用自耦電離突破比較酸式鹽溶液中粒子濃度大小的誤區(qū)
□ 海南中學 羅書昌 陳 輝 顏輔佐 許葉陽 謝靚宇 陳垂富
一、發(fā)現(xiàn)誤區(qū)
天一文化命制的海南省2021-2022 學年高三學業(yè)水平診斷[1](三)化學學科第13 題,已知亞磷酸(H3PO3)是二元弱酸,298K 時的電離常數(shù)分別為:Ka1=10-1.4,Ka2=10-6.7。298K 時,向1L0.2mol·L-1NaH2PO3溶液中通入HCl氣體。其中A選項,0.2mol·L-1NaH2PO3溶液中:c(H2PO3-)>c(H+)>c(HPO32-)>c(H3PO3)。命題者提供的參考答案:A選項正確。命題透析:本題以酸式鹽與酸的反應為情境,考查電離平衡與離子濃度大小比較等知識,意在考查考生的綜合分析能力,變化觀念與平衡思想的核心素養(yǎng);思路點撥:根據(jù)電離常數(shù)知,H2PO3-的水解常數(shù)Kh=Kw/Ka1=10-14÷10-1.4=10-12.6<Ka2=10-6.7,故H2PO3-的電離程度大于水解程度,A項正確。
本題A選項中離子濃度大小比較是錯誤的,解析也不清楚,H2PO3-的電離程度大于水解程度,只能說明c(HPO32-)>c(H3PO3),但是c(H+)與c(HPO32-)、c(H3PO3)的大小關系沒有解釋,且c(H2PO3-)>c(H+)>c(HPO32-)>c(H3PO3)排序是錯誤的,NaH2PO3溶液中離子濃度的大小關系正確的是:c(Na+)>c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-),為什么呢?可以從微觀探析和定量計算兩個方面準確解析。
二、微觀探析
首先要清楚0.2mol·L-1NaH2PO3溶液中存在的平衡體系,并分析其反應程度的相對大小,確立其主次矛盾。第一個平衡體系(自耦電離),,其平衡常數(shù);第二個平衡體系,,其平衡常數(shù)Ka2=10-6.7;第三個平衡體系,H3PO3-+H2OH3PO3+OH-,其平衡常數(shù)Kh=Kw/Ka1=10-14÷10-1.4=10-12.6;第四個平衡體系,H2OH++OH-,其平衡常數(shù)Kw=10-14。因為溶液中c(H2PO3-)大,同時根據(jù)四個平衡體系的平衡常數(shù)Kc>Ka2>Kh>Kw,亞磷酸氫根離子自耦電離程度最大,c(HPO32-)和c(H3PO3)較大;又因為H2PO3-的水解常數(shù)Kh=Kw/Ka1=10-14÷10-1.4=10-12.6<Ka2=10-6.7,H2PO3-的電離程度大于水解程度,綜合可知c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-)。本題命題者沒有分析清楚0.2mol·L-1NaH2PO3溶液中的主要平衡體系即亞磷酸氫根離子自耦電離,沒有抓住問題的主要矛盾,導致比較c(H2PO3-)、c(HPO32-)、c(H3PO3)、c(H+)、c(OH-)大小時出現(xiàn)錯誤。
三、定量計算
可以借助武漢大學主編《分析化學》[2](第六版)上冊第126 頁酸式鹽中氫離子濃度計算公式以及第117 頁多元酸溶液中各組分的分布系數(shù),準確計算出0.2mol·L-1NaH2PO3溶液中c(H2PO3-)、c(HPO32-)、c(H3PO3)、c(H+)、c(OH-),可以證明我們微觀探析的結論。
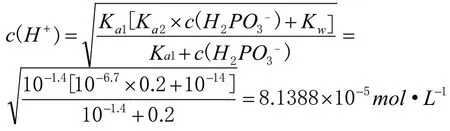
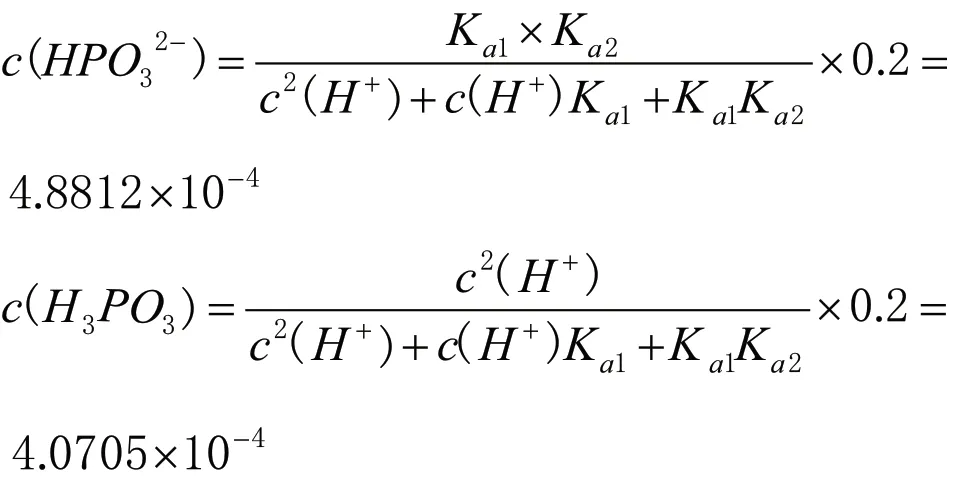
c(OH-)=Kw/c(H+)=1.2287×10-10
根據(jù)計算結果,易得出0.2mol·L-1NaH2PO3溶液中微粒濃度大小關系為:c(H2PO3-)>c(HPO32-)>c(H3PO3)>c(H+)>c(OH-),與微觀分析結果相互證明。
四、拓展研究
《三維設計新課程·高中總復習(化學)》第154頁,典題示例2 寫出0.1mol·L-1NaHSO3溶液中微粒濃度大小關系,提供的參考答案為c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),是存在錯誤的。《高考調(diào)研·新課標高中總復習(化學)》也給出0.1mol·L-1NaHSO3溶液中微粒濃度大小關系為c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),0.1mol·L-1NaHCO3溶液中微粒濃度大小關系為c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+),也是存在錯誤的。李春文[3]和陳天賜[4]等老師總結了相關規(guī)律,中學階段學習的顯酸性的酸式鹽有NaHSO3和NaH2PO4等,判斷離子濃度大小關系,即不電離離子>電離離子>顯性離子>弱酸根離子>水電離產(chǎn)生的另一種離子;顯堿性的酸式鹽有NaHCO3和NaHS等,判斷離子濃度大小關系,即不水解離子>水解離子>顯性離子>水電離出的另一離子>電離得到的酸根離子,不過也沒有考慮酸式鹽中酸式酸根離子自耦電離程度相對較大的主要因素,導致出現(xiàn)不完全正確的規(guī)律。這些問題同樣可以用微觀探析和定量計算來解決。
1.0.1mol·L-1NaHSO3 溶液
首先要清楚25℃,0.1mol·L-1NaHSO3(25℃,Ka1=1.4×10-2,Ka2=6.0×10-8)[5]溶液中存在的平衡體系,并分析其反應程度的相對大小。第一個平衡體系(自耦電離),HSO3-+HSO3-SO32-+H2SO3,其平衡常數(shù)Kc=Ka2/Ka1=6.0×10-8÷(1.4×10-2)=4.3×10-6;第二個平衡體系,HSO3-SO32-+H+,其平衡常數(shù)Ka2=6.0×10-8;第三個平衡體系,HSO3-+H2OH2SO3+OH-,其平衡常數(shù)Kh=Kw/Ka1=10-14÷(1.4×10-2)=7.1×10-13;第四個平衡體系,H2OH++OH-,其平衡常數(shù)Kw=10-14。因為溶液中c(HSO3-)大,同時根據(jù)四個平衡體系的平衡常數(shù)Kc>Ka2>Kh>Kw,亞硫酸氫根離子自耦反應程度最大,c(SO32-)和c(H2SO3)較大;又因為HSO3-的水解常數(shù)Kh=Kw/Ka1=10-14÷10-1.4=10-12.6<Ka2=10-6.7,HSO3-的電離程度大于水解程度,綜合可知c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)>c(H+)>c(OH-)。再運用相關公式計算c(SO32-)、c(H2SO3)和c(H+)。
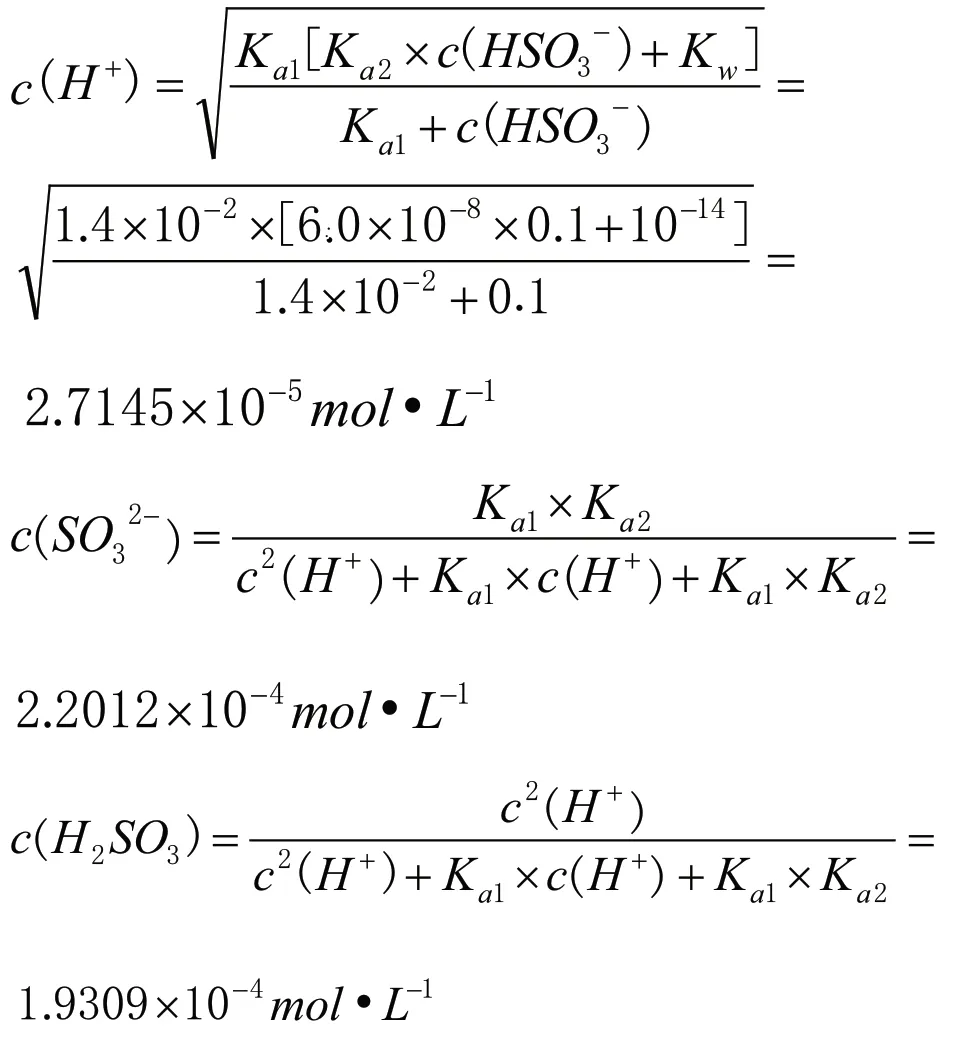
經(jīng)定量計算可以得出0.1mol·L-1NaHSO3溶液中各微粒濃度大小關系為:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)>c(H+)>c(OH-)。
2.0.1mol·L-1NaHCO3 溶液
同樣首先要清楚25℃,0.1mol·L-1NaHCO3(25℃,Ka1=4.5×10-7,Ka2=4.7×10-11)[5]溶液中存在的平衡體系,并分析其反應程度的相對大小。第一個平衡體系(自耦電離),HCO3-+HCO3-CO32-+H2CO3,其平衡常數(shù)Kc=Ka2/Ka1=4.7×10-11÷(4.5×10-7)=1.04×10-5;第二個平衡體系,HCO3-+H2OH2CO3+OH-,其平衡常數(shù)Kh=Kw/Ka1=10-14÷(4.5×10-7)=2.2×10-8;第三個平衡體系,HCO3-CO32-+H+,其平衡常數(shù)Ka2=4.7×10-11;第四個平衡體系,H2OH++OH-,其平衡常數(shù)Kw=10-14。因為溶液中c(HCO3-)大,同時根據(jù)四個平衡體系的平衡常數(shù)Kc>Kh>Ka2>Kw,碳酸氫根離子自耦反應程度最大,c(CO32-)和c(H2CO3)較大,這就容易解釋2020年海南高考試題中可以用加熱飽和NaHCO3溶液制二氧化碳或在NaHCO3溶液中加氯化鈣或氯化鋇溶液有白色沉淀的現(xiàn)象;又因為HCO3-的水解常數(shù)Kh>Ka2,HCO3-的水解程度大于電離程度,溶液呈堿性,綜合可知c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)>c(OH-)>c(H+)。再運用相關公式計算c(H2CO3)、c(CO32-)和c(OH-)。
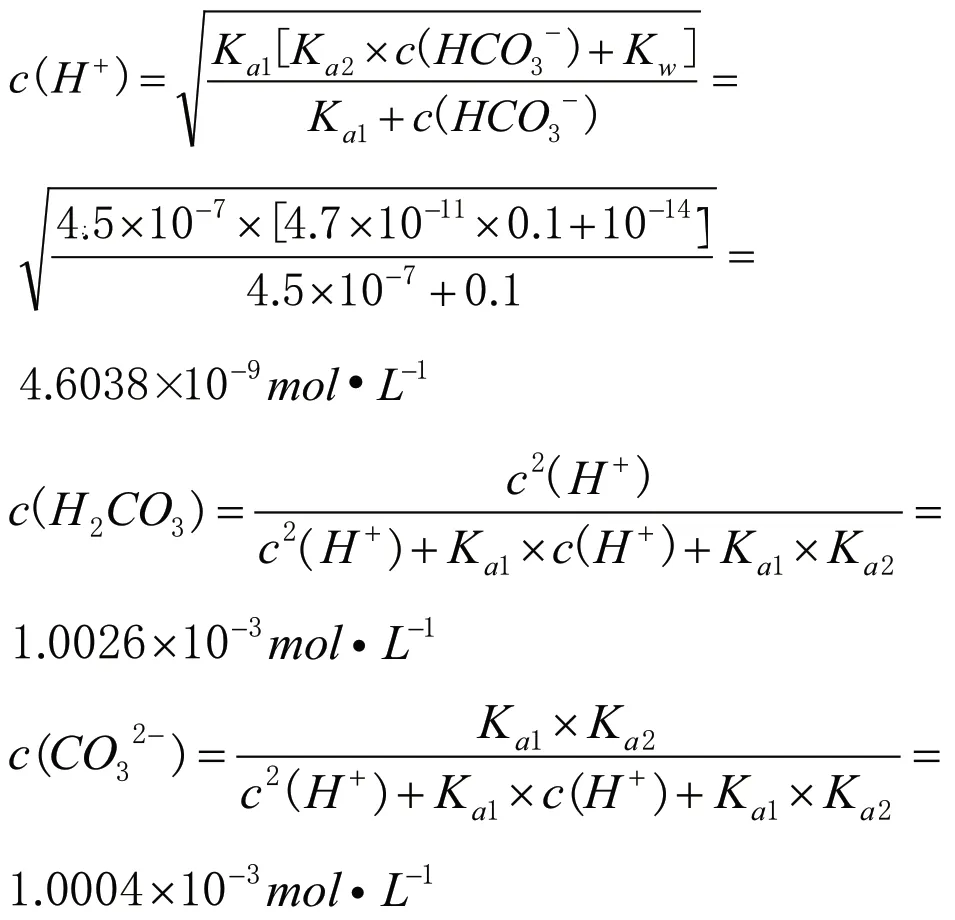
經(jīng)定量計算可以得出0.1mol·L-1NaHCO3溶液中各微粒濃度大小關系為:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)>c(OH-)>c(H+)。
經(jīng)微觀探析和定量計算,李春文和陳天賜等老師總結的相關規(guī)律可修改為,中學階段學習的酸式鹽稀溶液(0.001mol·L-1 本文抓住酸式鹽稀溶液中因酸式酸根電離和水解相互促進使酸式酸根自耦電離程度較大的主要因素,解決了酸式鹽稀溶液各微粒濃度大小關系中的誤區(qū),再通過微觀探析和定量計算推導和證明酸式鹽稀溶液各微粒濃度大小關系。建立比較酸式鹽稀溶液各微粒濃度大小關系的基本模型:當電離程度大于水解程度,各微粒濃度大小關系為不電離離子>電離離子>弱酸根離子>弱酸分子>顯性離子>水電離產(chǎn)生的另一種離子,如0.1mol·L-1NaHSO3溶液中各微粒濃度大小關系為:c(Na+)>c(HSO3-)>c(SO32-)>c(H2SO3)>c(H+)>c(OH-);當水解程度大于電離程度,各微粒濃度大小關系為不水解離子>水解離子>弱酸分子>電離得到的酸根離子>顯性離子>水電離出的另一離子,如0.1mol·L-1NaHCO3溶液中各微粒濃度大小關系為:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)>c(OH-)>c(H+)。 酸式鹽稀溶液中各微粒濃度大小關系問題對于中學生而言過于復雜,定量計算更不作要求,高考命題專家的處理方式值得我們學習。筆者研究近十年高考真題,發(fā)現(xiàn)命題專家沒有比較酸式鹽稀溶液中c(OH-)和c(H+)與其他微粒濃度的大小關系,精準把控其難度,比如:2019 年江蘇高考真題0.2mol·L?1NH4HCO3溶液(pH>7):c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3·H2O),2012年四川高考真題pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)等。故在命制試題或設計作業(yè)時,教師要認真研讀課程標準和高考真題,設計出科學的有利于培養(yǎng)學生核心素養(yǎng)的試題或作業(yè),減輕學生負擔,提高教學質(zhì)量。五、研究結論

