37批諾氟沙星膠囊檢測結果分析
*周卓杰 吳愫青 熊瑛
(廣東省珠海市食品藥品檢驗所 廣東 519000)
諾氟沙星為氟喹諾酮類抗菌藥,具廣譜抗菌作用,尤其對需氧革蘭陰性桿菌的抗菌活性高,適用于敏感菌所致的尿路感染、淋病、前列腺炎、腸道感染和傷寒及其他沙門菌感染,目前已經有膠囊劑、軟膏劑、片劑和滴眼劑等類型[1],已廣泛應用于臨床。本文抽取的37批諾氟沙星膠囊來源于珠海市市場監督管理局2016年至2021年對珠海各地區藥房和醫院的日常抽檢和國家基藥抽檢,其中,2016年抽取了9批,涉及7個廠家;2017年抽取了3批,涉及3個廠家;2018年抽取了5批,涉及5個廠家;2019年抽取了6批,涉及6個廠家;2020年抽取了9批,涉及5個廠家;2021年抽取了5批,涉及5個廠家。因此,通過這5年抽取的37批諾氟沙星膠囊的檢驗結果,可以有效來分析珠海市地區這幾年售賣的諾氟沙星膠囊的質量狀況,考察其有效性和穩定性,為將來監管諾氟沙星膠囊做參考。
1.樣品信息和檢驗依據
(1)樣品信息和結果來源
本次分析的37批諾氟沙星膠囊檢測結果,是由珠海市食品藥品檢驗所從2016年至2021年檢測在珠海各區域抽檢的諾氟沙星膠囊所得,規格均為0.1g,其中涉及16個生產單位,合格率為97.3%。
(2)檢驗依據
依據《中國藥典》2015年二部1198頁諾氟沙星膠囊的標準進行檢測,有性狀、鑒別、有關物質、溶出度、裝量差異和含量測定共6個檢測項目,其中鑒別中鑒別1和鑒別2選做其一,溶出度使用紫外分光光度法,有關物質和含量測定使用高效液相色譜法。
2.儀器與試劑
(1)儀器。Waters 2695高效液相色譜儀,XS 205梅特勒電子分析天平,天大天發RCZ 8M智能溶出試驗儀,安捷倫708 DS自動取樣溶出度儀,島津UV-2600紫外分光光度計。
(2)試劑。諾氟沙星對照品(中檢院提供批號:1304 50-201206,含量:99.5%),環丙沙星對照品(中檢院提供批號:130451-201203,含量:84.2%),依諾沙星對照品(中檢院提供批號:0452-9901,含量:91.1%),諾氟沙星雜質A對照品(中檢院提供批號:130610-201001,含量:99.4%),乙腈、鹽酸、磷酸、三乙胺、冰醋酸、氫氧化鈉,其中乙腈為色譜純,其余為分析純。
3.檢驗標準和結果
(1)性狀
標準規定為本品內容物為白色至淡黃色顆粒或粉末。其中有14批內容物為白色顆粒或粉末,23批內容物為淡黃色顆粒或粉末,均符合規定。
(2)鑒別
鑒別1為化學反應,鑒別2則為液相色譜鑒別,鑒別1和鑒別2選做一項,為提高檢驗效率,一般選擇鑒別2,鑒別2規定:在含量測定項下記錄的色譜圖中,供試品溶液主峰的保留時間應與對照品溶液主峰的保留時間一致。檢驗結果:37批諾氟沙星膠囊的供試品溶液主峰保留時間皆與對照品溶液主峰保時間一致,均符合規定。圖1為其中一批諾氟沙星膠囊的供試品溶液和對照品溶液的色譜圖對比。

圖1 含量測定色譜圖
(3)有關物質
標準規定為供試品溶液色譜圖中如有雜質峰,雜質A(262nm檢測)按外標法計算,不得過0.2%;單雜(278nm檢測)不得大于對照溶液主峰面積,其他單雜的和(278nm檢測)不得大于對照溶液主峰面積的2倍(1.0%)。結果顯示:37批的雜質A含量都在0.05%以下,單雜結果在0%~0.4%之間,其他單雜的和結果在0%~0.6%之間,均符合規定,具體數值見表1,圖2為有關物質項下的代表性圖譜。

圖2 有關物質色譜圖
(4)溶出度
諾氟沙星膠囊的溶出度標準規定:限度為標示量的75%。在37批諾氟沙星膠囊中,有36批溶出結果符合規定,但有一批在限度范圍以下,不符合規定,具體數值見表1。膠囊劑的溶出度影響因素比較多,除了輔料,溶出介質等常規因素會影響結果,膠囊殼也會影響其溶出的結果。一旦溶出度不合格,反應的問題是可能服用后藥物成分從制劑中釋放的速度和量不能按照藥物設計時的規律實現,被人體吸收的藥量達不到或者超過標準,藥效不穩定,容易產生不良事件。查閱了多篇文獻后,總結了主要影響諾氟沙星膠囊溶出度的三個因素:①沉降籃的使用,可以避免諾氟沙星膠囊浮在溶出介質液面或者黏在溶出杯上引起的溶出誤差。②輔料的選擇輔料的親水性和疏水性會影響水性介質與輔料的接觸角度,從而影響活性成分的溶出。③膠囊殼的選擇膠囊殼在溶出介質中溶解的快慢,也會影響到活性成分接觸到溶出介質的時間,從而影響溶出度的結果[3-5]。
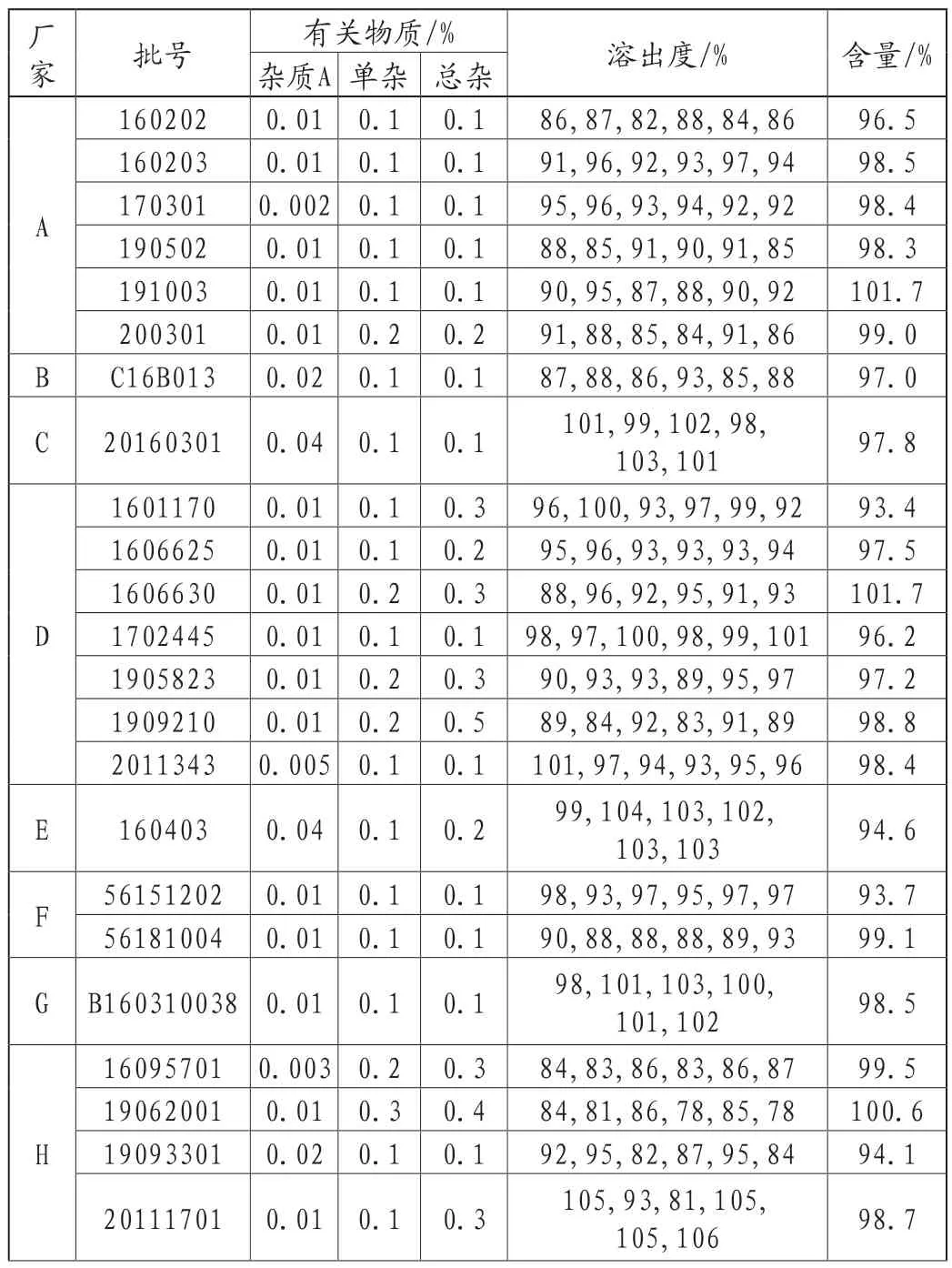
表1 37批諾氟沙星膠囊檢驗結果

續表
(5)裝量差異
膠囊劑要檢查其裝量差異,一來為了控制好每粒膠囊劑的藥量,減少因藥量引起不良反應事件的發生,二來從側面一定程度反映了該廠的品控能力。標準規定:取供試品20粒,分別精密稱定重量,傾出內容物(不得損失囊殼),硬膠囊囊殼用小刷或其他適宜的用具拭凈,再分別精密稱定囊殼重量,求出每粒內容物的裝量與平均裝量。每粒裝量與平均裝量相比較,超出裝量差異限度的不得多于2粒,并不得有1粒超出限度1倍。結果:均符合規定,具體數值見圖3,諾氟沙星膠囊的規格目前只有0.1g一種,從圖3可以看出,裝量主要集中在0.1901~0.2300g之間,說明大部分廠家的生產諾氟沙星內容物的工藝在此區間。
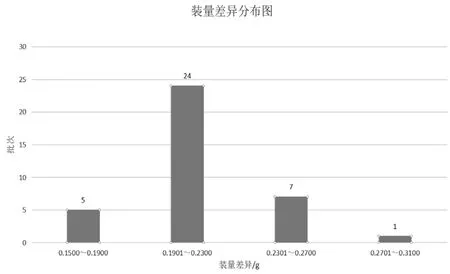
圖3 裝量差異分布圖
(6)含量測定
照高效液相色譜法(通則0512)測定,色譜條件與系統適用性試驗:用十八烷基硅烷鍵合硅膠為填充劑;以0.025mol/L磷酸溶液(用三乙胺調節pH值至3.0±0.1)-乙腈(87:13)為流動相,檢測波長為278nm。稱取諾氟沙星對照品、環丙沙星對照品和依諾沙星對照品各適量,加0.1mol/L鹽酸溶液適量使溶解,用流動相稀釋制成每1ml中含諾氟沙星25μg、環丙沙星和依諾沙星各5μg的混合溶液,取20μl注入液相色譜儀,記錄色譜圖,諾氟沙星峰的保留時間約為9min。諾氟沙星峰與環丙沙星峰和諾氟沙星峰與依諾沙星峰間的分離度均應大于2.0。然后取本品的細粉適量(約相當于諾氟沙星125mg),精密稱定,置500ml量瓶中,加0.1mol/L鹽酸溶液10ml使溶解后,用水稀釋至刻度,搖勻,精密量取續濾液5ml,置50ml量瓶中,用流動相稀釋至刻度,搖勻,作為供試品溶液,精密量取20μl注入液相色譜儀,記錄色譜圖;另取諾氟沙星對照品,同法測定,按外標法以峰面積計算,即得[2]。標準規定:本品含諾氟沙星(C16H18FN3O3)應為標示量的90.0%~110.0%。結果:37批諾氟沙星膠囊的含量均符合規定,在93.4%~104.2%之間,具體數值見表1。
4.討論
從2016年至2021檢驗的37批諾氟沙星膠囊實驗結果看出,諾氟沙星膠囊品質情況總體較好,除了L廠家的溶出度不及格,其余廠家均符合規定,合格率為97.3%,較好的證明了這幾年珠海市市場售賣的諾氟沙星膠囊的品質,保證了市民的用藥安全。但同時從表1可以看出不同批次不同廠家生產的諾氟沙星膠囊質量良莠不齊,希望可以通過這次37批諾氟沙星膠囊實驗數據的分析,不僅可以對現狀做出評價,還可以為將來監督管理諾氟沙星膠囊做出參考價值。
37批諾氟沙星膠囊中有關物質項目基本符合規定,但個別藥廠的單個雜質和其他單個雜質的總和偏大,比較接近限度值,而藥物某些雜質與藥物的不良反應有密不可分的關系,所以減少和降低有關物質的雜質含量在保證藥品安全有效上顯得尤為重要,而雜質的來源通常是原料,化學反應的副產物,降解產物等原因[6],所以藥廠要降低雜質的含量,就得從生產該品種的每一個步驟進行嚴格的把控;另一方面,在國外標準中,已經有檢測諾氟沙星有關物質中的雜質E和雜質K的標準[7],而《中國藥典》2015版暫時只有雜質A的檢測,在國內也有研究表明,部分的國產諾氟沙星膠囊的雜質E超標[8],因此,如果能加入對雜質E和雜質K的檢測,便能更好的有效控制諾氟沙星膠囊的質量。
在溶出度項目中,雖然除了L廠,其他都符合規定,但其實平均溶出度低于90%總共有12批,占32.4%,溶出度是體外評價樣品質量、判斷藥物療效的有效藥學研究手段,在一定程度上反應了藥物在人體釋放藥物量的多少,所以要重視溶出度這個項目。
經查詢,L廠是個大規模的藥廠,并且諾氟沙星膠囊是主打產品,然而在這種情況下,仍出現了溶出度不及格的事故,并且在同年該廠的諾氟沙星膠囊的不同批次在別的地方藥檢所依然檢測到溶出度不合格,進行了通報批評并整改,說明該廠的諾氟沙星膠囊溶出度不合格不是一個偶然事件,希望該廠能在輔料和膠囊殼的上重新做出合理的選擇,有效的保障諾氟沙星膠囊的溶出度。
在含量測定這個項目上,從表1也可以看出,結果均符合規定,大部分結果處于95%~105%之間,但還有5批含量低于95%,而某些相同藥廠的不同批次質量控制不好,差異比較大,而不同藥廠之間的藥品質量差異更加明顯,這表明了各藥廠需要完善制藥的工藝,提高藥物的質量[9],保證藥品質量的穩定性,確保廣大人民的用藥安全。

