靶向腸道菌群改善失眠的研究進展及展望
田培郡,蔣嬌娜,呂天鳳,王榮,王剛,陳衛
(江南大學 食品學院,江蘇 無錫,214122)
據統計,人的一生中約有1/3的時間處于睡眠狀態。睡眠是生物體的基本功能,對維持正常生理活動具有十分重要的作用。高質量的睡眠不僅有助于提高生活質量,而且在緩解疲勞、恢復體力、修復神經元、鞏固記憶、維持代謝穩態等方面發揮著不可忽視的作用[1]。不同年齡段人群對睡眠時間的需求各不相同,正常成年人的正常睡眠時間大約在7~8 h[2]。研究表明,良好的睡眠可以降低某些慢性疾病的發病率;反之,睡眠不足則影響多種生理功能,例如認知、情緒、免疫、生殖功能等[3]。
1 失眠導致的公共衛生問題
失眠,是一種不容易自然地進入睡眠狀態的癥狀,以難以入睡或是無法維持睡眠為主要特征,在臨床上,持續3個月具有夜間入睡困難、睡眠時間減少、日間嗜睡、注意力和記憶力下降等癥狀可被診斷為失眠。據世界衛生組織調查表明,全球睡眠障礙發病率達到27%,其中失眠問題占據最主要因素[4]。新型冠狀病毒肺炎全球大流行爆發以來,世界各國的失眠問題進一步惡化。張帆等[5]調查發現,在新型冠狀病毒肺炎大規模爆發后的第一階段,約44.1%的中國人存在睡眠障礙;有過隔離史的人比未參與隔離的人睡眠障礙的發病率高約7%[6]。在2020年前5個月,美國在谷歌搜索引擎上“失眠”的搜索量比前3年同期增加了58%[7]。2020年希臘的一項調查表明,37.6%的被調查者存在睡眠問題,遠高于疫情前的失眠患病率[8]。此外,部分失眠患者的失眠癥狀持續加強,繼而引發了多種并發癥,例如抑郁癥、阿爾茲海默癥、糖尿病、心血管疾病等,這給世界公共衛生體系和人類生命質量帶來了巨大的挑戰[9-10]。
2 失眠的病理學機制及其治療策略
2.1 失眠的病理學機制
臨床上將失眠分為原發性失眠和繼發性失眠。繼發性失眠是由包括軀體疾病、精神障礙、藥物濫用、睡眠呼吸紊亂等引起的失眠;原發性失眠的診斷缺乏特異性指標,主要是一種排除性診斷[11]。目前,關于失眠的發病機制并不清晰,但科學家普遍認為其是一個受多因素影響的慢性疾病。現有的關于失眠的病理學機制主要包括以下幾個方面(圖1):
2.1.1 神經遞質系統紊亂
神經遞質的合成和分泌功能紊亂是引起失眠的重要原因之一,包括褪黑素(melatonin, MT),5-羥色胺(5-hydroxytryptamine, 5-HT),γ-氨基丁酸(γ-aminobutyric acid, GABA)以及去甲腎上腺素(norepinephrine, NE)等[12]。MT是由色氨酸合成的抑制性神經遞質,是人體內調控睡眠和覺醒的重要物質之一,其主要通過激活2種高親和力G蛋白偶聯受體MT1和MT2來調節睡眠和覺醒;人體內MT合成和分泌的失調是導致失眠的重要原因之一[12]。作為MT形成的重要前體物質,5-HT與人體晝夜節律和睡眠障礙等密切相關,通過與腦內5-HT1A受體、5-HT2受體作用或輕度激動5-HT1A受體或拮抗5-HT2受體均可增加深睡眠,并且兩者之間具有協同作用[13]。GABA是大腦中重要的抑制性神經遞質,主要功能為維持腦內興奮和抑制的平衡,其在大腦內合成不足,則會引起腦內抑制功能不足,出現持續興奮,進而引起失眠[14]。
2.1.2 “下丘腦-垂體-腎上腺軸”系統紊亂
下丘腦-垂體-腎上腺(hypothalamic-pituitary-adrenal, HPA)軸,是神經內分泌系統的重要組成部分,在調節人體免疫系統、心情、情緒以及晝夜節律等方面具有重要作用[15]。睡眠,尤其是深度睡眠,對HPA軸的活動具有抑制作用,而當促腎上腺皮質激素和皮質醇分泌增加,HPA軸被激活則可導致覺醒和失眠[16]。除HPA軸被過度激活引起失眠癥狀的發生外,HPA軸與機體內炎癥因子的相互作用也是導致失眠發生發展的重要誘因,如慢性疾病、睡眠呼吸障礙、嗜睡等導致的體內炎癥因子過度表達會引起HPA軸功能紊亂,而HPA軸的進一步紊亂又會反作用于與炎癥相關的睡眠障礙[17]。由于HPA軸在神經系統中的重要作用,其功能的紊亂還會引起多種神經系統疾病的發生,這些HPA軸相關疾病,會促進失眠等睡眠障礙問題的加劇。

圖1 失眠的病理學機制Fig.1 Pathological mechanism of insomnia
2.1.3 社會環境與心理因素
除生理上導致的失眠外,外界社會環境和心理因素也是導致失眠的重要因素,如壓力、焦慮、環境變化以及飲食方式等[18]。當一個人長時間處于壓力狀態下,更容易引起抑郁,焦慮等心理疾病的發生,這些心理問題會進一步促進失眠和其他睡眠問題的出現[19]。人的睡眠質量容易受到外界環境的影響,環境噪聲過大、光照刺激過強、溫度不適宜、環境的熟悉程度等因素都會使人入睡困難、睡眠易中斷,從而導致失眠;日常飲食也是引起失眠的重要非直接因素之一,如咖啡因和茶多酚不耐受的人群,過度攝入咖啡因、茶多酚等對神經系統具有刺激性的膳食因子會導致失眠的發生,但是這種暫時性的失眠可受個人行為的調節[20]。
2.2 失眠的治療手段
2.2.1 化學藥物治療
目前,化學藥物是臨床上治療失眠的主要手段之一。如苯二氮卓類藥物和Z-藥物(唑吡坦、佐匹克隆和扎萊普隆),主要通過作用于GABA途徑調節失眠患者的睡眠質量;阿莫美拉汀、延緩釋放的MT等主要作用于MT和食欲素神經元途徑,促進入睡或提高睡眠深度;組胺和5-HT受體拮抗劑等則直接作用于5-HT途徑[21]。雖然化學藥物的治療具有價格低、效果快的特點,并取得了一定的治療效果,但其副作用同樣令人擔憂。尤其是患者長期服用,在產生依賴性和耐受性的同時,造成一些神經損傷,一旦停止使用,可能會產生戒斷反應,或對服用者的精神狀態造成損傷[22]。因此尋找一種高效、低毒副作用的失眠治療方法迫在眉睫。
2.2.2 非藥物治療
除直接采用化學藥物治療外,非藥物治療也是一種有效治療失眠的手段,包括改善睡眠習慣、睡眠環境和心理疏導等[23]。此外,傳統中醫治療,如針灸、穴位法以及中藥熏香等對部分失眠患者同樣展示出顯著的治療效果[24]。非藥物治療雖然取得了一定的治療效果,但是存在治療效果不穩定、個體差異大、治愈率低等缺點,且極容易受到外界干擾、易反復。
3 靶向腸道菌群改善失眠的理論探索及應用前景
3.1 腸道微生物調控睡眠的途徑及機制
近年來大量研究發現,腸道菌群失調與睡眠障礙之間存在強相關性[25]。2016年一項研究表明,睡眠中斷導致的晝夜節律紊亂顯著地改變了小鼠的腸道菌群組成[26]。晝夜節律也稱為生物鐘,是由宿主建立以適應環境中的明暗循環,以24 h為周期波動變化,對人體生理穩態和健康至關重要;而睡眠與晝夜節律緊密聯系,晝夜節律的紊亂會引起失眠、睡眠碎片化等睡眠問題[27]。持續4周的廣譜抗生素治療在剝奪小鼠腸道菌群的同時,也顯著減少了小鼠非快速眼動(non-rapid eye movement, NREM)睡眠的時間,而快速眼動(rapid eye movement, REM)睡眠時間增多;這表明,腸道菌群的改變也能影響睡眠的質量。進一步的分析表明,這種現象與腸道菌群代謝產物中神經傳遞相關的氨基酸和維生素代謝異常存在顯著相關性[28]。臨床研究中也發現了類似的現象。失眠患者的腸道菌群多樣性、厭氧菌和短鏈脂肪酸(short chain fatty acid, SCFA)產生菌的豐度顯著低于健康人群;其特征菌屬Lachnospira和Bacteroides的豐度與血清中IL-1β的水平呈顯著正相關[29]。另一項基于嬰兒的隊列分析表明,腸道菌群產生的SCFA含量(尤其是丙酸)與嬰兒睡眠時間存在正相關性[30]。值得注意的是,一項針對腸易激綜合征(irritable bowel syndrome, IBS)患者的糞菌移植研究發現,移植了健康人糞便的IBS患者,其抑郁樣/焦慮癥狀得到顯著緩解的同時,睡眠質量也顯著提高[31]。盡管以上報道的證據無法證明睡眠問題和腸道菌群組成之間的因果關系,但不可否認的是,腸道菌群可能是參與調控睡眠的一個重要靶點。
伴隨著菌群-腸-腦軸理論的成熟,腸道微生物被證明可能通過以下幾種機制與大腦進行交流,從而調控睡眠功能。(1)調節血清素系統:血清素(及其代謝產物MT)是生物體REM睡眠所必需的神經遞質,而腸道是人體產生血清素的最主要場所。腸道微生物的存在是腸道血清素合成的必要條件,更是調控外周-中樞血清素轉運系統的關鍵因素[32];(2)調節迷走神經和免疫系統:迷走神經是腸道微生物與中樞神經系統進行直接信號交流的最重要的神經。研究表明,迷走神經阻斷術能夠消除小鼠由于睡眠剝奪導致的全身性炎癥,這表明迷走神經激活參與睡眠及睡眠障礙伴隨的免疫功能異常[33];(3)調節血腦屏障:研究表明,連續10 d的睡眠剝奪導致大鼠血腦屏障通透性升高,而恢復睡眠后這種癥狀減輕[34]。已有證據表明,腸道菌群及其代謝產物(主要是乙酸)對血腦屏障的形成和維持至關重要[35];這表明腸道微生物可能通過調節血腦屏障間接地對睡眠功能發揮作用;(4)產生功能性代謝產物:腸道微生物能夠產生多種功能性代謝物,例如5-HT、GABA、SCFA等。這些代謝物不僅直接作用于腸道神經系統或迷走神經,還能通過在循環系統中的波動水平,對宿主的生物節律發揮直接作用。SATEIA等[36]發現慢性抗生素治療小鼠腸道中抑制性神經遞質甘氨酸和GABA增加,其睡眠/覺醒周期也顯著改變,但目前關于口服GABA調控睡眠的證據尚不充足。腸道微生物和睡眠溝通機制與途徑總結如圖2所示。
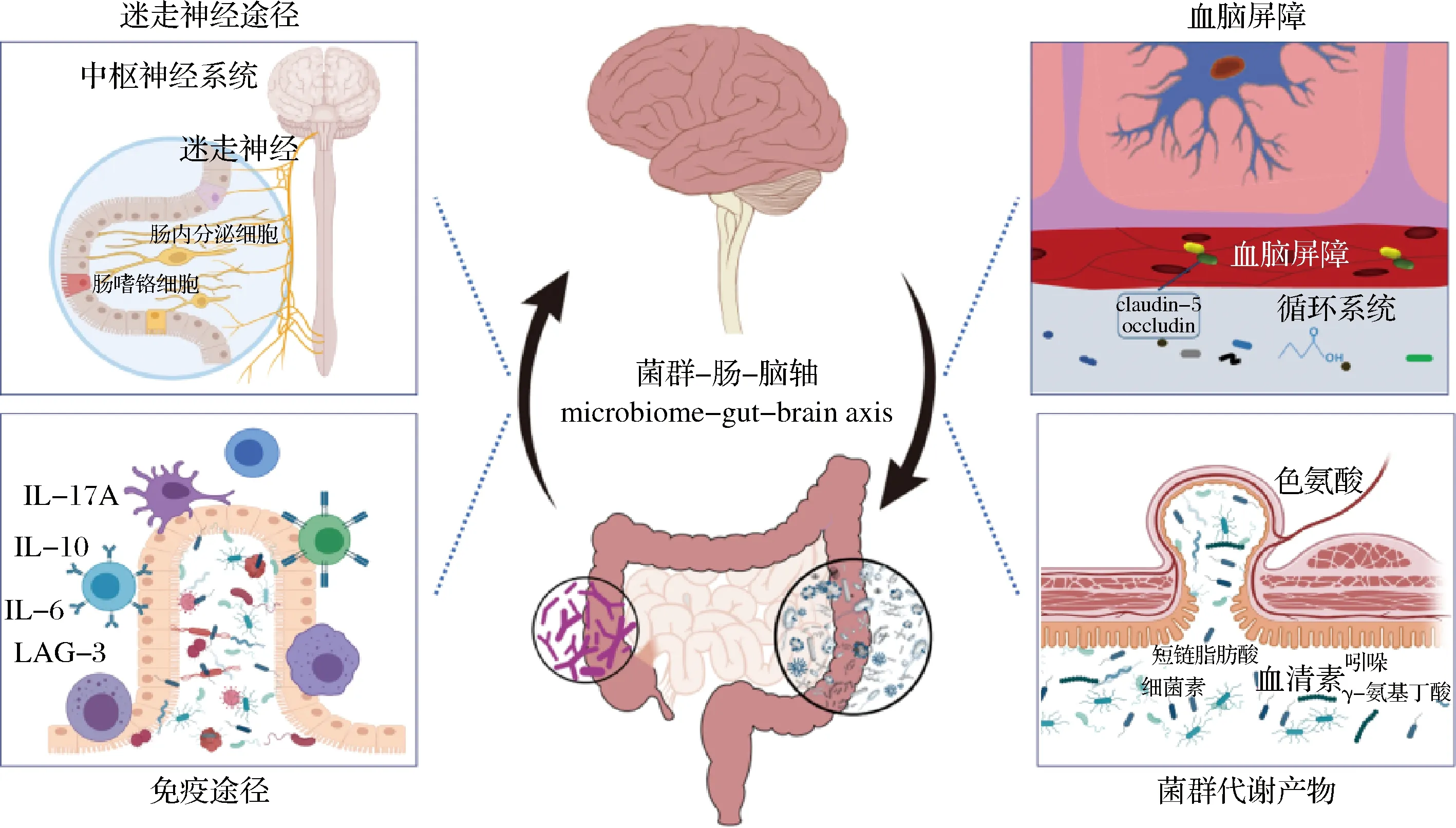
圖2 腸道微生物調控睡眠的可能機制和途徑Fig.2 Possible mechanisms and pathways by which gut microbes regulate sleep
3.2 膳食策略改善失眠的應用總結
由上文可見,失眠與腸道菌群有著緊密聯系。因此,調節腸道菌群可能是治療失眠的一種潛在策略。近年來,科學家們也開始了應用膳食手段改善失眠的探索,其中最主要的代表為益生菌[25]。益生菌改善失眠的主要途徑包括:(1)直接改變腸道微生物菌群的豐度和物種多樣性,恢復失眠障礙引起的腸道微生物群紊亂,進而通過恢復腸道菌群穩態,發揮調節失眠的生物學作用;(2)通過調節腸道中某些特殊菌群的功能,如分泌SCFAs、代謝膽汁酸鹽等方式間接調節腸-腦軸功能,進而改善失眠患者的癥狀。除益生菌外,其他膳食因子也具有改善睡眠質量和調節睡眠障礙的生理作用,如功能性蛋白質、不飽和脂肪酸、氨基酸等。目前關于膳食模式(例如高蛋白飲食、高纖維飲食等)與睡眠功能相關性的研究十分匱乏,這也為后續膳食營養學研究提供了新的思路。有助于改善睡眠的膳食因子的作用效果和具體機制總結如表1所示。

表1 膳食因子調節睡眠的作用與潛在機制Table 1 Effect of nutritional factors on regulating the sleep and its potential mechanisms
4 總結和展望
菌群-腸-腦軸作為中樞神經和腸神經之間的雙向信息交互系統,對于人體的許多生理功能調控起重要作用。腸道微生物通過迷走神經傳入、免疫和微生物代謝產物等途徑作用于中樞神經系統,腸道菌群紊亂則會引發焦慮、抑郁、睡眠障礙等問題。同時,失眠與失眠并發癥會反作用于腸道神經系統,導致腸道菌群紊亂,形成惡性循環,從而進一步加深失眠問題。腸道菌群與睡眠障礙兩者間的相關研究表明,維持腸道菌群穩態是改善失眠問題的關鍵。通過益生菌等膳食策略,能夠調節菌群-腸-腦軸,達到改善失眠的目的。膳食治療建立在對腸道微生物與中樞神經系統的深入研究上,作為一種安全、有效、無副作用的治療手段,在未來對于治療失眠問題和多種失眠并發癥均有重要意義。

