正丁烷異構(gòu)化制異丁烷反應(yīng)熱力學(xué)分析及試驗(yàn)研究
劉洪全,于中偉,張秋平,王杰廣,馬愛增,孔令江,王子健
(中國(guó)石化石油化工科學(xué)研究院,北京 100083)
近年來(lái),隨著國(guó)內(nèi)異丁烷-丁烯烷基化[1]、異丁烷脫氫[2]、丙烷/異丁烷混合脫氫[3]以及異丁烷-丙烯共氧化[4]等裝置的建設(shè),異丁烷需求量逐年攀升。尤其隨著我國(guó)汽油標(biāo)準(zhǔn)的不斷升級(jí)[5],異丁烷-丁烯烷基化作為汽油升級(jí)不可或缺的技術(shù)之一[6],其產(chǎn)能快速擴(kuò)張[1,7],帶動(dòng)了異丁烷需求的大幅增長(zhǎng)。正丁烷異構(gòu)化是一種專產(chǎn)異丁烷的技術(shù),可將碳四資源中的正丁烷高效地轉(zhuǎn)化為異丁烷。因此,開發(fā)正丁烷異構(gòu)化技術(shù)對(duì)增產(chǎn)異丁烷和實(shí)現(xiàn)碳四資源的優(yōu)化利用有重要意義。
烷烴異構(gòu)化反應(yīng)需要在酸性催化劑的作用下進(jìn)行,正丁烷異構(gòu)化是碳鏈最短的烷烴異構(gòu)化反應(yīng)。由于正丁烷分子穩(wěn)定,活化和轉(zhuǎn)化能壘高,只有酸性足夠強(qiáng)的催化材料才能將正丁烷活化和異構(gòu)化,因此,正丁烷異構(gòu)化反應(yīng)還是表征催化材料酸性、研制高性能酸性催化劑的重要探針?lè)磻?yīng)[8]。
正丁烷異構(gòu)化的應(yīng)用前景和重要的學(xué)術(shù)價(jià)值吸引科研人員在本領(lǐng)域持續(xù)開展研究工作,并取得了一系列進(jìn)展[9]。從現(xiàn)有報(bào)道來(lái)看,正丁烷異構(gòu)化研究主要集中在反應(yīng)機(jī)理探究[10-12]、催化材料篩選[13-15]和催化劑改性[16-18]等方面,正丁烷異構(gòu)化反應(yīng)熱力學(xué)的研究較少[19]。熱力學(xué)研究是催化劑研制和新工藝開發(fā)不可或缺的手段。本研究旨在通過(guò)熱力學(xué)分析,計(jì)算正丁烷異構(gòu)化制異丁烷反應(yīng)的熱效應(yīng)和不同溫度下目標(biāo)反應(yīng)的標(biāo)準(zhǔn)平衡常數(shù)(Kθp),考察反應(yīng)條件對(duì)反應(yīng)平衡的影響,并與試驗(yàn)結(jié)果進(jìn)行對(duì)比,驗(yàn)證熱力學(xué)分析結(jié)果的可靠性,為催化劑研發(fā)和反應(yīng)工藝條件優(yōu)化提供理論依據(jù)。
1 熱力學(xué)計(jì)算
1.1 反應(yīng)的ΔrHθm、ΔrGθm和Kθp的計(jì)算
在正丁烷異構(gòu)化制異丁烷的反應(yīng)過(guò)程中,還存在著歧化、加氫裂化、脫氫、積炭等一系列副反應(yīng),形成了一個(gè)復(fù)雜的反應(yīng)網(wǎng)絡(luò)。要提高主反應(yīng)的轉(zhuǎn)化率和選擇性,催化劑體系的選擇至關(guān)重要。目前性能較好的正丁烷異構(gòu)化催化劑有兩大類,分別是氯化氧化鋁催化劑和固體超強(qiáng)酸催化劑。采用上述催化劑體系,并選擇合適的反應(yīng)條件,可有效抑制副反應(yīng),使正丁烷異構(gòu)化制異丁烷反應(yīng)選擇性超過(guò)90%[8]。鑒于此,本研究只選取主反應(yīng)進(jìn)行熱力學(xué)分析,不討論歧化等副反應(yīng)。此外,由于異丁烷和正丁烷的沸點(diǎn)較低,采用現(xiàn)有催化劑體系時(shí),正丁烷異構(gòu)化反應(yīng)溫度通常高于150 ℃,壓力通常低于2.5 MPa,在此反應(yīng)條件下,正丁烷和異丁烷的逸度與其壓力接近,可視為理想氣體。
以上述分析為前提,通過(guò)查閱物理化學(xué)數(shù)據(jù)手冊(cè)[20-21],可以獲得正丁烷異構(gòu)化反應(yīng)中各組分的標(biāo)準(zhǔn)摩爾生成焓、標(biāo)準(zhǔn)摩爾生成吉布斯自由能和等壓摩爾熱容等熱力學(xué)數(shù)據(jù)。利用這些熱力學(xué)數(shù)據(jù),參照已有的方法[22]進(jìn)行熱力學(xué)計(jì)算,可得到不同溫度下正丁烷異構(gòu)化制異丁烷反應(yīng)的標(biāo)準(zhǔn)摩爾焓變(ΔrHθm)、標(biāo)準(zhǔn)摩爾吉布斯自由能變(ΔrGθm)和Kθp,各溫度下的ΔrHθm,ΔrGθm,Kθp列于表1。
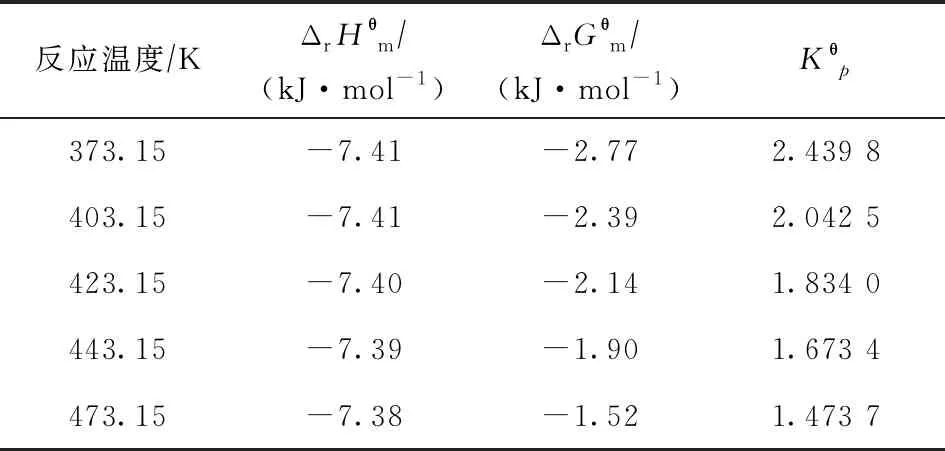
表1 不同溫度下正丁烷異構(gòu)化反應(yīng)的ΔrHθm,ΔrGθm,Kθp
從表1可知,不同反應(yīng)溫度下正丁烷異構(gòu)化反應(yīng)的ΔrHθm變化不大,約為-7.4 kJ/mol,與正戊烷異構(gòu)化反應(yīng)的ΔrHθm(約為-7.1 kJ/mol)[23]接近,由于焓變均為負(fù)值且絕對(duì)值很小,表明此類輕質(zhì)烷烴異構(gòu)化反應(yīng)為微放熱反應(yīng)。ΔrGθm和Kθp與反應(yīng)的平衡轉(zhuǎn)化率有關(guān),其中ΔrGθm的數(shù)值大小與平衡轉(zhuǎn)化率負(fù)相關(guān),而Kθp正好相反,與平衡轉(zhuǎn)化率正相關(guān)。
從表1還可以看出,ΔrGθm隨著反應(yīng)溫度的下降而減小,Kθp則逐漸增大,說(shuō)明降低反應(yīng)溫度對(duì)提高正丁烷異構(gòu)化反應(yīng)平衡轉(zhuǎn)化率有利。需要說(shuō)明的是,利用ΔrGθm雖然可以判斷目標(biāo)反應(yīng)達(dá)到平衡時(shí)的轉(zhuǎn)化程度,但不能判斷某一條件下反應(yīng)自發(fā)進(jìn)行的方向,只有通過(guò)反應(yīng)的摩爾吉布斯自由能變(ΔrGm)才能判斷[22]。對(duì)于正丁烷異構(gòu)化反應(yīng),如前所述,由于將正丁烷和異丁烷視為理想氣體,不同溫度下的ΔrGm可表示為:
ΔrGm(T)=ΔrGθm(T)+RTln(p異丁烷/p正丁烷)
(1)
式中,p正丁烷和p正丁烷分別為正丁烷和異丁烷的分壓,Pa。由式(1)可知,ΔrGm不僅與ΔrGθm有關(guān),還與正丁烷和異丁烷的分壓有關(guān),在給定反應(yīng)條件下,可根據(jù)正丁烷和異丁烷的分壓及反應(yīng)溫度計(jì)算ΔrGm并判斷反應(yīng)自發(fā)進(jìn)行的方向。
1.2 不同溫度下正丁烷平衡轉(zhuǎn)化率及正、異丁烷平衡摩爾分?jǐn)?shù)計(jì)算
正丁烷異構(gòu)化通常為臨氫反應(yīng),假設(shè)初始反應(yīng)條件為:反應(yīng)溫度T、反應(yīng)壓力p,以1 mol純正丁烷為原料,氫氣物質(zhì)的量為n,設(shè)反應(yīng)達(dá)到平衡時(shí)正丁烷的平衡轉(zhuǎn)化率為x,則平衡時(shí)正丁烷的分壓為p正丁烷=p(1-x)/(1+n),異丁烷的分壓為p異丁烷=px/(1+n)。因此Kθp可表示為:
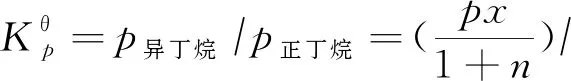
(2)
將表1中Kθp數(shù)值代入式(2),可計(jì)算出正丁烷的平衡轉(zhuǎn)化率以及正丁烷、異丁烷的平衡摩爾分?jǐn)?shù),結(jié)果見表2。
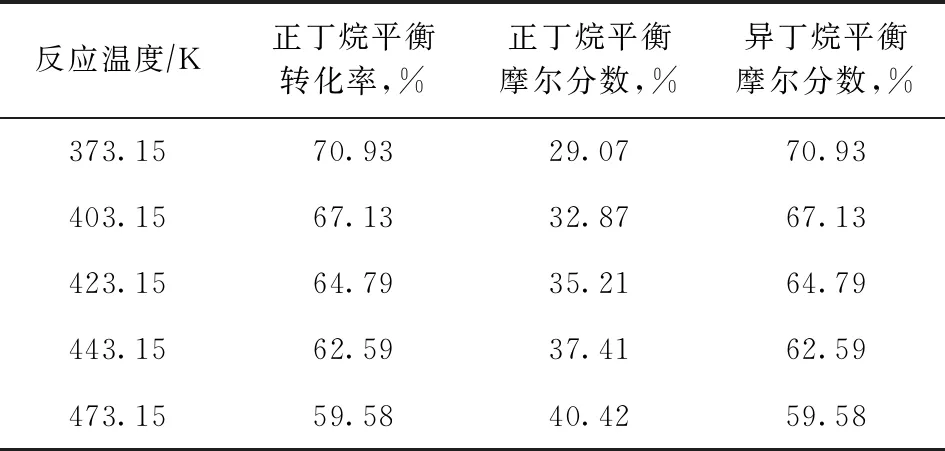
表2 不同反應(yīng)溫度下正丁烷的平衡轉(zhuǎn)化率和各組分的平衡摩爾分?jǐn)?shù)
由表2可知,將反應(yīng)溫度從473.15 K降至373.15 K,正丁烷異構(gòu)化生成異丁烷的平衡轉(zhuǎn)化率從59.58%提高到了70.93%,說(shuō)明降低反應(yīng)溫度對(duì)提高正丁烷異構(gòu)化的平衡轉(zhuǎn)化率有利。在實(shí)際反應(yīng)中,反應(yīng)溫度的選擇還取決于催化劑的性能,如果反應(yīng)溫度過(guò)低,催化劑活化和轉(zhuǎn)化正丁烷的能力下降,在一定反應(yīng)時(shí)間內(nèi)實(shí)際轉(zhuǎn)化率可能遠(yuǎn)低于平衡轉(zhuǎn)化率,因此反應(yīng)溫度的降低是有限度的。正丁烷異構(gòu)化制異丁烷雖然有各種不同的催化劑,但反應(yīng)溫度一般都控制在393~493 K之間[8]。
2 實(shí) 驗(yàn)
2.1 催化劑制備
Al2O3載體的制備:稱取一定量的擬薄水鋁石粉,加入田菁粉,攪拌均勻后,加入適量硝酸水溶液,在雙螺桿擠條機(jī)中混捏均勻并擠條成型,將擠出的濕條在室溫下放置4 h,然后在120 ℃下干燥12 h,600 ℃下焙燒4 h,制得條形Al2O3載體。
Pt/Al2O3催化劑的制備:量取計(jì)算量的氯鉑酸水溶液,加入適量競(jìng)爭(zhēng)吸附劑,并將制得的Al2O3載體浸入上述溶液中,浸漬吸附1 h后,在60~70 ℃下旋轉(zhuǎn)蒸干,120 ℃下干燥12 h,空氣氣氛下管式爐中510 ℃焙燒4 h,氫氣氣氛下500 ℃還原4 h,制得Pt負(fù)載量(w)為0.13%的基礎(chǔ)催化劑Pt/Al2O3。
Pt/Al2O3-Cl催化劑的制備:以AlCl3作為氯化劑,以H2為載氣,采用升華法對(duì)Pt/Al2O3催化劑進(jìn)行氯化,制備催化劑Pt/Al2O3-Cl。
2.2 催化劑評(píng)價(jià)
以純正丁烷為原料,采用10 mL固定床微反裝置進(jìn)行催化劑評(píng)價(jià)。反應(yīng)產(chǎn)物采用安捷倫7890A型在線氣相色譜儀進(jìn)行分析。進(jìn)料后1 h開始采樣,后續(xù)采樣間隔為1 h。根據(jù)產(chǎn)物組成數(shù)據(jù)計(jì)算正丁烷轉(zhuǎn)化率和異丁烷選擇性。
3 結(jié)果與討論
3.1 反應(yīng)溫度的影響
在反應(yīng)壓力為2.5 MPa、正丁烷質(zhì)量空速為4.0 h-1、氫/烴摩爾比為0.10的條件下,考察了反應(yīng)溫度對(duì)正丁烷異構(gòu)化反應(yīng)的影響,并與熱力學(xué)計(jì)算所得正丁烷平衡轉(zhuǎn)化率進(jìn)行比較,結(jié)果見表3。從表3可以看出:反應(yīng)溫度不高于443.15 K時(shí),反應(yīng)溫度對(duì)正丁烷轉(zhuǎn)化率的影響顯著,正丁烷轉(zhuǎn)化率隨反應(yīng)溫度的升高而快速提高;443.15 K后繼續(xù)提高反應(yīng)溫度,正丁烷轉(zhuǎn)化率提高幅度很小;隨著反應(yīng)溫度的升高,異丁烷選擇性略有下降,但均維持在高于97%的水平;反應(yīng)溫度為443.15 K時(shí)異丁烷的收率最高。
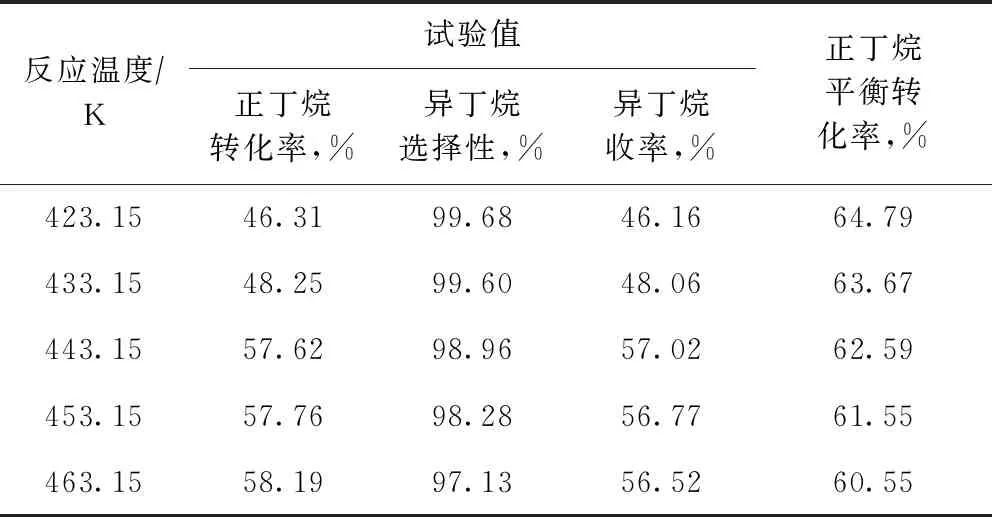
表3 反應(yīng)溫度對(duì)正丁烷異構(gòu)化反應(yīng)的影響
由表3還可以看出,正丁烷的平衡轉(zhuǎn)化率隨著反應(yīng)溫度的升高而降低,而試驗(yàn)值是先升高,然后基本保持穩(wěn)定。當(dāng)反應(yīng)溫度低于443.15 K時(shí),雖然正丁烷異構(gòu)化反應(yīng)的平衡轉(zhuǎn)化率較高,但由于低溫下反應(yīng)速率較低,反應(yīng)受動(dòng)力學(xué)控制,在有限的接觸時(shí)間內(nèi)并未達(dá)到熱力學(xué)平衡,故正丁烷實(shí)際轉(zhuǎn)化率遠(yuǎn)低于熱力學(xué)平衡值。隨著反應(yīng)溫度的提高,反應(yīng)速率增大,正丁烷轉(zhuǎn)化率上升明顯,反應(yīng)逐漸接近熱力學(xué)平衡。本課題選擇443.15~453.15 K為適宜的正丁烷異構(gòu)化反應(yīng)溫度。
3.2 反應(yīng)壓力的影響
在反應(yīng)溫度為443.15 K、正丁烷質(zhì)量空速為4.0 h-1、氫/烴摩爾比為0.10的條件下,考察了反應(yīng)壓力對(duì)正丁烷異構(gòu)化反應(yīng)的影響,并與熱力學(xué)計(jì)算所得正丁烷平衡轉(zhuǎn)化率進(jìn)行比較,結(jié)果見表4。從表4可以看出:反應(yīng)壓力從1.5 MPa提高至2.0 MPa時(shí),正丁烷轉(zhuǎn)化率顯著提高,當(dāng)壓力進(jìn)一步提高至2.5 MPa時(shí),正丁烷轉(zhuǎn)化率有小幅提高并達(dá)到峰值,再提高壓力至3.0 MPa時(shí),正丁烷轉(zhuǎn)化率開始下降;在所考察的壓力范圍內(nèi),異丁烷選擇性均高于98%,只是隨著反應(yīng)壓力的提高略有下降;反應(yīng)壓力為2.0~2.5 MPa時(shí),異丁烷收率最高。
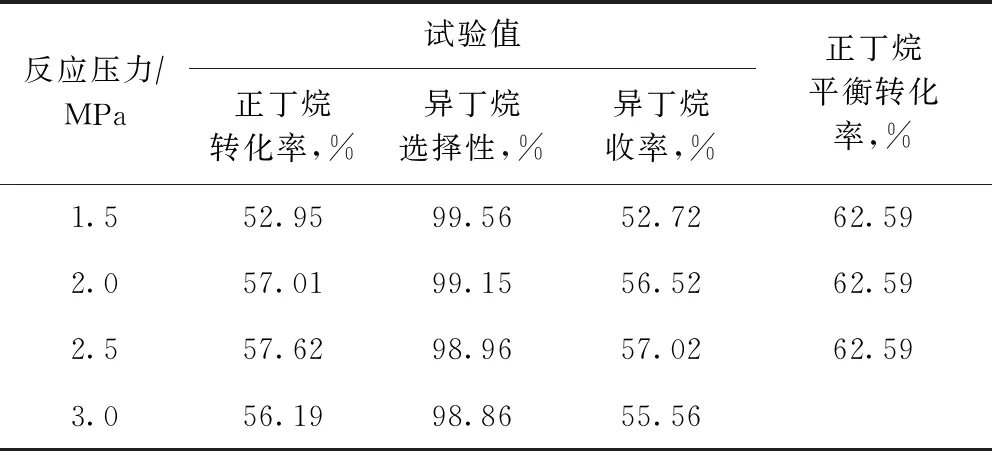
表4 反應(yīng)壓力對(duì)正丁烷異構(gòu)化反應(yīng)的影響
由于正丁烷異構(gòu)化是分子數(shù)不變的反應(yīng),理想狀態(tài)下反應(yīng)壓力對(duì)正丁烷的平衡轉(zhuǎn)化率沒(méi)有影響。反應(yīng)壓力為2.0~2.5 MPa時(shí)正丁烷轉(zhuǎn)化率試驗(yàn)值最高,更接近熱力學(xué)平衡值。當(dāng)反應(yīng)壓力高于2.5 MPa時(shí),異丁烷和正丁烷與理想氣體的偏離較大,需要用逸度代替壓力來(lái)計(jì)算平衡轉(zhuǎn)化率[24],因此表4中未給出壓力高于2.5 MPa時(shí)的正丁烷平衡轉(zhuǎn)化率數(shù)據(jù)。本課題選擇2.0~2.5 MPa為適宜的正丁烷異構(gòu)化反應(yīng)壓力。
3.3 正丁烷進(jìn)料空速的影響
在反應(yīng)溫度為443.15 K、壓力為2.5 MPa、氫/烴摩爾比為0.10的條件下,考察了進(jìn)料空速對(duì)正丁烷異構(gòu)化反應(yīng)的影響,并與熱力學(xué)計(jì)算所得正丁烷平衡轉(zhuǎn)化率進(jìn)行比較,結(jié)果見表5。從表5可以看到:隨著進(jìn)料空速的提高,正丁烷轉(zhuǎn)化率不斷下降,尤其當(dāng)正丁烷質(zhì)量空速高于4.0 h-1以后,正丁烷轉(zhuǎn)化率下降幅度較大;異丁烷選擇性隨進(jìn)料空速的增加略有提高。
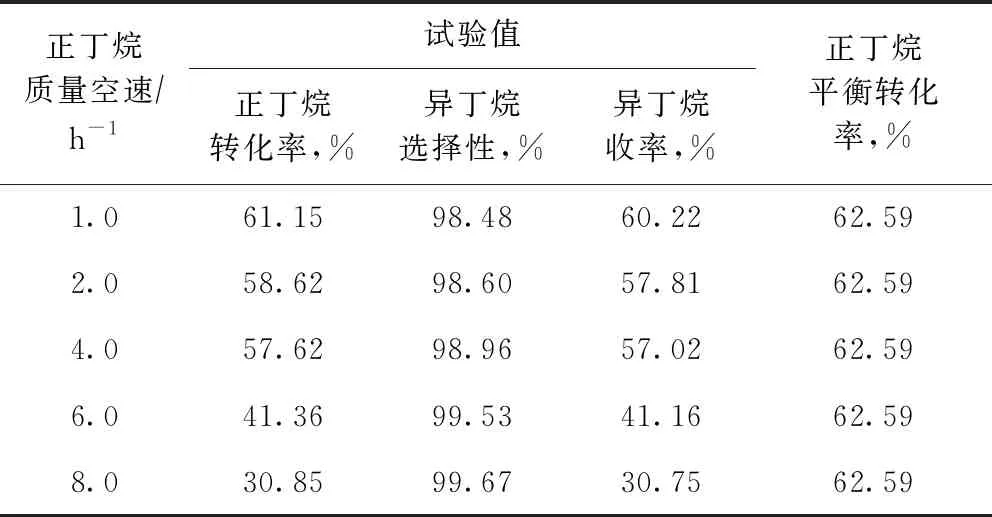
表5 進(jìn)料空速對(duì)正丁烷異構(gòu)化反應(yīng)的影響
由表5還可以看出:進(jìn)料空速對(duì)正丁烷異構(gòu)化的平衡轉(zhuǎn)化率沒(méi)有影響,而實(shí)際轉(zhuǎn)化率受進(jìn)料空速的影響較為明顯;隨著進(jìn)料空速的降低,實(shí)際轉(zhuǎn)化率逐漸接近熱力學(xué)平衡值,說(shuō)明熱力學(xué)計(jì)算結(jié)果可靠性較高,可以較好預(yù)測(cè)該條件下正丁烷轉(zhuǎn)化率的極限。兼顧反應(yīng)效率和催化劑用量,適宜的正丁烷進(jìn)料質(zhì)量空速應(yīng)為1.0~4.0 h-1。
3.4 氫/烴摩爾比的影響
在反應(yīng)溫度為443.15 K、壓力為2.5 MPa、正丁烷質(zhì)量空速為4.0 h-1的條件下,考察了氫/烴摩爾比對(duì)正丁烷異構(gòu)化反應(yīng)的影響,并與熱力學(xué)計(jì)算所得正丁烷平衡轉(zhuǎn)化率進(jìn)行比較,結(jié)果見表6。從表6可以看到,氫/烴摩爾比對(duì)正丁烷異構(gòu)化反應(yīng)有顯著影響,當(dāng)氫/烴摩爾比超過(guò)0.10時(shí),正丁烷轉(zhuǎn)化率和異丁烷收率均大幅度下降。
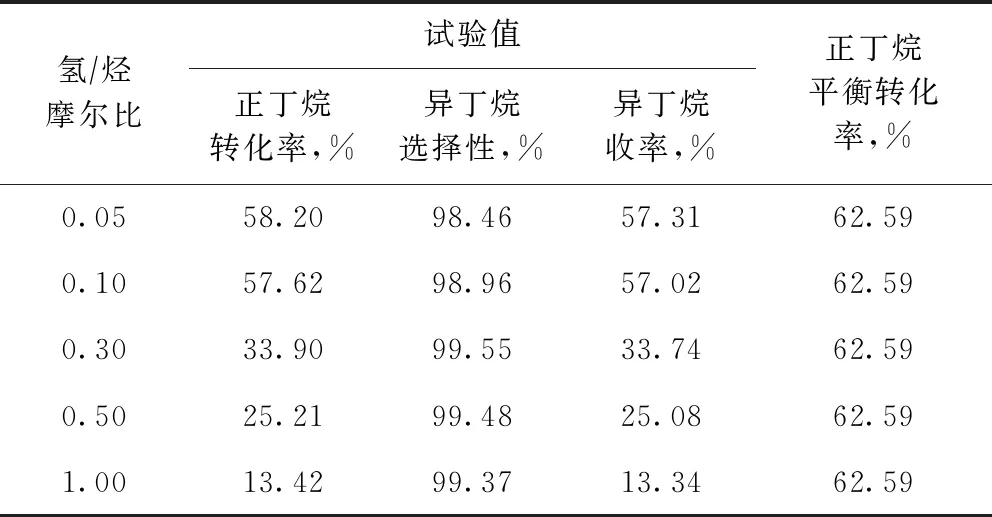
表6 氫/烴摩爾比對(duì)正丁烷異構(gòu)化反應(yīng)的影響
由表6還可以看出,氫/烴摩爾比對(duì)正丁烷異構(gòu)化的平衡轉(zhuǎn)化率沒(méi)有影響,而實(shí)際轉(zhuǎn)化率受氫/烴摩爾比的影響顯著。當(dāng)氫/烴摩爾比較高時(shí),正丁烷在催化劑床層的停留時(shí)間較短,反應(yīng)受動(dòng)力學(xué)控制,受正丁烷活化及轉(zhuǎn)化速率的制約,正丁烷轉(zhuǎn)化率較低,隨著氫/烴摩爾比的降低,正丁烷在催化劑床層的停留時(shí)間延長(zhǎng),正丁烷轉(zhuǎn)化率快速提高,當(dāng)氫/烴摩爾比降至0.10和0.05時(shí),正丁烷轉(zhuǎn)化率已接近熱力學(xué)平衡值。因此,適宜的氫/烴摩爾比應(yīng)為0.05~0.10。
綜上可見,正丁烷異構(gòu)化反應(yīng)的試驗(yàn)轉(zhuǎn)化率低于熱力學(xué)計(jì)算所得平衡轉(zhuǎn)化率,通過(guò)提高反應(yīng)溫度、降低正丁烷進(jìn)料空速,同時(shí)選擇較低的氫/烴比和適宜的反應(yīng)壓力,可使試驗(yàn)轉(zhuǎn)化率接近平衡轉(zhuǎn)化率。
4 結(jié) 論
(1)正丁烷異構(gòu)化屬微放熱反應(yīng),降低反應(yīng)溫度可提高正丁烷的平衡轉(zhuǎn)化率。
(2)在Pt/Al2O3-Cl催化正丁烷異構(gòu)化反應(yīng)中,反應(yīng)溫度、反應(yīng)壓力、正丁烷進(jìn)料空速和氫/烴摩爾比均對(duì)正丁烷轉(zhuǎn)化率有影響,選擇合適的反應(yīng)溫度和壓力,并適當(dāng)降低進(jìn)料空速和氫/烴摩爾比,有利于提高正丁烷轉(zhuǎn)化率,適宜的工藝條件為:反應(yīng)溫度443.15~453.15 K、反應(yīng)壓力2.0~2.5 MPa、質(zhì)量空速1.0~4.0 h-1、氫/烴摩爾比0.05~0.10。
(3)正丁烷的試驗(yàn)轉(zhuǎn)化率低于熱力學(xué)計(jì)算所得平衡轉(zhuǎn)化率,通過(guò)提高反應(yīng)溫度、降低正丁烷進(jìn)料空速,同時(shí)選擇較低的氫/烴比和適宜的反應(yīng)壓力,可使試驗(yàn)轉(zhuǎn)化率接近平衡轉(zhuǎn)化率。

