山羊結腸小袋纖毛蟲和A型產氣莢膜梭菌混合感染的病原學分析
陳凌志 , 黃紫貝 , 徐康智 , 李 俊 , 孫啟亮 , 王彥紅 , 劉文博 ,許金俊 , 潘志明 , 陶建平 , 焦庫華 , 候照峰
(1.揚州大學獸醫學院 , 江蘇 揚州 225009 ; 2.江蘇省動物重要疫病與人獸共患病防控協同創新中心 , 江蘇 揚州 225009 ;3.江蘇省人獸共患病學重點實驗室 , 江蘇 揚州 225009 ; 4.菏澤市食品藥品檢驗檢測研究院 , 山東 菏澤 274000)
江蘇省南通市通州區某養殖戶共飼養200只山羊,3月齡,近5 d內發病,發病率為15%(30/200),死亡4只,于2021年5月14日送至揚州大學動物醫院就診,該養殖戶采用圈養結合放牧的飼養方式,圈舍為臨時搭建而成,衛生條件較差,排泄物清理不及時,養殖戶曾使用阿苯達唑伊維菌素驅蟲,并已注射小反芻獸疫疫苗。患病山羊普遍食欲不振,腹瀉,糞便帶有黏液,氣味略腥臭,并有少數眼球下陷,近2 d已注射土霉素,未見明顯效果。本試驗通過對腹瀉山羊進行解剖檢查、實驗室診斷和病原學鑒定,確診其為大量結腸小袋纖毛蟲(Balantioidescoli)和產氣莢膜梭菌(Clostridiumperfringens)的混合感染病例,該起病例報道及其病原學診斷方法可為養殖產業中山羊腹瀉的防控工作提供理論指導。
1 材料與方法
1.1 主要試劑 產氣莢膜梭菌測定用培養基,16S rDNA Bacterial Identification PCR Kit(TaKaRa公司),OxoidTMAnaeroGenTM厭氧袋(Thermo scientific公司)等。
1.2 解剖與顯微鏡檢查 對病死羊只進行剖檢,觀察各實質器官病理變化。無菌采集山羊各段腸道黏膜和內容物,分別收集至潔凈樣品袋中送至實驗室,用鑷子挑取少量樣品,與蒸餾水混勻涂片,蓋玻片直接壓片后,置于光學顯微鏡下觀察。
1.3 細菌分離 采集肝臟、腎臟、小腸、盲腸等病變組織,無菌接種于綿羊血平板,分別在37 ℃需氧和厭氧條件下培養24 h。隨后,挑取單菌落接種于產氣莢膜梭菌測定用培養基,37 ℃厭氧培養24 h,并進行2次純化,純化后選取典型菌落觀察生物學形態并進行革蘭染色鏡檢。
1.4 分離菌16S rDNA鑒定 參照16S rDNA Bacterial Identification PCR Kit操作說明書,挑取單個菌落于200 μL超純水中,100 ℃煮沸10 min,離心取上清5~10 μL作為模板,采用試劑盒提供的引物進行PCR擴增。PCR反應體系:PCRPremix25 μL,上游和下游引物各0.5 μL,DNA模板50~100 ng,加16S-free H2O至總體積50 μL。PCR反應條件:94 ℃預變性5 min;94 ℃變性1 min,50~55 ℃退火1 min,72 ℃延伸1.5 min,共30個循環;最后72 ℃延伸5 min。反應結束后取5 μL PCR擴增產物進行1.2%瓊脂糖凝膠電泳分析,PCR純化產物送至北京擎科生物科技有限公司測序。
1.5 分離菌16S rDNA遺傳進化分析 將所得序列在NCBI網站進行BLAST搜索比對,分析所得序列與GenBank已公布序列的同源性,選取相同宿主和不同宿主源細菌16S rDNA序列,運用MEGA 5.0軟件構建系統發育樹,鑒定所分離細菌的種屬。
1.6 細菌毒力分型鑒定 采用多重PCR方法鑒定分離菌毒素分型,參照參考文獻[1]引物信息,由南京金斯瑞生物科技公司合成plc、iap、etx、netB、cpe和cpb共6對特異性引物,進行多重PCR擴增,PCR產物進行1%瓊脂糖凝膠電泳,將目的片段送北京擎科生物科技有限公司進行測序比對,進一步確定產氣莢膜梭菌分型。
1.7 藥敏試驗 通過Kirby-Bauer(K-B)紙片瓊脂擴散法測定山羊分離菌對常見抗菌藥物的耐藥性[2],無菌操作將分離菌的純培養物均勻涂抹于營養瓊脂平板上,置于37 ℃培養箱中培養18~24 h后,測量抑菌圈直徑。
2 結果
2.1 病死山羊剖檢病變 送檢病死山羊,剖檢病變發現肺臟氣腫、局部出血,肝臟腫大、淤血,膽囊異常腫大,膽汁濃稠,脾臟壞死、出血,腎臟水腫、質軟,腸道組織表現出典型的病理變化,如腸管內大量水樣稀便、黏膜出血等。
2.2 腸道黏膜與內容物顯微鏡檢查 取各段腸道黏膜與內容物進行實驗室顯微鏡檢查,未發現球蟲卵囊及線蟲、吸蟲、絳蟲等蟲卵或蟲體節片等,但在結腸和盲腸內容物中觀察到大量結腸小袋纖毛蟲滋養體(圖1)。山羊結腸小袋纖毛滋養體呈梨形或卵圓形,大小約45.85 μm × 112.33 μm,全身附有纖毛,蟲體前端纖毛較長,后端鈍圓、略尖,纖毛擺動呈規律的波浪狀,使身體旋轉或向前快速移動。
2.3 細菌分離與純化 取病羊肝臟、腎臟、小腸和盲腸等組織病料,進行細菌分離培養。在有氧環境下培養24 h,綿羊血平板上未見雙溶血菌落,而厭氧培養24 h后,可見邊緣整齊、光滑濕潤、圓形隆起、透明雙溶血菌落。隨后,于產氣莢膜梭菌測定用培養基厭氧培養24 h后,形成典型的黑色菌落形態,挑取黑色單菌落進行2次純化(圖2),革蘭染色鏡檢,顯示分離菌為直桿狀,兩端鈍緣,單個或成雙的革蘭陽性菌。

圖2 細菌分離和純化Fig.2 Bacteria isolation and purification
2.4 分離菌16S rDNA鑒定 采用16S rDNA Bacterial Identication PCR Kit對分離菌菌落DNA進行PCR擴增,擴增的DNA片段經瓊脂糖凝膠電泳分析后進行測序驗證。結果如圖3所示,分離菌菌落經PCR擴增,產生1條約500 bp大小的特征條帶。經測序驗證,成功獲得分離菌16S rDNA序列。

圖3 16S rDNA的PCR擴增Fig.3 PCR amplification of 16S rDNA M:DL2 000 DNA Marker; P:陽性對照; 1:分離菌; N:陰性對照M: DL2 000 DNA Marker; P: Positive control; 1: Isolated strain; N: Negative control
2.5 分離菌16S rDNA遺傳進化分析 將所得序列于NCBI數據庫進行BLAST分析,顯示本試驗中山羊分離株16S rDNA序列與產氣莢膜梭菌同源性均在99%以上,因此確定山羊分離株為產氣莢膜梭菌,并命名為NTCPG1。選取分離于不同國家和地區的豬、雞、鴨、山羊和綿羊來源的產氣莢膜梭菌16S rDNA基因序列進行遺傳進化分析,結果如圖4所示,所有分離株共分為2個大的分支,本試驗分離于山羊的產氣莢膜梭菌NTCPG1株與來源于巴基斯坦的山羊分離株(GenBank:MW551947.1)、綿羊分離株(GenBank:MW556208.1)及來源于國內的豬源分離株(GenBank:KX094442.1)位列同一分支,且與分離于芬蘭的豬源產氣莢膜梭菌(GenBank:CP075903.1)親緣關系最近。

圖4 16S rDNA系統發育樹Fig.4 Phylogenetic tree of 16S rDNA▲:本試驗分離的山羊產氣莢膜梭菌分離株▲:C. perfringens isolated from goat in this study
2.6 毒力基因分型 多重PCR毒力基因分型中plc、iap、etx、netB、cpe基因和cpb基因片段大小分別對應324、461、656、738、233 bp和196 bp,電泳結果如圖5所示,山羊分離株NTCPG1株僅出現1條324 bp左右目的條帶,初步判定為plc基因,經測序驗證確為plc基因,因此,山羊分離株NTCPG1株為A型產氣莢膜梭菌。
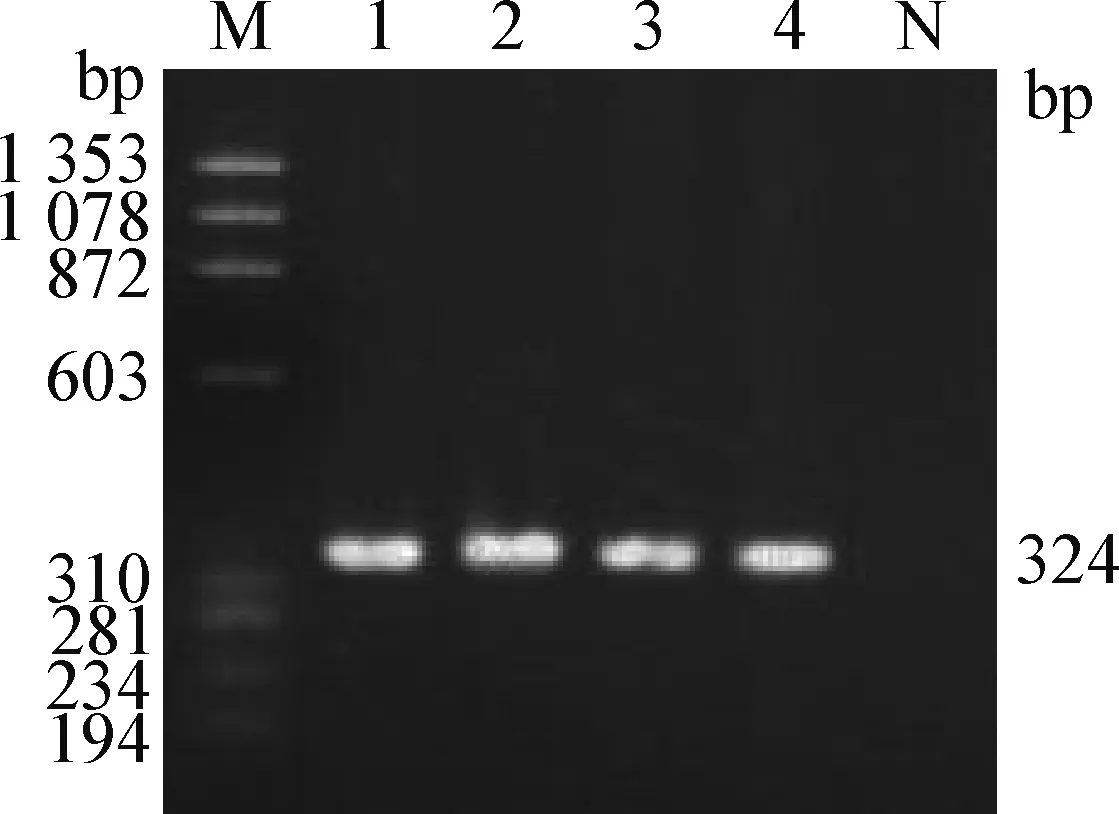
圖5 毒力基因的PCR擴增Fig.5 PCR amplification of virulence genes M:φX174-HaeⅢ digest DNA Marker; 1~4: 山羊分離株NTCPG1; N:陰性對照M: φX174-HaeⅢ digest DNA Marker; 1-4: NTCPG1 strain isolated from goat; N: Negative control
2.7 藥敏試驗 結果見表1,山羊NTCPG1分離菌對氨基糖苷類(妥布霉素、鏈霉素、新霉素、慶大霉素、卡那霉素),復方新諾明和氟苯尼考等抗生素耐藥;而對青霉素類(阿莫西林、美洛西林),頭孢菌素類(頭孢曲松鈉、頭孢哌酮、頭孢噻肟),喹諾酮類(環丙沙星、左氧氟沙星),多西環素和多黏菌素B等抗生素敏感。
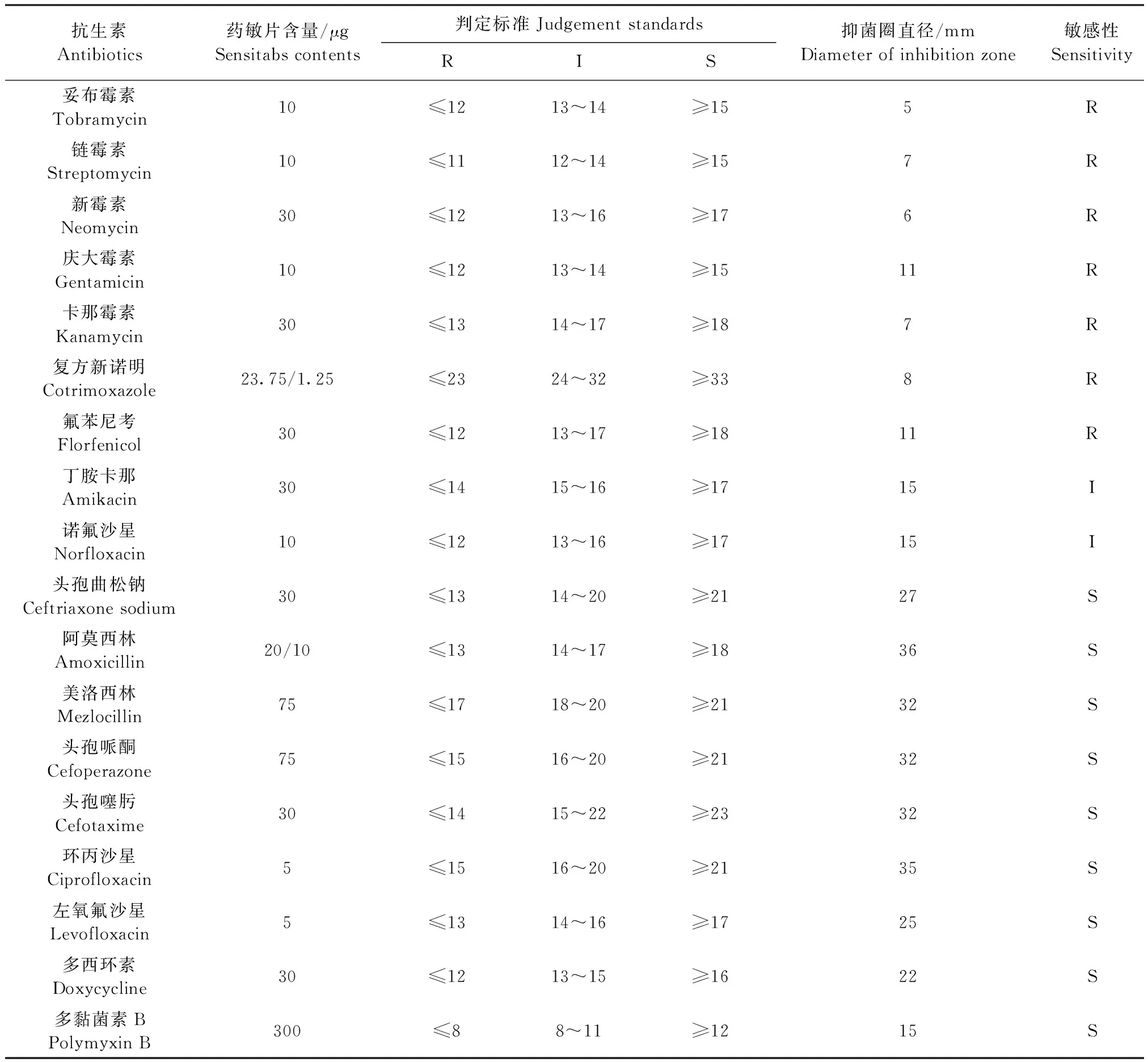
表1 山羊NTCPG1分離菌藥敏試驗結果Table 1 Result of drug susceptibility test for NTCPG1 strain from goat
3 討論
羊傳染性腹瀉是臨床生產中較為常見的消化道疾病,該病由多種病原單獨或混合感染引起,臨床上常見病原如大腸埃希菌、沙門菌、魏氏梭菌、金黃色葡萄球菌、小反芻獸疫病毒、球蟲、結腸小袋纖毛蟲、蛔蟲、絳蟲等,均可導致腹瀉癥狀,并造成較高病死率。本試驗腹瀉病羊經病原學分析和鑒定,診斷為結腸小袋纖毛蟲滋養體和A型產氣莢膜梭菌混合感染,該2種病原均屬人獸共患病原。在以往的臨床生產中,結腸小袋纖毛蟲和產氣莢膜梭菌單獨感染的病例已有較多報道,但二者混合感染的病例分析較為少見。
結腸小袋纖毛蟲可入侵人或動物大腸壁,引起以腹瀉、脫水、消瘦和貧血為特征的腸道原蟲病[3],該病呈全球性分布[4],且在國內大部分地區廣泛流行,嚴重威脅人畜安全[5]。目前,有關結腸小袋纖毛蟲的病例分析多見于豬,而羊結腸小袋纖毛蟲少有報道[6-7]。研究發現,結腸小袋纖毛蟲在宿主體內繁殖能力極強,動物攝入極少量包囊即可能造成嚴重感染[4],同時,該病原對高溫、陽光、干燥等因素非常敏感,而對陰濕環境更為適應[7],因此,該病的發生多與飼養環境和衛生條件相關。本病例中病羊飼養場地為臨時搭建而成,平時衛生條件較差,排泄物清理不及時等,為結腸小袋纖毛蟲的感染創造了有利條件。
產氣莢膜梭菌多存在于食物、污水、土壤及人、畜腸道中,能引起人類和畜禽的多種腸道疾病,同時也是畜禽壞疽性皮炎、腸毒血癥和壞死性腸炎的主要病原[8]。目前已經證實產氣莢膜梭菌至少存在19種以上毒素,其中最主要為α、β、?、毒素[9],并依此分為A、B、C、D和E共5個毒素型[10-11]。盡管不同毒素的致病機制有所區別,但其致病性均很強[12],研究表明,產氣莢膜梭菌可引起羔羊痢疾、腸毒血癥、羊猝狙等疫病[13],感染羊只表現為發病急、病程短、死亡率高[14],尤其可引起膘情較好的羊急性死亡[15],這與本試驗病例的發病特點一致。目前,羊源產氣莢膜梭菌主要有A、B、C、D型,來源于國內不同地區的流行病學調查數據顯示,A型羊源產氣莢膜梭菌感染率最高,是肉羊體內的主要流行菌株[12,16],該型菌株可導致羊腸毒血癥[16],病羊表現為多器官組織壞死、水腫或充血、出血等病變[17],與本試驗NTCPG1株感染引起的病理變化相符。另外,本試驗遺傳進化分析結果顯示,來源于不同國家不同宿主的產氣莢膜梭菌16S rDNA序列同源性均較高,且NTCPG1株與豬源和羊源分離株親緣關系較近,提示該菌存在跨地區跨物種的傳播特性。本試驗藥敏試驗結果發現,山羊NTCPG1分離菌主要對氨基糖苷類抗生素表現為多重耐藥,這與分離自北京和山西等地的產氣莢膜梭菌耐藥表型一致[18],而與分離于陜西、青海、寧夏三地區呈磺胺類耐藥表型的特點不盡一致[12]。盡管不同地區間存在差異,但以上結果均表明,山羊產氣莢膜梭菌的多重耐藥愈發嚴重,提示臨床上應規范使用抗生素,并可合理的聯合或交叉使用敏感藥物進行預防治療。
以往羊腹瀉病例分析多為病原單獨感染或多種細菌混合感染[19],鮮有寄生蟲與其他病原混合感染的病例報道,這在一定程度上表明寄生蟲在臨床生產中的重要性和危害性未能引起足夠重視。在實際臨床生產中,結腸小袋纖毛蟲感染非常普遍,主要以慢性感染或無癥狀感染為主,僅少數導致急性腹瀉[20],但與其他病原混合感染時,可加速破壞腸道黏膜的免疫系統,造成宿主發病率和死亡率上升,并增加了治療難度[4]。本試驗中山羊病例在腹瀉初期,曾采用抗生素注射治療,但未見明顯效果,在隨后的治療措施中,建議養殖場采用地美硝唑與環丙沙星聯合用藥,并加強圈舍清理和消毒,治療后病羊腹瀉情況得到明顯改善,表明結腸小袋纖毛蟲在該病的發生和發展中起到了重要作用。

