納米材料在腫瘤光熱治療中存在的問題及解決策略
常夢宇,王 曼,侯智堯,林 君*
(1.中國科學院長春應(yīng)用化學研究所稀土資源利用國家重點實驗室,吉林長春 130022;2.南洋理工大學 物理與數(shù)學科學學院,新加坡 637371;3.廣州醫(yī)科大學 基礎(chǔ)醫(yī)學院,廣東 廣州 511436)
1 引 言
癌癥嚴重威脅人類健康,是人類死亡的主要原因之一。據(jù)世界衛(wèi)生組織國際癌癥研究機構(gòu)(IARC)發(fā)布的數(shù)據(jù)顯示,2020 年全球新發(fā)癌癥病例1 929 萬例,全球癌癥死亡病例996 萬例[1]。傳統(tǒng)的癌癥治療手段,主要包括手術(shù)、化療、放療等,均難以治愈癌癥[2]。因此,研發(fā)新穎的療效顯著且毒副作用低的抗癌治療藥物和技術(shù)是極其必要的。隨著納米技術(shù)的發(fā)展,具有優(yōu)異理化性能的納米材料(尺寸小,比表面積大,獨特的聲、光、電、磁、熱性能等)為癌癥治療提供了廣闊的創(chuàng)造空間[3-5]。納米藥物可通過高滲透性和滯留(EPR)效應(yīng)或主動靶向作用富集在腫瘤部位,從而提高抗腫瘤療效[6-7]。此外,針對腫瘤微環(huán)境(弱酸性,大量葡萄糖、過氧化氫和谷胱甘肽過表達)或特定的外部刺激(激光、超聲、磁力、X 射線),可設(shè)計“刺激響應(yīng)”性腫瘤靶點激活的納米藥物[8-10]。因此,具有強療效以及低毒副作用的納米藥物已成為生物醫(yī)學高速發(fā)展的推進器。
熱療是指將靶向腫瘤部位暴露于41~48 ℃溫度范圍內(nèi)的一種療法[11]。由于熱療可增加血管通透性、提高血液流動速度并改善腫瘤氧合狀態(tài),臨床上其已被用為傳統(tǒng)放化療療法的輔助治療[12]。更重要的是,熱療具有直接殺死癌細胞的效果[13]。當腫瘤受到熱療時,部分不耐熱的細胞內(nèi)蛋白質(zhì)發(fā)生變性,隨后與癌細胞中的其他蛋白質(zhì)形成共聚物[14-15]。過熱誘導(dǎo)的蛋白質(zhì)變性和聚集可以嚴重損害生物體內(nèi)的一些生理活動,如蛋白(酶)失活、染色質(zhì)改變、DNA 合成和修復(fù)抑制等,最終導(dǎo)致癌細胞死亡[16-17]。基于納米材料的光熱療法(PTT)已廣泛應(yīng)用于臨床治療和實驗室科學研究。在PTT 過程中,利用激光照射富集有光熱轉(zhuǎn)換試劑(PTAs)的腫瘤部位,可將光能轉(zhuǎn)換為熱能[18-19]。特別是在近紅外(NIR)生物窗口(700~1 400 nm)內(nèi),PTT 可實現(xiàn)組織的深度穿透,降低組織的熱效應(yīng),從而減少對鄰近健康器官和組織的光損傷[20-23]。總體而言,與傳統(tǒng)治療方法相比,外部激光刺激介導(dǎo)的基于納米材料的PTT 具有非侵入性、時空可控性、良好的靶向性以及對正常組織毒副作用小等優(yōu)勢[24-27]。
因此,研發(fā)高效且安全的納米PTAs 對抗腫瘤治療具有重要意義。目前,貴金屬材料、金屬硫族化合物、二維材料、有機小分子和半導(dǎo)體聚合物等作為納米PTAs 已被應(yīng)用于抗腫瘤PTT 領(lǐng)域[28-34]。然而,由于PTAs 光熱轉(zhuǎn)換效率不足、腫瘤富集量不足、在體內(nèi)長期滯留、治療過程中腫瘤復(fù)發(fā)和轉(zhuǎn)移、對腫瘤周圍正常組織的熱損傷、腫瘤耐熱性以及單一療法的局限性等問題的存在,使PTT 在未來的臨床轉(zhuǎn)化過程中面臨巨大的挑戰(zhàn)。鑒于此,本綜述針對PTT 在發(fā)展過程中遇到的實際問題和不足,總結(jié)了相應(yīng)的解決策略,以使PTT 在臨床實踐中成為一種高效安全的癌癥治療手段。
2 光熱轉(zhuǎn)換原理
在PTT 過程中,PTAs 可將吸收的光子能量轉(zhuǎn)化為熱能,以消融腫瘤[35]。目前,許多無機和有機納米材料,包括貴金屬PTAs、半導(dǎo)體PTAs、碳材料PTAs、以及基于有機分子的PTAs 已被廣泛應(yīng)用于PTT。在這部分,我們將分別介紹這四種經(jīng)典的PTAs 的光熱轉(zhuǎn)換原理。
2.1 貴金屬PTAs
當光子的入射頻率與金屬表面電子的振蕩頻率相同時,貴金屬材料可以表現(xiàn)出獨特的局域表面等離子體共振效應(yīng)(LSPR)[36]。這一現(xiàn)象使貴金屬具有較強的光學吸收能力和較高的光熱轉(zhuǎn)換效率。貴金屬PTAs,例如金、銀、鉑等,可從NIR 光吸收能量,將它們的電子從基態(tài)激發(fā)到激發(fā)態(tài),隨后通過非輻射衰減以熱的形式將能量釋放出來[37]。如圖1(a)所示,當光照射到等離子金屬表面時,一部分光被吸收,另一部分光被散射。其中,只有被吸收的能量才能部分轉(zhuǎn)化為熱能。處于激發(fā)態(tài)的PTAs可以通過輻射衰減和非輻射衰減兩種途徑釋放能量回到基態(tài),前者發(fā)射光子并產(chǎn)生熒光,后者可產(chǎn)生熱量。由此可見,可通過增加貴金屬PTAs 的光學吸收、減少光學散射、以及促進非輻射衰減的能量轉(zhuǎn)換過程來提高其光熱轉(zhuǎn)換效率。
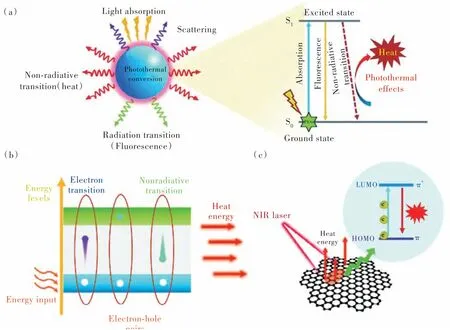
圖1 (a)光觸發(fā)的等離子體金屬不同過程示意圖[37];(b)半導(dǎo)體材料光熱轉(zhuǎn)換機理圖[37];(c)碳基納米材料光熱轉(zhuǎn)換機理圖[37]。Fig.1 (a)Schematic representation of the activated different processes when a light beam interacts with a plasmonic metal[37].(b)Schematic representation of the photothermal conversion principle of semiconductor materials[37].(c)Schematic diagram of the photothermal conversion principle of carbon-based nanomaterials[37].
2.2 半導(dǎo)體PTAs
具有固有吸收帶隙的半導(dǎo)體,例如CuS、MoS2等在近紅外區(qū)具有優(yōu)異的光學吸收[38-41]。其光熱轉(zhuǎn)換過程主要依賴于光子與電子相互作用過程中的能量躍遷和非輻射弛豫(圖1(b))。這種半導(dǎo)體納米材料的近紅外光吸收是由于具有未占據(jù)d軌道的過渡金屬元素發(fā)生d-d 躍遷所致。當入射光子的能量大于半導(dǎo)體的帶隙能量時,位于價帶的電子會被激發(fā)并轉(zhuǎn)移到導(dǎo)帶,形成電子-空穴對。處于激發(fā)態(tài)的電子是不穩(wěn)定的,它們最終會弛豫回到低能級釋放能量。當能量以聲子的形式釋放時,會引起晶格局部加熱,從而產(chǎn)生光熱效應(yīng)[42]。
2.3 碳材料PTAs
碳基納米材料(碳納米管、石墨烯、石墨烯氧化物、碳點)的光熱轉(zhuǎn)換性能是由它們的共軛結(jié)構(gòu)所致[43]。由于碳材料電子之間的鍵合強度較弱,π鍵的能量相對較低,因此電子從π 軌道躍遷到π*軌道只需要較低的激發(fā)能量。通過提高共軛π 鍵的比例,不僅可以減小最高占據(jù)分子軌道(HOMO)和最低未占據(jù)分子軌道(LUMO)之間的能隙,還可以將最大吸收波長從可見光區(qū)調(diào)整到近紅外區(qū)。如圖1(c)所示,當NIR 光輻照材料時,吸收光子的電子從LUMO 被激發(fā)到HOMO,然后通過電子-聲子耦合回到基態(tài),釋放熱量。因此,基于共軛結(jié)構(gòu)和較小的軌道能隙,碳基PTAs 具有出色的近紅外吸收和優(yōu)異的光熱性能。
2.4 超分子PTAs
超分子組裝起源于生物系統(tǒng),廣泛應(yīng)用于生物學和醫(yī)學領(lǐng)域。通過超分子組裝,將藥物、光敏劑等功能性試劑聚集在一起,構(gòu)成一個完整的納米平臺[44]。該組裝基于非共價分子間相互作用,主要包括靜電相互作用、氫鍵作用、疏水相互作用和范德華相互作用[45]。一般來講,在光激發(fā)后,有機敏化劑分子被激活到激發(fā)態(tài)(S1)。激發(fā)態(tài)衰減回到基態(tài)主要通過三個過程(圖2(a)):發(fā)射光子(熒光)、系間竄越(磷光)和非輻射弛豫(熱量)。對于分子敏化劑來說,這三種途徑通常是相互競爭的,導(dǎo)致產(chǎn)生的熱量有限。因此,為了提高光熱轉(zhuǎn)換效率,發(fā)光和系間竄越必須得到抑制。超分子組裝導(dǎo)致分子敏化劑之間相互堆積、分子間碰撞頻繁,這種碰撞會猝滅熒光發(fā)射和系間竄越,從而增強超分子產(chǎn)熱效率(圖2(b))。
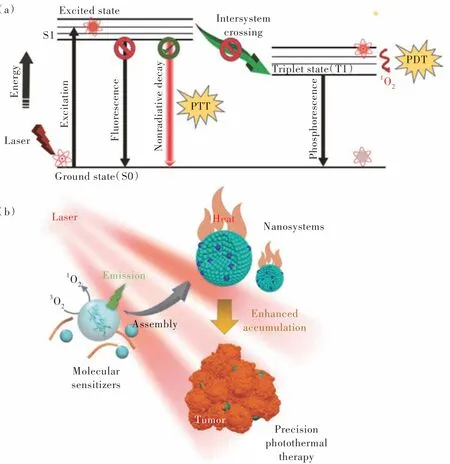
圖2 (a)各種能量轉(zhuǎn)移機制的雅布倫斯基示意圖[18];(b)超分子光熱效果示意圖。自組裝的光敏劑可提高光熱轉(zhuǎn)換效率,并增加其在腫瘤部位的蓄積,從而提高腫瘤治療效果[45]。Fig.2 (a)Schematic Jablonski diagram representing different energy transfer mechanisms[18].(b)Schematic illustration of supramolecular photothermal effects. Self-assembly of photosensitizers gives rise to enhanced photothermal conversion efficiency and accumulation at tumor site,thereby improving the cancer therapeutic efficacy[45].
3 光熱治療抗腫瘤機制
熱療已被應(yīng)用于癌癥的診斷和治療,它通常作為一種輔助療法,與手術(shù)、化療和放療相結(jié)合來治療癌癥[46]。由于腫瘤中的血管與正常組織中的脈管系統(tǒng)不同,腫瘤組織較比正常組織更易受到熱損傷[47]。熱療后腫瘤細胞活力降低的重要機制是蛋白質(zhì)變性,及其下游途徑的激活和失活[12]。治療窗口在41~47 ℃范圍內(nèi),組織細胞即可發(fā)生凋亡[48]。如圖3 所示,在光熱治療的刺激下,特定半胱氨酸蛋白酶(Caspases)的信號級聯(lián)被激活,隨后Caspase-8 和-9 激活下游負責蛋白質(zhì)水解分解細胞的“效應(yīng)因子”Caspase-3、-6 和-7[49]。并且,這些信號通路在線粒體中得到增強[50]。當溫度超過50 ℃時,細胞死亡途徑是壞死過程[51]。壞死是一種更迅速和無組織的細胞死亡形式,不需要連續(xù)的蛋白激活[52]。細胞內(nèi)蛋白質(zhì)結(jié)構(gòu)的改變可以破壞腫瘤細胞的運動、細胞內(nèi)信號轉(zhuǎn)導(dǎo),進而抑制腫瘤的生長和轉(zhuǎn)移[53]。
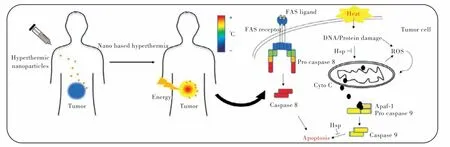
圖3 光熱治療惡性腫瘤機制圖[54]Fig.3 The proposed mechanism of PTT against malignant tumors[54]
4 PTT 面臨的問題及解決策略
4.1 解決PTAs 光熱轉(zhuǎn)換效率不足
如前所述,PTT 主要依賴于PTAs 將光能轉(zhuǎn)化為熱能以達到腫瘤消融的目的。為了實現(xiàn)安全高效的PTT,PTAs 須在生物窗口具備良好的光熱性能,包括大的吸收截面、優(yōu)異的光熱轉(zhuǎn)換效率和光熱穩(wěn)定性。該部分,我們從PTAs 固有光熱性能的改善以及近紅外生物窗口的選擇兩個角度出發(fā),來總結(jié)提高PTAs 光熱轉(zhuǎn)換效率的策略。
4.1.1 Au 納米材料形貌調(diào)控
在過去的幾十年里,科研工作者已經(jīng)研發(fā)出了多種具有前景的PTAs,包括基于金屬的納米材料、碳納米材料、二維材料、有機小分子、半導(dǎo)體聚合物等[55-56]。在眾多的PTAs 中,Au 納米材料的局域表面等離子共振(LSPR)峰可通過改變其大小、形狀、結(jié)構(gòu)等參數(shù)而被調(diào)節(jié)到近紅外生物窗口[57]。因此,近些年,Au 納米材料受到了極大的關(guān)注。多種Au 納米結(jié)構(gòu),包括聚集的膠體粒子、納米殼、納米籠、納米棒等已應(yīng)用于近紅外光響應(yīng)的PTT[58]。令人備受鼓舞的是Au 納米顆粒已在臨床前列腺癌的PTT 中取得了突破性的成功[59]。因此,探索合適的Au 納米材料形貌對進一步實現(xiàn)PTT 療效的最大化是很有必要的。基于此,夏幼南課題組制備了Au 納米六足、納米棒、納米籠結(jié)構(gòu)(圖4(a)~(c))[60]。并在相同的實驗條件下,給小鼠尾靜脈注射相同體積和濃度的生理鹽水、PEG 修飾的Au 納米六足、納米棒和納米籠。3 天后,將腫瘤區(qū)域暴露于1.2 W·cm-2的808 nm 激光。從圖4(d)可見,Au 納米六足實現(xiàn)了最佳的光熱轉(zhuǎn)換效果。因此,優(yōu)化實驗參數(shù)以合成特定形貌的納米材料,可有效提高納米材料的光熱轉(zhuǎn)換效率。

圖4 (a)~(c)Au 納米六足、納米棒和納米籠透射圖[60];(d)不同Au 納米結(jié)構(gòu)注射后,808 nm 激光激發(fā)下,小鼠腫瘤部位的熱成像圖[60]。Fig.4 (a)-(c)The TEM images of Au nanohexapods,nanorods,and nanocages[60].(d)Thermal imaging of tumor sites in mice stimulated by 808 nm laser after injection of different Au nanostructures[60].
4.1.2 金屬/半導(dǎo)體異質(zhì)結(jié)結(jié)構(gòu)構(gòu)建
貴金屬和半導(dǎo)體的緊密接觸可以提高貴金屬的局域表面等離子共振(LSPR)效應(yīng),改變半導(dǎo)體的電子躍遷途徑,從而提高光熱轉(zhuǎn)換效率[61-62]。因此,含有等離子體金屬和半導(dǎo)體的雜化異質(zhì)結(jié)結(jié)構(gòu)可以協(xié)同增強PTT。例如,張海元課題組制備了Bi2S3-Au 異質(zhì)結(jié)納米棒(圖5(a))[63]。和單獨的Bi2S3相比,Bi2S3-Au 具有更多的深層缺陷。因此,在808 nm 激 光 照 射 下,Bi2S3-Au 結(jié) 構(gòu) 更 有利于激發(fā)電子和空穴的非輻射衰減以產(chǎn)生更多的聲子,從而通過強烈的晶格振動向周圍介質(zhì)釋放熱量。因此,與Bi2S3(33.58%)相比較,Bi2S3-Au(51.06%)的光熱轉(zhuǎn)換效率有顯著的提高。在此基礎(chǔ)上,我們課題組針對稀土釩酸鹽半導(dǎo)體在近紅外波段光學吸收不足的問題,設(shè)計了稀土釩酸鹽半導(dǎo)體/貴金屬(Ce-VO4/Ag, NdVO4/Au)異質(zhì)結(jié)納米結(jié)構(gòu),有效增強了稀土釩酸鹽半導(dǎo)體的光熱轉(zhuǎn)換能力,并提高了抗腫瘤療效(圖5(b)、(c))[64-65]。此外,一些其他的異質(zhì)結(jié)結(jié)構(gòu)耦合體,例如Cu2MoS4/Au、Au-Cu9S5、AuNR@Cu2-xSe、Au/Fe3O4等,在光熱轉(zhuǎn)換效率性能上面均有顯著的提升[66-69]。

圖5 (a)808 nm 激光照射下Bi2S3和Bi2S3-Au 的光熱機理圖[63];(b)CeVO4/Ag 的合成機理圖[64];(c)NdVO4/Au 的LSPR 機理圖[65]。Fig.5 (a)Schematic illustration of photothermal mechanism of Bi2S3 and Bi2S3-Au under 808 nm irradiation[63].(b)Schematic illustration of the synthesis process of CeVO4/Ag[64].(c)The proposed mechanism for LSPR effect of NdVO4/Au[65].
4.1.3 近紅外生物窗口選擇
光作為PTT 的一個重要參數(shù),已受到科研工作者的廣泛關(guān)注。與第一近紅外生物窗口(NIR-Ⅰ,700~980 nm)相比,第二近紅外生物窗口(NIR-Ⅱ,1 000~1 400 nm)可顯著降低組織自熱,提高組織穿透深度[70]。更重要的是,在NIR-Ⅱ生物窗口,安全的最大允許暴露(MPE)激光功率密度為1 W·cm-2,而在NIR-Ⅰ窗口僅為0.33 W·cm-2[71]。因此,在NIR-Ⅱ生物窗口內(nèi)探尋具有高光熱轉(zhuǎn)換效率的PTAs,對于提高組織深部腫瘤的治療效果是極其重要的。例如,施劍林課題組通過兩步液相剝離法設(shè)計了二維可生物降解的碳化鈮[72],其具有高光熱轉(zhuǎn)換效率(808 nm 激發(fā):36.5%,1 064 nm 激發(fā):46.65%),在NIR-Ⅰ和NIR-Ⅱ生物窗口內(nèi)均實現(xiàn)了有效的PTT(圖6(a))。張洪杰課題組設(shè)計了一維Fe2P(圖6(b))[71],其在808 nm 處的光熱轉(zhuǎn)換效率為55%,在1 064 nm 處的光熱轉(zhuǎn)換效率為56.6%。在安全的MPE 范圍內(nèi),和NIR-Ⅰ(808 nm,0.3 W·cm-2)相比,腫瘤在1 064 nm(0.5 W·cm-2)激光輻照下可完全消融(圖6(c))。此外,F(xiàn)e3O4@CuS、Au@Cu2-xS、Bi、Cu3BiS3等納米材料在NIR-Ⅱ窗口內(nèi)也具有優(yōu)異的光熱轉(zhuǎn)換性能[73-75]。

圖6 (a)碳化鈮在NIR-Ⅰ和NIR-Ⅱ生物窗口內(nèi)體內(nèi)光熱腫瘤消融示意圖[72];(b)Fe2P 的合成過程和體內(nèi)治療示意圖[71];(c)不同治療模式后小鼠照片、離體腫瘤照片以及腫瘤切片[71]。Fig.6 (a)Schematic illustration of Nb2C for in vivo photothermal tumor ablation in NIR-Ⅰand NIR-Ⅱbio-windows[72].(b)Diagram of Fe2P synthesis and treatment mechanism[71].(c)Photos of mice,excised tumors,and tumor sections after different treatment models[71].
在PTT 中,選擇合適的激光輻照強度一直是困擾人們的一個難題。一方面,高功率激光會對腫瘤附近的正常組織造成不可避免的熱損傷;另一方面,低功率激光不能完全消滅殘存的癌細胞,往往導(dǎo)致腫瘤復(fù)發(fā)。因此,提高納米材料的光熱轉(zhuǎn)換效率,使輻照近紅外激光的功率密度在人體可耐受的MPE 范圍內(nèi)發(fā)揮顯著療效,對于PTT 未來的發(fā)展是至關(guān)重要的。
4.2 聯(lián)合治療解決單一PTT 療效欠佳
雖然PTT 具有較高的特異性和可忽略的侵襲性,但NIR 光在腫瘤組織中穿透深度有限,在激光輻射范圍之外的腫瘤無法被完全消融,導(dǎo)致腫瘤復(fù)發(fā)和轉(zhuǎn)移。因此,單一的PTT 往往不能徹底治愈腫瘤,特別是對于較大的腫瘤,以及伴有遠端轉(zhuǎn)移性和擴散性的病灶。令人感到鼓舞的是PTT 介導(dǎo)的熱效應(yīng)具有一些功能性效用,如控制藥物釋放、調(diào)節(jié)細胞內(nèi)基因表達和酶活性、觸發(fā)抗腫瘤免疫響應(yīng)、增加靶向組織的化學反應(yīng)等[76]。因此,將PTT 與其他治療方法聯(lián)合使用,為協(xié)同增強抗腫瘤療效提供了一種有效的策略。
目前,PTT 聯(lián)合化療、放療、基因治療、化學動力學治療(CDT)、光動力治療(PDT)、聲動力治療(SDT)、饑餓治療、氣體治療(GT)、熱動力治療、酶動力治療、免疫治療、以及基于PTT 的多模態(tài)治療模式已被大量報道(圖7)[77-78]。例如,張先正課題組制備了PEG-cRGD 修飾的MoTe2納米片,并高效負載抗癌藥物DOX,實現(xiàn)了協(xié)同增強的化療/PTT(圖8(a))[79];Younis 等將NIR 激發(fā)的光動力試劑吲哚菁綠(ICG)錨定在了雙等離子光熱試劑(Au 納米棒/MoS2異質(zhì)結(jié))上,實現(xiàn)了聯(lián)合的PTT/PDT(圖8(b))[80];劉揚中課題組制備了單原子錳,實現(xiàn)了聯(lián)合的酶動力和光熱抗腫瘤治療(圖8(c))[81];蔡稱心課題組制備了MCF-7 細胞膜包裹的空心多孔Cu7S4納米球(HPCu7S4@MCF-7),其不僅可以實現(xiàn)有效的PTT,還可以在腫瘤微環(huán)境的觸發(fā)下催化羥基自由基(·OH)和硫化氫(H2S)氣體的產(chǎn)生,從而促進CDT 和GT(圖8(d))[82];在最近的一項工作中,陳填烽課題組通過將Au 裝載入Te 納米棒的中心,并在Te 納米棒表面包裹一層Pd,制備了BTe-Pd-Au 三元異質(zhì)結(jié)結(jié)構(gòu),獲得了協(xié)同的放療/PTT,并觸發(fā)了一系列抗腫瘤免疫響應(yīng)(圖8(e))[83];此外,我們課題組制備了多功能的空心Cu2MoS4(CMS)擔載葡萄糖氧化酶(GOx)的納米體系(CMS@GOx),其作為一種具有酶活性的疫苗類納米治療劑實現(xiàn)了級聯(lián)的CDT/PDT/PTT/饑餓治療/免疫治療的高效聯(lián)合治療(圖8(f))[84]。

圖7 近紅外光激活納米藥物PTT 協(xié)同抗腫瘤治療模式[77]Fig.7 The scheme of near-infrared light activated nanomedicines for PTT-synergistic cancer treatment[77]
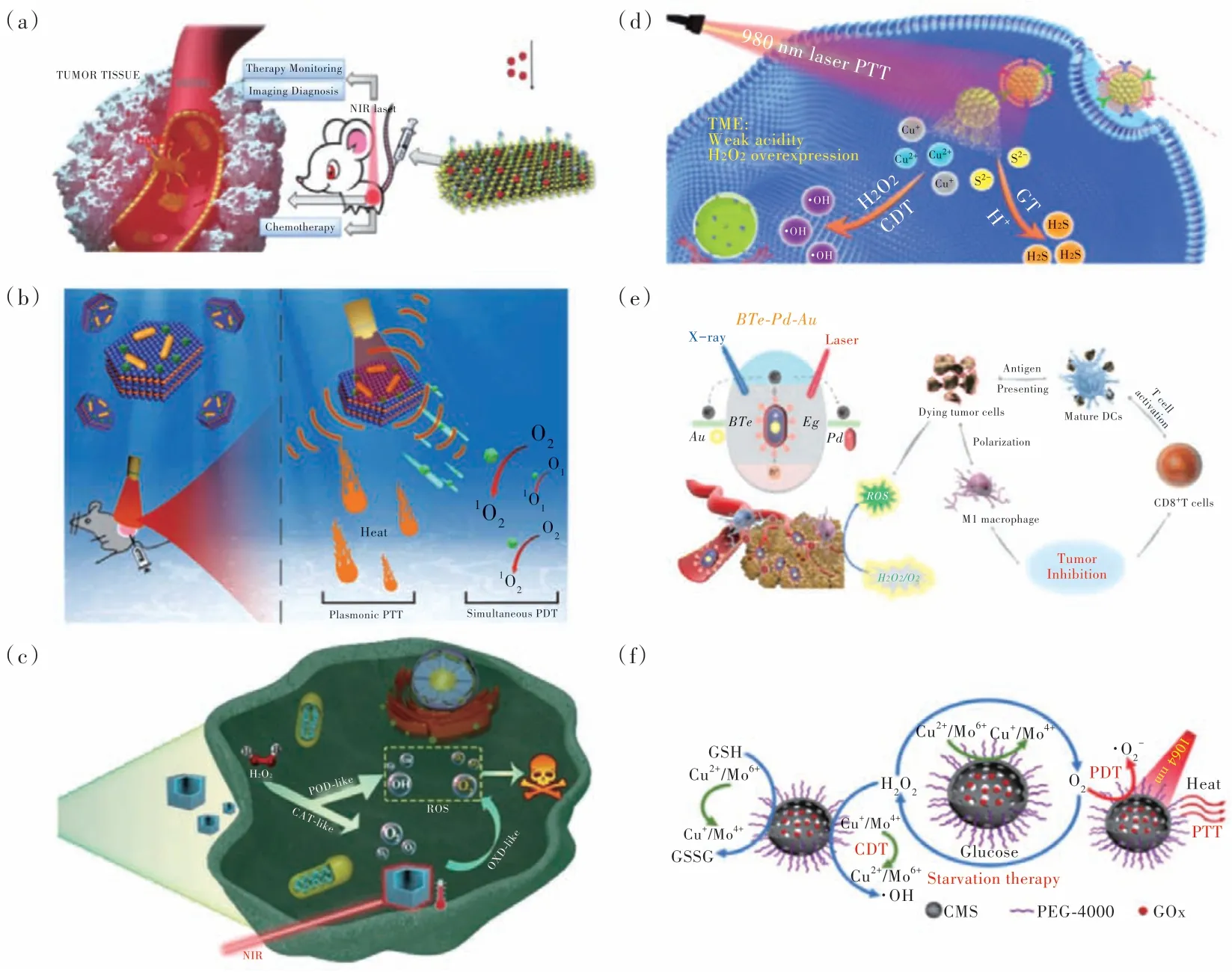
圖8 (a)MoTe2-PEG-cRGD/DOX 用于熱成像指導(dǎo)的協(xié)同PTT 和化療[79];(b)Au/MoS2-ICG 納米平臺誘導(dǎo)PDT/協(xié)同等離子體PTT 工作機制示意圖[80];(c)Mn 單原子納米酶用于協(xié)同酶催化和光熱療法的抗腫瘤治療示意圖[81];(d)基于Cu7S4@MCF-7 納米平臺的協(xié)同PTT/CDT/GT 癌癥治療策略[82];(e)BTe-Pd-Au 異質(zhì)結(jié)構(gòu)增強放療、PTT 和激活免疫響應(yīng)機制示意圖[83];(f)CMS@GOx 的協(xié)同PTT/PDT/CDT/饑餓治療機理圖[84]。Fig.8 (a)MoTe2-PEG-cRGD/DOX for thermal imaging-guided PTT and chemotherapy[79].(b)Schematic illustration of the working mechanism of the Au/MoS2-ICG nanoplatform to induce simultaneous PDT/synergistic plasmonic PTT[80]. (c)Schematic illustration of Mn-based single-atom enzyme for tumor therapy utilizing the synergetic enzyme catalysis and PTT[81].(d)Illustration of the PTT/CDT/GT synergetic strategy for cancer treatment based on the Cu7S4@MCF-7 nanoplatform[82].(e)Schematic illustration of the mechanism for enhancing radiotherapy,photothermal therapy and activating immunomodulatory potential by BTe-Pd-Au heterostructure[83].(f)Mechanism illustration of CMS@GOx-based synergistic PTT/PDT/CDT/starvation therapy[84].
受益于先進的納米技術(shù),多功能納米材料的智能設(shè)計使得在單一體系中集成多種治療方式的聯(lián)合治療展現(xiàn)出巨大的優(yōu)勢。基于PTT的聯(lián)合治療是一種有效的癌癥治療方法,其可通過將每種治療方法的優(yōu)勢結(jié)合起來,并彌補不同療法的缺陷,從而實現(xiàn)“1+1>2”的治療效果。因此,設(shè)計性能優(yōu)異的納米材料以用于多模式協(xié)同治療,可大幅度提高治療效果,有效治療對單一療法有耐藥性的惡性腫瘤。
4.3 解決PTAs 腫瘤富集量不足
目前,基于納米材料的光熱治療與臨床腫瘤治療仍存在一定的差距,這是由于納米材料在尾靜脈給藥后需經(jīng)歷五步級聯(lián)遞送過程,即靜脈注射進入血液循環(huán)、通過高滲透性和滯留(EPR)效應(yīng)富集在腫瘤部位、滲透到腫瘤組織內(nèi)部、腫瘤細胞內(nèi)吞和細胞內(nèi)藥物釋放。由此可見,光熱納米材料在腫瘤部位的富集是制約光熱治療最終消融效果的一個重要因素[85]。基于此,科研工作者已開發(fā)出多種靶向PTT 模式。根據(jù)識別位點的位置,可將其分為下述三種類型。
4.3.1 細胞外靶點
細胞外靶點是指存在于腫瘤微環(huán)境(TME)中的識別位點。由于實體腫瘤代謝旺盛、生長迅速,腫瘤周圍組織產(chǎn)生缺氧、酸性、血管增生、酶過表達等極端環(huán)境[86]。通過利用癌變組織和正常組織的不同,可實現(xiàn)腫瘤的特異性治療。例如,Song等在對患者腫瘤樣品進行分析時,發(fā)現(xiàn)低密度脂蛋白受體(LDLR)是在腫瘤細胞中過表達的有效的乏氧標志物(圖9(a))[87]。因此,他們使用LDLR抗體作為乏氧靶向配體,并與光敏劑二氫卟吩Ce6、乏氧激活的抗癌藥替拉扎明TPZ 和配體聚乙二醇PEG 自組裝,形成了CPTA 復(fù)合物。該復(fù)合物可有效靶向乏氧癌細胞,并實現(xiàn)協(xié)同的PTT/PDT/化療/放療。
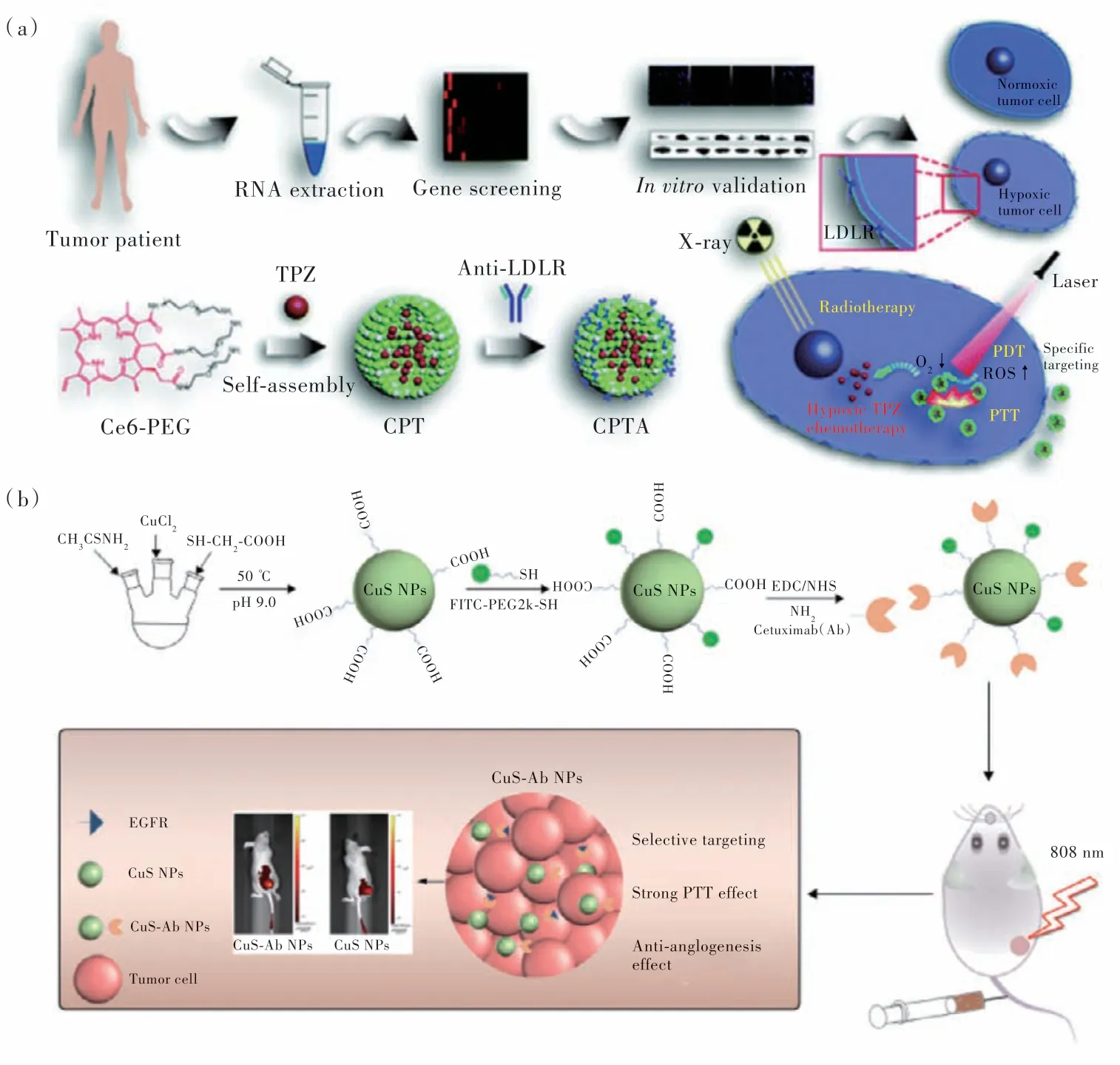
圖9 (a)乏氧標志物LDLR 的基因篩選、CPTA 納米顆粒的形成、以及腫瘤細胞乏氧靶向和協(xié)同多模態(tài)治療示意圖[87];(b)FITC-CuS-Ab NPs 的合成及靶向治療示意圖[89]。Fig.9 (a)Illustration of gene screening for hypoxia marker LDLR,the formation of CPTA nanoparticles,and hypoxic targeting and synergetic multimodal therapy in tumor cells[87].(b)Schematic diagram of synthesis and targeting therapy of FITCCuS-Ab NPs[89].
4.3.2 細胞內(nèi)靶點
細胞外靶點是指受體存在于腫瘤細胞膜表面。由于細胞是相對獨立的空間,物質(zhì)的攝入需要嵌入細胞膜上的受體的協(xié)助。因此,細胞膜上會產(chǎn)生特定的受體來轉(zhuǎn)移不同的物質(zhì),包括離子、小分子和生物大分子。由于腫瘤細胞代謝異常,許多受體過度表達,例如整合素αvβ3、表皮生長因子受體(EGFR)、葉酸受體(FR)、生物素受體(BR)、轉(zhuǎn)鐵蛋白受體(TfR)、CD44 受體等[88]。基于此,Li 等制備了西妥昔單抗(Ab)修飾的CuS 納米顆粒(CuS-Ab)(圖9(b))[89]。利用CuS-Ab 納米平臺,Ab 不僅可以定向靶向癌細胞膜上過表達的EGFR,還可以通過阻斷EGFR 的磷酸化來阻止腫瘤的生長、轉(zhuǎn)移和復(fù)發(fā)。該納米體系的體外和體內(nèi)實驗結(jié)果表明,在Ab 的協(xié)助下,CuS 可以有效地富集在腫瘤部位,具有良好的光熱腫瘤消融效果。
4.3.3 亞細胞器靶點
亞細胞器靶點是指將PTAs 與細胞器靶向配體相結(jié)合,因此PTAs 在內(nèi)吞后能有效地誘導(dǎo)細胞器的凋亡。由于細胞器(細胞核、線粒體、溶酶體、內(nèi)質(zhì)網(wǎng)、高爾基體)中含有熱敏蛋白和遺傳物質(zhì),細胞器很容易被破壞,可在低劑量輻照強度下造成細胞死亡,從而減少對周圍正常組織的損傷[90]。因此,細胞器靶向成像和治療受到了廣泛關(guān)注。Pan 等設(shè)計了細胞核靶向的TAT 肽功能化的Au納米棒(GNRs-NLS)(圖10(a)),其可有效增加Au 納米棒的細胞內(nèi)吞以及細胞核的藥物遞送,從而在較低的功率密度下實現(xiàn)了選擇性的PTT[91]。Li 等(圖10(b))設(shè)計了內(nèi)質(zhì)網(wǎng)靶向FAL 多肽修飾的吲哚菁綠(ICG)偶聯(lián)的空心金納米球(FAL-ICGHAuNS),并將其與可逆轉(zhuǎn)乏氧TME 的供氧血紅蛋白(Hb)脂質(zhì)體(FAL-Hb lipo)一起注射入小鼠體內(nèi)[92]。在近紅外光輻照下,該納米體系可有效地誘導(dǎo)內(nèi)質(zhì)網(wǎng)壓力以及細胞膜表面鈣網(wǎng)蛋白的暴露,實現(xiàn)了內(nèi)質(zhì)網(wǎng)靶向的PTT/PDT促進的免疫治療。
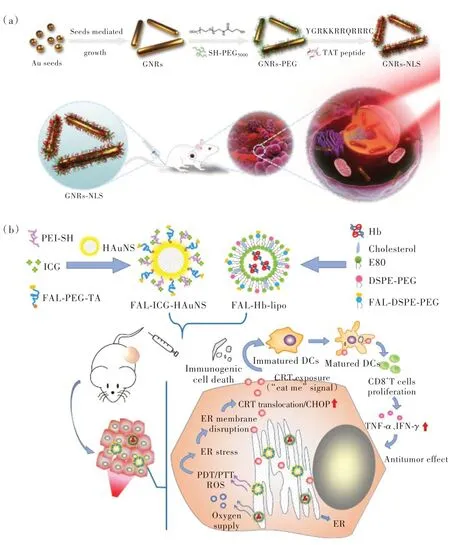
圖10 (a)GNRs-NLS 合成過程及核靶向光熱治療示意圖[91];(b)FAL-ICG-HAuNS 和FAL-Hb-lipo 抗腫瘤機理,內(nèi)質(zhì)網(wǎng)靶向光熱/光動力療法增強免疫原性癌細胞死亡和抗癌效果示意圖[92]。Fig.10 (a)Schematic illustration of the synthetic procedure and nuclear targeted photothermal therapy of GNRs-NLS[91].(b)The antitumor mechanism of FAL-ICG-HAuNS plus FAL-Hb-lipo. Schematic illustration of enhanced immunogenic cancer cell death and anticancer effect induced by endoplasmic reticulum-targeting photothermal/photodynamic therapy[92].
總而言之,近年來,具有靶向功能的PTAs在精準癌癥治療領(lǐng)域展現(xiàn)了巨大的優(yōu)勢。這些智能PTAs可利用EPR 效應(yīng)、受體介導(dǎo)的細胞內(nèi)吞作用、或細胞膜包覆的同源靶向策略,促進選擇性的癌細胞攝取,提高治療效果,并最小化全身副作用。
4.4 解決PTT 對正常組織的熱損傷
盡管將PTT 與其他治療模式整合到一個納米體系中進行協(xié)同治療具有顯著的抗腫瘤效果,但由于這種聯(lián)合治療模式缺乏對腫瘤部位的特異性,往往會對腫瘤周圍的正常組織和器官造成不可避免的熱損傷。因此,一方面,針對腫瘤微環(huán)境(TME)獨特的特征(弱酸性、乏氧、過表達的過氧化氫和谷胱甘肽等),設(shè)計TME 激活的納米復(fù)合材料實現(xiàn)“刺激-響應(yīng)”性的精準靶向癌癥治療,將為PTT 的生物安全性提供有效的保障[93]。另一方面,使用正常組織可耐受的溫度(38~43 ℃)實施低溫PTT,避免對腫瘤周圍健康組織和器官的損傷,對未來的臨床轉(zhuǎn)化是極其必要的[94]。
4.4.1 腫瘤微環(huán)境激活的PTAs
大量研究證據(jù)表明,半胱硫氨酸-β-合成酶的上調(diào)增加了結(jié)直腸癌微環(huán)境中內(nèi)源性H2S 的產(chǎn)生[95]。因此,楊仕平課題組利用內(nèi)源性H2S 和無光熱性能的Cu2O 在結(jié)直腸腫瘤部位的原位反應(yīng),生成了具有光熱性能的Cu9S8,實現(xiàn)了TME 激活的PTT(圖11(a))[96]。在此基礎(chǔ)上,該課題組進一步制備了Au@Cu2O 的金屬半導(dǎo)體異質(zhì)結(jié)結(jié)構(gòu)(圖11(b))[97]。當Au@Cu2O 通過高滲透長滯留(EPR)效應(yīng)靶向到結(jié)直腸癌腫瘤部位時,腫瘤中內(nèi)源性的H2S 與Au@Cu2O 在原位發(fā)生反應(yīng)生成Au@Cu9S8。由于局域表面等離子共振(LSPR)耦合場的增強,Au@Cu9S8在近紅外區(qū)展現(xiàn)出強吸收,實現(xiàn)了增強的PTT。此外,我們課題組制備了Cu2O@CaCO3復(fù)合體(圖11(c))[98]。在弱酸性和結(jié)直腸癌腫瘤微環(huán)境觸發(fā)下,CaCO3礦化層分解釋放Ca2+離子,實現(xiàn)了鈣超載治療。隨后,裸露的Cu2O 和內(nèi)源性H2S 反應(yīng)生成了在NIR Ⅱ區(qū)具有強吸收的可代謝的超小Cu31S16,實現(xiàn)了有效的PTT和PDT。該納米體系可將促腫瘤生長的M2 型腫瘤相關(guān)巨噬細胞(TAMs)調(diào)控為可殺傷腫瘤的M1 型TAMs,逆轉(zhuǎn)了免疫抑制的腫瘤微環(huán)境。進一步結(jié)合CD47 檢查點封鎖,可顯著地激活免疫響應(yīng),有效治療原發(fā)腫瘤,并抑制癌癥的復(fù)發(fā)和轉(zhuǎn)移。
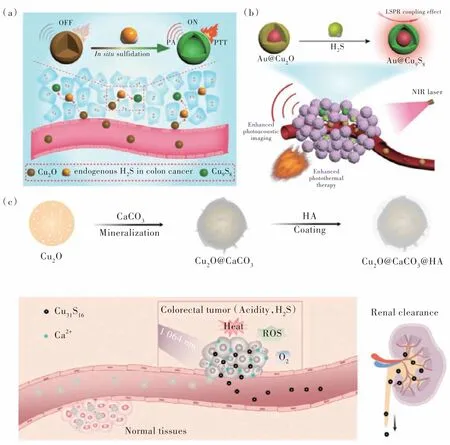
圖11 (a)Cu2O 和內(nèi)源性H2S 在結(jié)直腸癌處原位反應(yīng)觸發(fā)的PTT[96];(b)基于LSPR 效應(yīng),內(nèi)源性H2S 觸發(fā)的Au@Cu2O 增強的結(jié)直腸癌PTT[97];(c)Cu2O@CaCO3@HA 的合成路線和結(jié)直腸癌腫瘤微環(huán)境觸發(fā)的Cu2O@CaCO3@HA 的生物分解、抗腫瘤響應(yīng)和腎清除過程[98]。Fig.11 (a)The activated PTT by in situ reaction of Cu2O and endogenous H2S in colon cancer[96].(b)Based on the LSPR effect,the endogenous H2S-triggered Au@Cu2O with enhanced PTT for colon cancer[97].(c)The synthetic route of Cu2O@CaCO3@HA,and the colorectal cancer TME-triggered bio-decomposition,anti-tumor responses and renal clearance process[98].
盡管PTT 可以實現(xiàn)病灶的光定位,有效抑制腫瘤生長。但當光穿透過PTAs聚集的健康組織時,會對其造成不可避免的熱損傷。因此,設(shè)計在體液循環(huán)過程中處于“休眠”狀態(tài)的PTAs前體,并通過利用TME 異常的生化指標作為刺激因素,使其在腫瘤部位轉(zhuǎn)化為具有優(yōu)異的光熱轉(zhuǎn)換性能的PTAs,可實現(xiàn)腫瘤部位精準的PTT,有效避免毒副作用。
4.4.2 低溫PTT
低溫PTT 正在逐漸興起,其克服了傳統(tǒng)PTT 的耐熱性和不良反應(yīng)等缺點,在未來的臨床應(yīng)用中顯現(xiàn)出巨大的潛力[99]。然而,由于癌細胞能激活其自我保護路徑,如熱休克蛋白(HSPs),以快速修復(fù)低熱造成的細胞損害,低溫PTT 的治療效果往往不夠理想[100]。因此,制備功能化納米醫(yī)藥以提高低溫PTT 的抗癌效果是極其重要的。目前,國內(nèi)外學者已設(shè)計出了幾種有效的低溫PTT 策略。例如,(1)通過共價偶聯(lián)或非共價包封將小分子HSPs抑制劑與光熱劑共遞送,可降低癌細胞的耐熱性。蘇州大學劉莊課題組將小分子HSP 抑制劑藤黃酸(GA)載入到由金屬離子、吲哚菁綠和PEG 形成的一維納米配位聚合物中,從而實現(xiàn)低溫PTT(圖12(a))[101]。相似的小分子抑制劑還有槲皮苷、17-AGG、BIIB021、
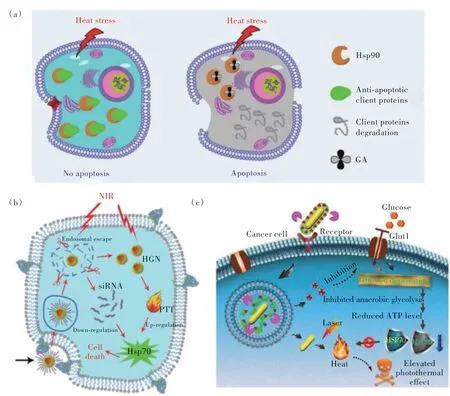
圖12 (a)藤黃酸負載的配位聚合物的低溫PTT[101];(b)siRNA 負載的空心金納米殼敏化的低溫PTT[102];(c)GNR/HA-DC通過干擾厭氧糖酵解代謝致敏腫瘤低溫PTT 示意圖[103]。Fig.12 (a)GA-loaded coordination polymers for mild PTT[101].(b)The low-temperature PTT sensitized by siRNA loaded hollow gold nanoshells[102].(c)Schematic illustration of GNR/HA-DC for sensitizing tumor to mild PTT by interfering with the anaerobic glycolysis metabolism[103].
SNX-2112、GM、VER-155008、2-PES、AHGDM、EGCG和LY2944002 等[94]。(2)siRNA 可以直接控制遺傳信息流,在癌癥治療中具有巨大的潛力。它通過破壞相應(yīng)信使RNA(mRNA)的翻譯來抑制靶蛋白的表達。基于此,顧月清課題組設(shè)計了干擾RNA(siRNA)連接的空心Au納米殼,通過siRNA 對腫瘤細胞中HSP70 表達的沉默,實現(xiàn)低溫PTT 對腫瘤的消融(圖12(b))[102]。(3)HSPs 的表達與三磷酸腺苷(ATP)的含量密切相關(guān)。因此,抑制腫瘤內(nèi)ATP的產(chǎn)生被認為是抑制腫瘤耐熱性的一種有效的方法。武漢大學張先正課題組通過將葡萄糖轉(zhuǎn)運載體(Glut1)抑制劑雙氯芬酸(DC)、光熱試劑Au 納米棒以及靶向劑透明質(zhì)酸整合在一起,制備了GNR/HA-DC 納米體系(圖12(c))[103]。通過DC 誘導(dǎo)的Glut1 下調(diào),有效地抑制了葡萄糖代謝和ATP 依賴的HSPs的合成。(4)在PTT 治療過程中,自噬傾向于通過“修復(fù)”熱誘導(dǎo)的細胞損傷來抑制治療效果。因此,具有自噬抑制能力的功能化光熱納米劑可以協(xié)同增強低溫PTT 的療效。程義云課題組設(shè)計了自噬抑制劑氯喹(CQ)裝載的聚多巴胺體系,并通過實驗證明了抑制自噬能顯著增強低溫PTT 療效(圖13(a))[104]。(5)然而,在某些情況下,自噬可能對腫瘤抑制起積極作用。例如,自噬啟動因子和腫瘤抑制因子beclin 1 誘導(dǎo)的自噬過程可破壞自噬的穩(wěn)態(tài)功能,激活自噬性細胞死亡途徑。因此,促進這一自噬途徑有利于提高低溫PTT 的治療效果。程義云課題組也通過將聚多巴胺與beclin 1 衍生的多肽、PEG 和RGD 多肽結(jié)合得到了PPBR 納米藥物(圖13(b))[105]。PPBR 可促進癌細胞的自噬活性,進一步顯著提高低溫光熱殺傷細胞的效果。(6)一氧化氮(NO)作為一種氣體分子,其在腫瘤組織部位具有很好的擴散能力。并且,NO也可以作為細胞內(nèi)次級信使,參與并調(diào)節(jié)許多生理過程。例如,NO在濃度較高時可直接導(dǎo)致細胞死亡,也可通過信號通路調(diào)控增敏化療或放療。也有研究報道,NO可抑制自噬等亞細胞降解過程,加速細胞凋亡性死亡。其于此,趙宇亮課題組設(shè)計了Bi2S3擔載NO供體BNN的納米體系[106]。在該體系中,NO可抑制線粒體保護性自噬,使細胞色素c從線粒體中成功釋放,誘導(dǎo)細胞凋亡,從而實現(xiàn)NO 敏化的低溫PTT(圖13(c))。(7)鐵死亡發(fā)生的過程伴隨著大量的脂質(zhì)過氧化物(LPO)和活性氧物種(ROS)的產(chǎn)生[107]。LPO 能自發(fā)形成醛降解產(chǎn)物,使HSPs的伯胺交聯(lián),從而破壞HSPs的結(jié)構(gòu)和功能[108]。此外,具有高度化學活性的LPO 能進一步自發(fā)產(chǎn)生大量的ROS,生成的ROS也可以與HSPs發(fā)生反應(yīng)形成交聯(lián)物[109]。基于這一HSPs清除途徑,我們課題組制備了Pd SAzyme,其可以產(chǎn)生大量的羥基自由基((OH),并消耗谷胱甘肽(GSH),從而誘導(dǎo)鐵死亡。鐵死亡過程中產(chǎn)生的大量的LPO和ROS可有效消除癌細胞中的HSPs,從而實現(xiàn)了鐵死亡促進的低溫PTT(圖13(d))[110]。

圖13 (a)氯喹觸發(fā)的自噬抑制敏化的低溫PTT 示意圖[104];(b)beclin 1 誘導(dǎo)的自噬增強敏化的溫和PTT[105];(c)NO 氣體與溫和PTT 在腫瘤治療中的協(xié)同作用機制[106];(d)鐵死亡促進溫和PTT 機理[110]。Fig.13 (a)Scheme of CQ-triggered autophagy inhibition sensitized mild PTT[104].(b)Illustration depicts beclin 1-induced autophagy sensitizing mild PTT[105].(c)Synergistic mechanism of NO gas and mild PTT in cancer therapy[106].(d)Schematic illustration of the mechanism of ferroptosis-boosted mild PTT[110].
與傳統(tǒng)PTT 可能對病灶周圍健康組織造成熱損傷、引起炎癥、產(chǎn)生免疫抑制細胞因子、導(dǎo)致腫瘤復(fù)發(fā)和轉(zhuǎn)移相比,生物安全性能較高的低溫PTT 正蓬勃發(fā)展,其在癌癥治療領(lǐng)域取得了令人鼓舞的進展,具有巨大的臨床應(yīng)用潛力。我們相信,隨著醫(yī)學研究的不斷深入和納米技術(shù)的持續(xù)發(fā)展,低溫PTT將實現(xiàn)從實驗到臨床的轉(zhuǎn)化,從而提高惡性腫瘤治療效果,減少相關(guān)不良反應(yīng),改善患者的愈后生活。
5 總結(jié)及展望
本文針對PTT 目前存在的一些問題,總結(jié)了相應(yīng)的突破性的解決策略。主要包括:調(diào)控納米材料的形貌、構(gòu)建異質(zhì)結(jié)結(jié)構(gòu)以及選擇合適的光學窗口來提高納米材料的光熱轉(zhuǎn)換效率;設(shè)計多模態(tài)協(xié)同治療模式來克服單一PTT 的局限性;提高納米材料的腫瘤富集量來增強抗癌治療效果;以及構(gòu)建腫瘤微環(huán)境激活的PTAs 和設(shè)計低溫PTT 模式來提高藥物的生物安全性。
盡管PTT 已經(jīng)取得了許多鼓舞人心的進展,但在面向未來的臨床轉(zhuǎn)化中,PTT 仍然面臨著許多挑戰(zhàn)。(1)相較于紫外光/可見光,近紅外光(NIR),特別是NIR-Ⅱ光,組織穿透深度大大增加,但NIR 仍難以穿透深層組織,因此NIR 激活的納米藥物更適合于淺表腫瘤,如黑色素瘤。因此,利用光學傳輸技術(shù)將近紅外光源傳輸?shù)缴畈拷M織,以實現(xiàn)PTT 介導(dǎo)的組織深處的腫瘤治療將有效提高PTT 的應(yīng)用范圍。(2)相對于藥物小分子,納米顆粒(NPs)在體內(nèi)滯留時間較長,因此NPs 在體內(nèi)的潛在毒性是一個值得關(guān)注的問題。這種毒性不僅來自于NPs 本身,也來自于合成過程中涉及到的大多數(shù)溶劑和化學物質(zhì)。盡管NPs可能在短時間內(nèi)對細胞、器官或組織表現(xiàn)出較低的毒副作用,但其長期的細胞毒性和相關(guān)的免疫反應(yīng)應(yīng)該進一步地深入研究。減少安全隱患的一個可能的方向是設(shè)計可生物降解和可清除的NPs。例如,通過與可生物降解的有機二硫鍵結(jié)合或摻雜金屬錳離子來實現(xiàn)二氧化硅的生物降解性;將乙烯基鍵、噻吩部分、亞胺鍵或咪唑單元整合到有機聚合物納米顆粒中,也可以促進其在體內(nèi)降解。然而,提高NPs的生物降解性和清除能力可能會犧牲其穩(wěn)定性和血液滯留時間,導(dǎo)致腫瘤富集量較少。綜合這些因素,設(shè)計同時兼?zhèn)涠拘孕 ⒖山到狻⒛[瘤富集量高的PTAs是一項頗具挑戰(zhàn)性的工作。(3)平衡納米材料的光熱效果和快速代謝是未來光熱研究值得關(guān)注的問題。雖然設(shè)計尺寸小于腎臟過濾閾值的光熱納米材料(小于5 nm)可以避免納米材料在體內(nèi)長期滯留誘發(fā)的毒性,但由于腫瘤間質(zhì)存在高壓,小于5 nm的納米材料到達腫瘤部位后也會更容易從腫瘤組織返回到血管中,從而降低納米材料在腫瘤部位的富集,降低光熱治療效果。而已有文獻報道5~100 nm之間的納米材料在腫瘤組織中滯留時間更長,獲得的光熱治療效果更好。因此,設(shè)計能夠“按需調(diào)整尺寸”的納米PTAs將是未來的一個研究重點。(4)先確定納米材料在腫瘤部位富集最大量的時間點,再采取PTT是實現(xiàn)高效治療的前提。因此,將成像和治療整合到單一的納米平臺上,從而實現(xiàn)成像引導(dǎo)的精準癌癥治療,對未來PTT的臨床轉(zhuǎn)化具有指導(dǎo)性意義。
此外,PTT 的進一步發(fā)展不僅需要合成安全高效且多功能的PTAs,還需要創(chuàng)造新的實驗設(shè)備,同時實現(xiàn)納米顆粒的體內(nèi)示蹤、腫瘤部位的熱療、熱感檢測和健康參數(shù)的記錄。在解決了這些挑戰(zhàn)之后,近紅外光激活的納米藥物在未來的臨床實踐中將為癌癥的治愈帶來巨大的希望。
本文專家審稿意見及作者回復(fù)內(nèi)容的下載地址:http://cjl. lightpublishing. cn/thesisDetails#10.37188/CJL.20220118.

