不同生長天數‘熱研4號’王草青貯品質和微生物群落多樣性研究
龍仕和, 李雪楓, 潘俊歆, 常 曄, 史孟麗, 黃乃馨, 崔智海, 王 堅*
(1. 海南大學動物科技學院, 海南 海口 570228; 2. 海南大學林學院, 海南 海口 570228)
‘熱研4號’王草(Pennisetumpurpureum×P.americanum‘Reyan No.4’)是中國熱帶農業科學院熱帶牧草研究中心經多年試驗選育而成的多年生禾本科牧草,為象草(Pennisetumpurpureum)和美洲狼尾草(Pennisetumtyphoideum)的雜交品種[1]。該草具有品質好,生物產量高,光合作用強,可利用年限長,適應性和抗逆性強等特點,在廣東、海南、廣西和福建等熱帶亞熱帶地區廣泛種植[2],常作為反芻動物的優質青綠飼料。在海南,夏、秋季節高溫多雨王草生長旺盛,產量高,家畜短期內無法完全利用,因此,在王草生長旺盛季節將其調制成青貯飼料以緩解冬春季節飼料短缺成為確保反芻動物可持續發展的有效途徑。目前有關王草的青貯研究,眾多學者做了不少探討,如研究王草與不同農副產品混合青貯[3-4],王草青貯后的有氧穩定性[5-6],添加劑對王草青貯發酵品質的影響[7-8],不同刈割茬次王草表面附著的乳酸菌分布和青貯發酵品質等[9-10]。
近年來,海南地區臺風、極端降水等氣候頻率增加,導致牧草無法及時收獲,生產者必須調整牧草收獲時間以避免經濟損失。由于牧草在不同生長階段因其化學組分不同,進而影響其青貯發酵品質,是影響牧草青貯品質的主要因素之一[11-12]。牧草在生長早期含有較高的可溶性碳水化合物[13],相較于晚收割的牧草其干物質含量較低[14],在青貯過程中容易引起梭菌發酵導致干物質損失。牧草隨著生長時間延長,木質化程度增加,可溶性碳水化合物含量下降不利于青貯發酵[15]。目前,關于不同生長天數王草的青貯發酵品質和微生物群落的研究鮮有報道。本試驗擬對熱帶地區生長90,110,130 d的王草進行刈割青貯,研究其發酵品質和微生物群落多樣性,以期為熱帶地區王草青貯飼料的調制提供理論依據。
1 材料與方法
1.1 試驗材料
原料為熱研4號王草(以下簡稱王草),于2020年6月5日種植在海南大學熱帶農林學院試驗田。該試驗基地位于海南大學海甸校區(19° 32′ N,109° 35′ E),地處熱帶季風氣候區,年均氣溫22~26℃,年日照時間1 750~2 650 h,年均降水量1815 mm。基地0~20 cm深度土壤養分基本狀況為:pH值4.93,有機質1.98%,全氮1.28 g·kg-1,全磷0.88 g·kg-1,全鉀3.61 g·kg-1,堿解氮51.97 mg·kg-1,速效鉀95.75 mg·kg-1,速效磷15.82 mg·kg-1。
1.2 試驗設計
試驗采用隨機區組設計,設3個處理組:KM90S組(生長90 d)、KM110S組(生長110 d)和KM130S組(生長130 d),分別在青貯1,3,7,14和30 d后打開青貯袋取青貯飼料測定發酵品質和化學成分,對30 d的青貯樣品進行微生物群落分析,每個處理各個青貯時間點3次重復。
1.3 試驗方法
1.3.1王草原料處理 王草分別在生長90,110,130 d后將其刈割并帶回實驗室,用滅菌后的鍘刀將原料切短至2~3 cm并充分混合,將混合好的王草隨機選取15份(5個青貯時間×3個重復)樣品(每份300 g)裝入聚乙烯袋中,抽真空、密封,在室溫下青貯。另取3份鮮樣(每份300 g)用于化學成分測定,3份(每份10 g)用于微生物計數。
1.3.2青貯樣品處理 分別在青貯第1,3,7,14,30 d后打開青貯袋,每個樣品混勻后取20 g青貯料于100 mL錐形瓶中,加入70 mL蒸餾水,于4℃冰箱中浸提24 h后用4層紗布過濾得到浸提液用于測定pH、有機酸和NH3-N含量。剩余青貯料裝入信封中于65℃烘箱干燥72 h,烘干后用粉樣機粉碎然后經過40目篩用于測定化學成分。
1.3.3測定項目及方法 鮮樣和青貯樣置于65℃烘箱干燥72 h測定干物質(Dry matter,DM)含量;pH用pH計(PHS-3C精密pH計)對浸提液直接測定;蒽酮-硫酸比色法[16]測定可溶性碳水化合物(Water-soluble carbohydrates,WSC)含量;中性洗滌纖維(Neutral detergent fiber,NDF)和酸性洗滌纖維(Acid detergent fiber,ADF)含量通過范氏纖維分析法[17]進行測定;苯酚-次氯酸鈉比色法[18]測定氨態氮(Ammonia nitrogen,NH3-N)含量;粗蛋白質(Crude protein,CP)和總氮(Total nitrogen,TN)含量采用全自動凱氏定氮儀(K9860,山東海能科學儀器有限公司)進行測定;乳酸(Lactic acid,LA)、乙酸(Acetic acid,AA)、丙酸(Propionic acid,PA)和丁酸(Butyric acid,BA)含量通過高效液相色譜儀檢測(島津LC-20A,Carbomix H-NP,7.8 mm × 300 mm),流動相:2.5 mmol·L-1H2SO4溶液;流速:0.6 mL·min-1;柱溫箱溫度:55℃;檢測器:SPD-M20A;檢測波長:210 nm;進樣體積:5 μL。
1.3.4微生物計數 采用平板培養方法進行微生物計數。取10 g新鮮樣品與100 mL無菌生理鹽水(8.5 g·L-1)混合后進行連續梯度稀釋(10-1至10-7)。乳酸菌(Lactic acid bacteria,LAB)在MRS瓊脂(Solarbio Life Sciences Ltd. Co.,Beijing,China)上37℃厭氧培養24 h后計數。酵母和霉菌在馬鈴薯葡萄糖瓊脂(PDA;Solarbio Life Sciences Ltd. Co.,Beijing,China)上30℃有氧培養48 h后計數。腸桿菌在紫紅膽鹽葡萄糖瓊脂(VRBA;Solarbio Life Sciences Ltd. Co.,Beijing,China)上37℃有氧培養72 h后計數。
1.3.5微生物總DNA的提取 王草青貯30 d后,將青貯袋打開并充分混合,取3個重復樣品,每個重復取20 g青貯料放入三角瓶,加入180 mL去離子水,三角瓶在37℃,120 r·min-1的搖床里均質15 min,然后用四層紗布進行過濾,得到浸提液。取40 mL浸提液于8000 rpm離心15 min后棄掉上清液,用1 mL無菌PBS溶液將沉淀溶解并收集到1.5 mL離心管,然后在-20℃冰箱保存,用于總DNA的提取。
1.3.6PCR擴增及16S rRNA基因高通量測序 選用DNA提取試劑盒(DP302-02,天根生物技術有限公司)提取青貯飼料樣品中細菌的總DNA。利用前引物341F(5′-CCTACGGGNGGCWGCAG-3′)與后引物805R(5′-GACTACHVGGGTATCTAATCC-3′)獲取細菌V3~V4高變異區l6S rRNA基因。PCR擴增產物回收純化利用Qubit3.0 DNA檢測試劑盒對基因組DNA精確定量,采用lllumina公司的TruSeq TM DNA Sample PrepKit制備測序文庫。使用MiSeq測序儀進行2×300 bp的雙端測序并對結果進行分析,lllumina HiSeq測序及結果分析測序及序列物種信息由生工生物工程(上海)股份有限公司協助完成。使用Usearch軟件對測序序列進行聚類,對97%相似水平下的操作分類單元(OTU)進行生物信息統計分析。α多樣性(Alpha diversity)包括Shannon,Chao,Ace和Good's coverage指數通過Mothur計算。主成分分析(PCA)通過R軟件中的VEGEN包進行分析。優勢物種相對豐度柱狀圖通過R軟件進行計算。
1.4 數據分析
采用3(G)×6(E)完全隨機區組設計進行數據統計和分析,每個處理3個重復。數據處理使用的模型為Yijk=μ+Ti+Cj+TCij+Eijk,其中,Yij=因變量值,μ=總體均值,Ti=生長天數效應,Cj=青貯時間效應,TCij=生長天數×青貯時間互作效應,Eijk=隨機誤差。對微生物計數以10為底的對數轉換后進行數據分析,并以對數值表示。利用SPSS Statistics 26統計軟件進行數據分析。使用Duncan’s法對均值進行多重比較。P<0.05表明數據差異顯著,0.05≤P<0.10為存在趨勢。
2 結果與分析
2.1 不同生長天數王草原料化學特性及附著微生物數量
由表1可知,3組王草原料的WSC含量在40.28~71.76 g·kg-1DM之間。隨著生長天數延長,王草的DM含量顯著增加(143.92~217.11 g·kg-1DM)(P<0.05),CP含量顯著降低(P<0.05)。ADF和NDF含量隨著生長天數延長總體呈上升趨勢(P>0.05)。KM90S,KM110S和KM130S組王草的LAB數量分別為4.72,4.49和4.39 lg cfu·g-1FM,酵母和霉菌的數量在3.05~4.07 lg cfu·g-1FM之間,KM90S和KM130S組的腸桿菌數量顯著高于KM110S組(P<0.05)。
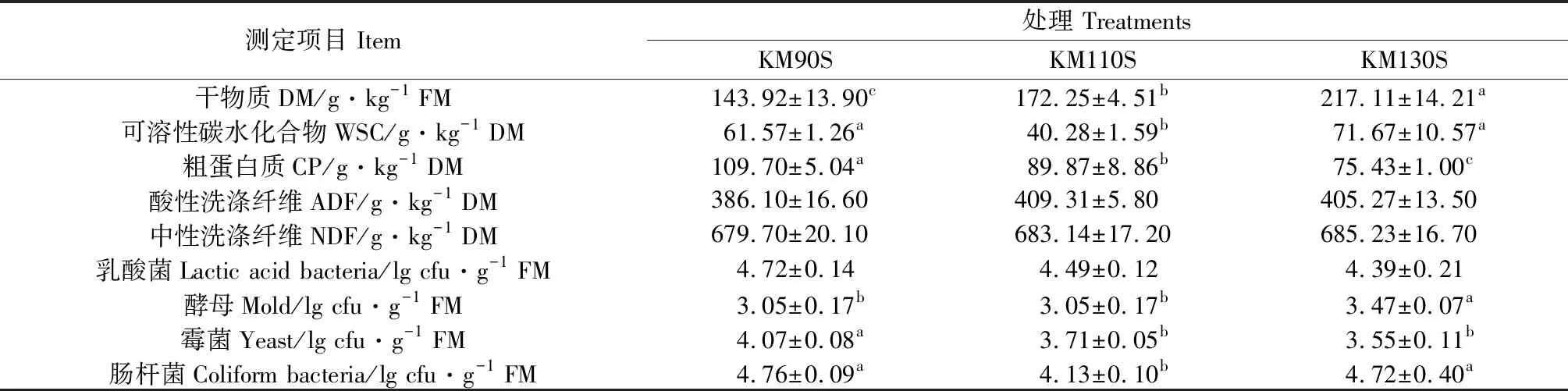
表1 不同生長天數王草原料化學特性及微生物組成Table 1 Chemical characteristics and microbial populations of king grass in different growth days
2.2 王草青貯過程中發酵品質的變化
由表2可知,KM110S和KM130S組的pH隨著青貯進行持續降低,均在青貯第30 d達到最低(P<0.05)。KM90S組的pH在青貯前7 d內變化不大,在青貯第14~30 d顯著下降(P<0.05)。與青貯第1 d相比,KM90S組的LA含量在青貯前7 d變化不大(P>0.05),隨后在青貯第14~30 d顯著增加(P<0.05)。KM110S和KM130S組的LA含量在整個青貯過程中持續增加,均在青貯第30 d達到最大(P<0.05)。青貯結束后,KM90S組的AA含量顯著高于另外2組(P<0.05)。青貯第7~30 d,KM110S組的LA/AA顯著高于另外2組(P<0.05)。三個試驗組的NH3-N含量隨著青貯時間延長增加(P<0.05),均在青貯第30 d達到最大,除青貯第3 d外,KM90S組的NH3-N含量高于KM110S和KM130S組。
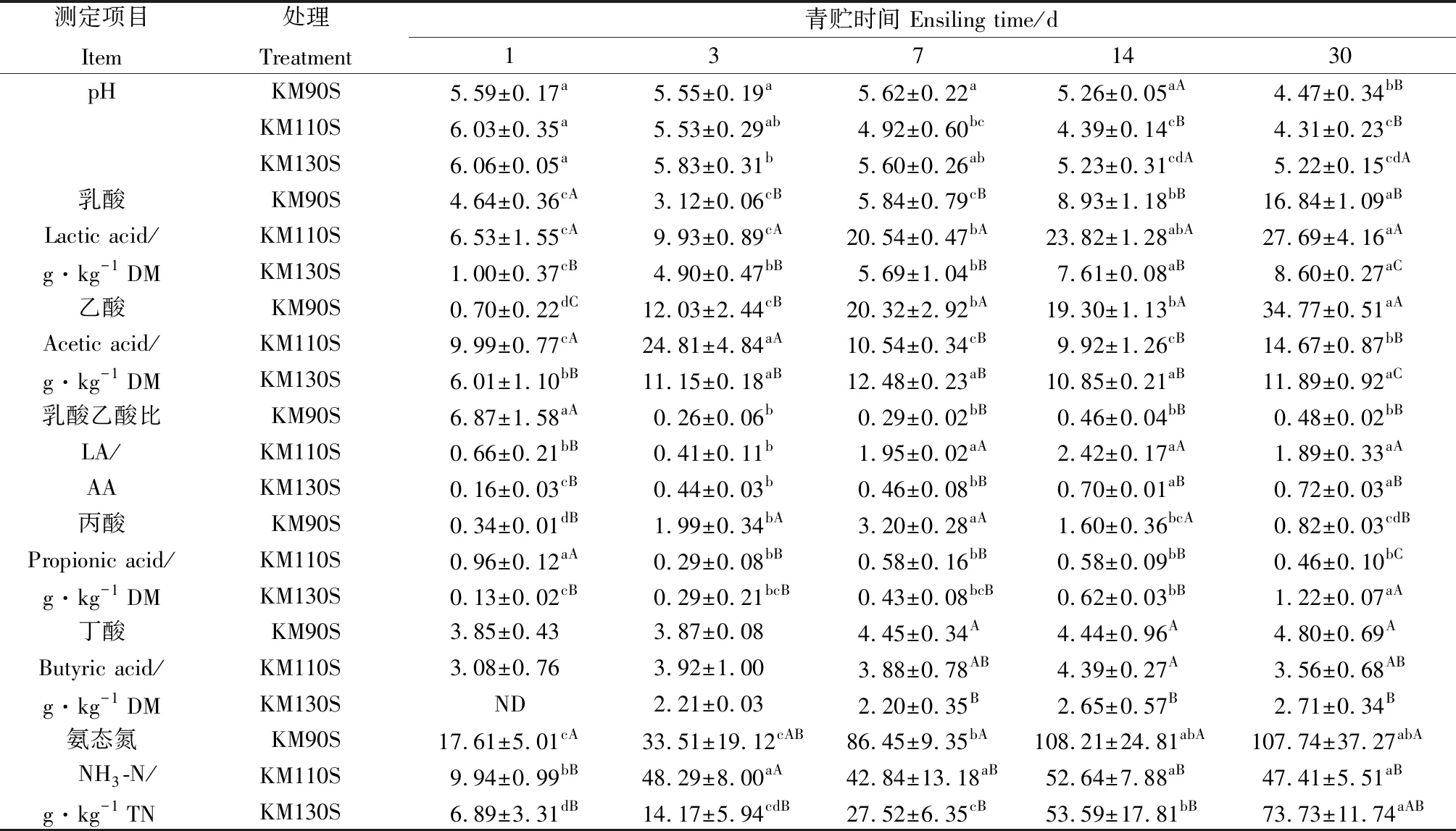
表2 王草青貯過程中發酵品質的變化Table 2 Changes in the fermentation quality of king grass silage during ensiling
2.3 王草青貯過程中化學成分和營養品質的變化
由表3可知,青貯結束后3組王草的DM含量顯著降低(P<0.05)。WSC含量隨著青貯時間的延長總體呈現為在青貯前7 d迅速下降(P<0.05),隨后下降速度減緩,均在青貯第30 d達到最低。與青貯第1 d相比,KM90S組的CP含量在青貯第14 d顯著降低(P<0.05)。KM90S組的ADF含量在青貯發酵期間持續增加,在青貯第14 d顯著增加(P<0.05)。KM130S組的NDF含量在青貯過程中呈增加趨勢,在青貯第30 d達到最大(P<0.05),KM110S組的NDF含量在青貯第7 d降低(P<0.05),隨后在青貯第7~30 d顯著增加(P<0.05)。
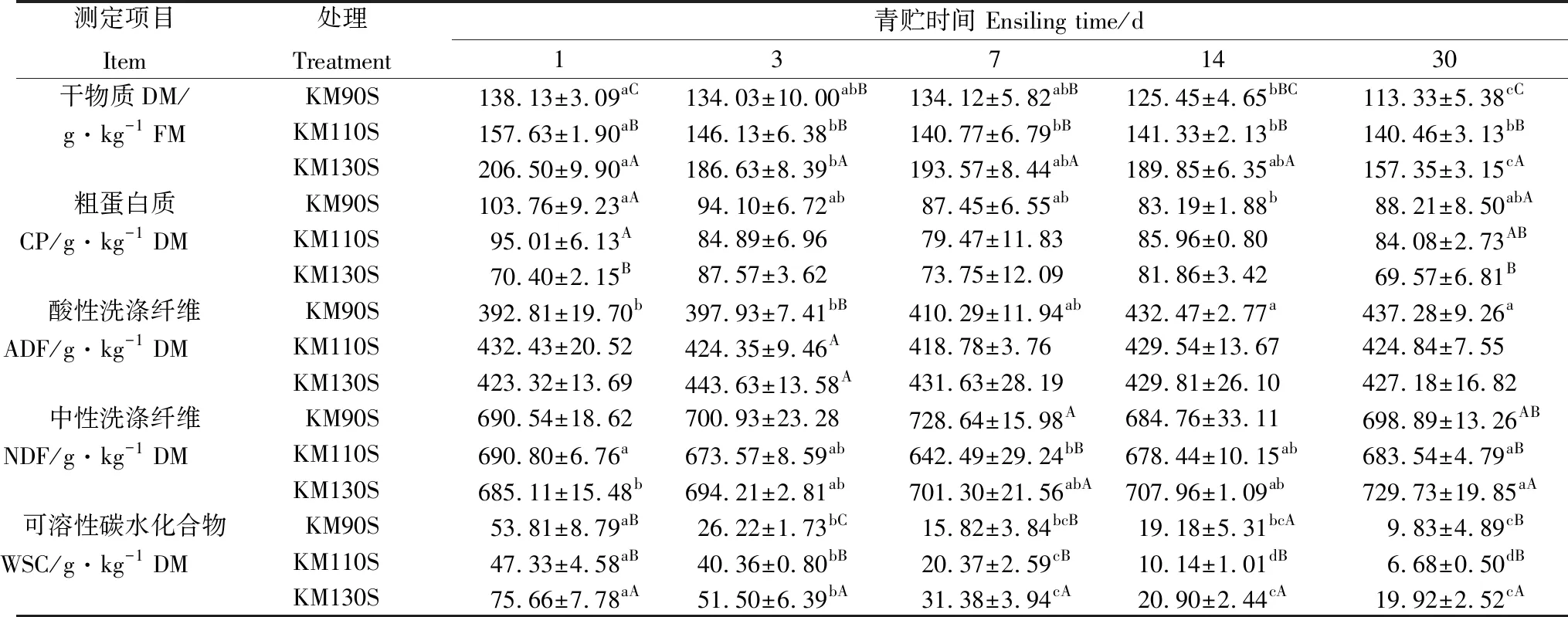
表3 王草青貯過程中化學成分和營養品質的變化Table 3 Changes in nutritional quality and chemical composition of king grass silage during ensiling
2.4 王草青貯30 d微生物α多樣性分析結果
微生物α多樣性分析結果見表4,KM90S,KM110S和KM130S組王草的青貯細菌OTU數分別為292,283,255個,Shannon和Chao指數隨著生長天數的延長呈下降趨勢。

表4 王草青貯30 d微生物α多樣性Table 4 Alpha diversity of microbial community diversity for king grass at 30 d silage
2.5 王草青貯30 d微生物β多樣性分析結果
青貯30 d后用主成分分析(PCA)對王草青貯樣品進行分析,由圖1可知,主成分1(PC1)和主成分2(PC2)對結果差異的貢獻度分別為83.46%和9.95%,不同生長天數王草青貯30 d后細菌群落的分布和結構存在明顯的分離和差異。
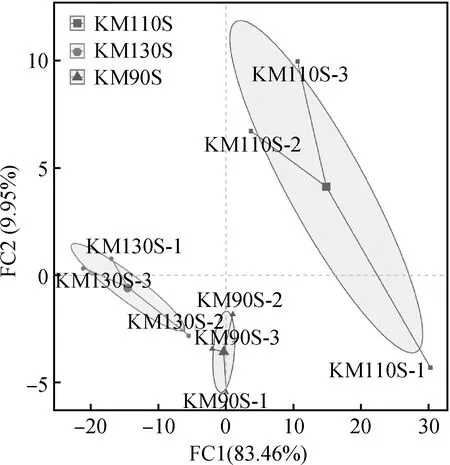
圖1 王草青貯30 d細菌群落PCA分析Fig.1 PCA analysis of the bacterial community of king grass silage at 30 days
2.6 王草青貯30 d微生物群落結構分析結果
圖2從門水平和屬水平揭示了不同生長天數王草青貯30 d樣品的微生物群落多樣性,厚壁菌門(Firmicutes)和變形菌門(Proteobacteria)總共占到了整個樣品門水平的95%~98%,其中KM110S組Firmicutes的相對豐度占到了44.90%,Proteobacteria的相對豐度占到了53.70%。KM90S和KM130S組Firmicutes的相對豐度分別占到了28.13%和21.96%,Proteobacteria的相對豐度分別占到了68.33%和76.58%。共在屬水平檢測出15種細菌,將各組中平均豐度大于0.1%的菌群制作成物種分布堆疊圖。結果表明,3組王草青貯后的優勢菌屬均為腸桿菌屬(unclassifiedEnterobacteriaceae),其相對豐度在49.01%~70.03%之間。王草青貯料中相對豐度大于0.1%的乳酸菌屬包括植物乳桿菌屬(Lactobacillus)、乳球菌屬(Lactococcus)、片球菌屬(Pediococcus)、腸球菌屬(Enterococcus)、明串珠菌屬(Leuconostoc)和魏斯氏屬(Weissella)。KM110S組中相對豐度最高的2種乳酸菌屬為Lactobacillus和Pediococcus,相對豐度分別為28.30%和9.64%,KM90S組的乳酸菌屬主要是Lactobacillus,相對豐度為20.38%,KM130S組中主要乳酸菌屬為Lactobacillus和Lactococcus,相對豐度分別占到了9.94%和9.45%。3組王草青貯30 d后梭狀芽孢桿菌屬(Clostridium)的相對豐度較低,在0.49%~1.20%之間。
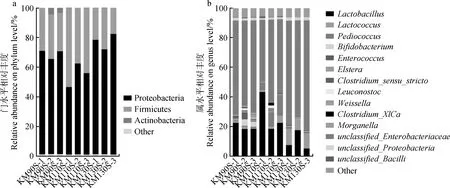
圖2 王草青貯30 d門(a)和屬(b)水平微生物群落組成Fig.2 Composition of microbial community of king grass silage at the phylum (a) and genus (b) levels at 30 d
3 討論
3.1 不同生長天數王草原料特性
一般認為LAB數量大于105cfu·g-1FM能夠使青貯飼料得到良好保存[15]。此外,在不使用任何添加劑時,青貯原料中至少要含約占DM含量8%~10%以上的WSC才能調制成功[19]。本試驗中,3組王草的LAB數量在4.39~4.72 105cfu·g-1FM之間,WSC含量約占DM含量的4%~7%,可能會導致青貯發酵受限。隨著生長天數延長,3組王草的DM,ADF和NDF含量增加,而CP含量降低,與Lounglawan等[20]研究相符。ADF和NDF含量的增加表明隨著生長時間延長王草木質化程度增加。KM90S,KM110S,KM130S組的WSC含量分別為61.57,40.28和71.67 g·kg-1DM。張英[21]等研究發現,隨著生長期延長王草的WSC呈上升趨勢。Masuko等[22]研究表明,第2茬牧草比第1茬的WSC含量低。可能與植物不同的生長時期、溫度、水分和光照條件有關[23]。
3.2 不同生長天數王草青貯過程中發酵品質的變化
青貯結束后3組王草的DM含量均顯著下降,表明在青貯過程中存在營養物質的損失。青貯第1~14 d內,3組王草的pH下降速度和LA含量增加速度不同,KM110S組最快,其次為KM130S和KM90組,可能與不同生長期刈割牧草附著LAB的數量、種類和活性有關。青貯第14~30 d,KM130S和KM110S組的pH和LA含量變化不大,KM90S組的LA含量顯著增加,pH顯著下降,與Zi等[24]結果相一致。pH是評價青貯發酵品質的重要參數,本試驗中,青貯結束后KM110S組(4.31)的pH低于KM90S(4.47)和KM130S組(5.22),是因為青貯過程中KM110S組的LA含量更多。有研究表明,AA是熱帶牧草青貯過程中的主要產物[25],在許多熱帶植物如木薯、雀稗和柱花草等青貯飼料中都得到了相類似的結果[26-27]。青貯結束后KM90S,KM110S和KM130S組的LA/AA分別為0.48,1.89和0.72,表明生長90 d和生長130 d的王草青貯發酵類型趨向于異型發酵模式。此外,青貯結束后3組王草的PA含量平均為0.83 g·kg-1DM,與Li等[27]在王草青貯飼料中的檢測到的含量接近。AA和PA具有很強的抗真菌特性,可以有效地抑制青貯飼料中酵母菌的活性并提高青貯飼料的有氧穩定性[28-29]。Catchpoole和Henzell[31]認為保存良好的青貯飼料的BA含量應小于2.00 g·kg-1DM。青貯結束后3組王草的BA含量在2.71~4.80 g·kg-1DM之間,未達到良好青貯飼料的要求,可能是王草原料中DM(143.92~217.11 g·kg-1FM)含量較低,容易引起梭菌發酵[[32-33]。BA含量與梭狀芽孢桿菌的活性有關,梭狀芽孢桿菌會引起青貯飼料中DM和能量的損失,減少牲畜的飼料攝入量,可能會引起動物健康問題[15,30]。
3.3 不同生長天數王草青貯過程中化學成分和營養品質的變化
青貯飼料的調制主要是在厭氧條件下LAB利用青貯原料中的WSC和少量的纖維素生成LA迅速降低pH從而抑制有害微生物的繁殖[15]。本試驗中,3組王草的WSC含量在青貯前7 d內快速下降,在青貯后期下降速度減慢,與郭剛[34]研究結果一致。KM90S組的LA含量在青貯的前7 d變化不大,可能是在青貯早期,大部分的WSC被植物的呼吸作用和有害微生物的活動所消耗,導致沒有充足的糖被乳酸菌利用,故LA含量無顯著變化,KM90S組第7 d的丁酸和NH3-N含量顯著高于KM110S組和KM130S組也印證這一推測。3組王草的NH3-N含量在青貯過程中顯著增加,這可能是植物蛋白酶和微生物共同作用的結果[35]。青貯結束后KM90S組的NH3-N含量最高,同時CP含量降低幅度最大,可能是該組中植物蛋白酶和微生物的活性較高。牧草中重要的營養物質包括NDF和ADF,家畜的飼料采食量和消化率與其含量密切相關。與青貯第1 d相比,KM90S組的ADF含量在青貯第14 d顯著增加。KM110S組的NDF含量呈先降后增趨勢,在青貯第7 d達到最低,KM130S組的NDF含量在青貯過程中持續增加,在青貯第30 d達到最大。青貯過程中ADF和NDF含量的增加可能與DM和WSC等有機物質的消耗損失有關,造成ADF和NDF的相對含量增加[36-37]。
3.4 不同生長天數王草的微生物多樣性
青貯飼料的品質主要取決于發酵過程中微生物群落及其代謝產物,因此,研究青貯飼料中的微生物群落組成可以為提高青貯發酵質量提供有價值的科學依據[38]。本試驗所有樣本的覆蓋率(Coverage)均在99%以上,表明測序數據有足夠的覆蓋性,可以反映細菌群落的核心組成。Shannon指數為常用的物種多樣性指數,Shannon指數越大表明樣品中物種多樣性越高,Chao指數越高,表明樣品中物種豐度越高[39]。本試驗中,Shannon和Chao指數隨著王草生長天數的延長呈下降趨勢,說明隨著生長期延長,王草青貯飼料的微生物多樣性有所降低。在主成分分析中(圖1),每個點距離越近代表樣品之間微生物群落相似度越高,距離越遠代表樣品之間微生物群落相似度越低。3組王草青貯樣品能夠較明顯的區分開。說明不同生長天數王草青貯微生物群落的組成和結構存在一定的差異。
3組王草青貯飼料在門水平上細菌區系的兩大優勢菌為Proteobacteria(53.7%~76.58%)和Firmicutes(28.13%~44.9%),與Zhang等[40]研究結果一致。青貯中參與LA發酵的大部分細菌群落屬于Firmicutes,例如Lactobacillus,Pediococcus,Lactococcus,Weissella和Leuconostoc。本試驗中KM110S組Firmicutes的相對豐度分別比KM90S和KM130S組高59.31%和104.30%,這可能是KM110S組中pH相對較低的原因,與Keshri等[41]在低pH青貯飼料中觀察到的Firmicutes相對豐度較高的結果一致。青貯飼料中的LAB可以發酵WSC產酸降低pH,從而抑制有害微生物的活性,使青貯飼料得到良好保存。一般認為青貯發酵初期飼料中主要的LAB屬為Enterococcus,Lactococcus,Pediococcus和Leuconostoc,之后隨著青貯飼料pH的下降,逐漸被產酸能力強的Lactobacillus替代[15]。本試驗中,KM90S和KM110S組在屬水平上優勢LAB均為Lactobacillus,相對豐度分別為20.38%和28.30%,KM130S組中優勢LAB為Lactobacillus和Lactococcus,相對豐度分別為9.94%和9.45%。這可能跟KM130S組青貯結束后較高的pH(5.22)有關。盧強等[42]研究發現,在pH(5.08~5.41)較高的苜蓿青貯料中,Lactobacillus,Lactococcus和Enterococcus的相對豐度較高。
青貯飼料中的腸桿菌可能與LAB競爭營養物質,產生NH3-N并造成營養損失[43]。本試驗中,3組王草青貯飼料在屬水平上的優勢菌為unclassifiedEnterobacteriaceae(49.01%~70.03%),與Li等[26]研究結論相一致。青貯飼料中BA的積累主要由梭菌發酵引起,不僅降低青貯飼料的營養價值,而且危害人和動物的健康[44]。王草青貯30 d后Clostridium(0.49%~1.20%)的相對豐度較低。表明3組王草青貯過程中BA的產生可能與青貯早期Clostridium的活動有關,隨著青貯時間的延長,3組王草青貯的pH下降,Clostridium的活性受到抑制。
4 結論
與生長90 d和130 d的王草相比,生長110 d王草青貯結束后的pH,NH3-N和BA含量最低,乳酸菌屬相對豐度和LA含量最高,因此生長110 d的王草調制出的青貯飼料優于生長90 d和130 d的。

