數字PCR技術檢測感染者尿液中SARS-CoV-2的方法研究
王志彬,羅 慶,李寶林,唐 敏,張 章,劉靳波
西南醫科大學附屬醫院醫學檢驗部(瀘州 646000)
2019 年12 月武漢爆發由新型冠狀病毒引發的肺炎,并迅速在全國蔓延[1],其傳播速度超過2003年爆發的“非典”[2]。2020 年1 月10 日,世界衛生組織(World Health Organization,WHO)將該病原體命名為2019-nCoV(2019 novel coronavirus),2 月11 日,國際病毒分類委員會(International Committee on Taxonomy of Viruses,ICTV)正式宣布該病毒為嚴重急性呼吸綜合征冠狀病毒2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)。
SARS-CoV-2 為正義鏈、單鏈線狀RNA 冠狀病毒[3],該病毒典型特征之一為無癥狀傳播[4],傳染者和被傳染者在感染初期可能無癥狀[5],使得防控難度加大。疫情發生以來,中國政府及時采取強有力、高效能的措施使得疫情得到初步控制,但截至目前,SARS-CoV-2在許多國家和地區仍在快速傳播和蔓延。感染者的及時確診是疫情防控的關鍵一環,目前臨床診斷主要基于臨床病史、胸部CT和病毒核酸檢測[6-7]。相較于臨床癥狀的出現,核酸檢測結果在促進感染者隔離、治療、出院以及評估感染活動中起重要作用。根據WHO 診療指南,目前診斷SARS-CoV-2 感染的金標準是基于實時熒光定量PCR(RT-qPCR)技術的檢測結果,但由于RT-qPCR 技術本身的靈敏性較低,加之標本取材差異大等,許多低拷貝病毒核酸感染者不能在一次核酸檢測中檢出,給疫情防控帶來巨大挑戰[8]。
微滴式數字PCR(droplet digital PCR,ddPCR)的工作原理是由微滴發生器將20 μL RT-qPCR反應體系分割成約20 000 個油包水的液滴單獨進行PCR 反應,再通過微滴分析儀對每個油滴進行熒光信號采集,采用泊松分布概率函數計算起始模板的拷貝數[9]。與RTqPCR相比,ddPCR不需要繪制標準曲線即可實現絕對定量,對低拷貝核酸檢出具有優勢[10]。咽拭子等取樣工作給醫護人員帶來暴露風險,尤其當防疫物資緊缺時。如果能通過尿液等標本代替咽拭子等進行核酸檢測,將大大降低醫護人員的暴露風險。研究報告指出,陽性病人尿液中含有SARS-CoV-2 核酸[11]。本研究針對5 例咽拭子陽性標本,同時進行ddPCR 和RT-qPCR實驗,比較了兩種技術在準確性和靈敏度上的差別,建立了最佳ddPCR 反應體系和反應程序;同時為了開發定量標本的采集方法進而應用于臨床檢驗系統,使用ddPCR 技術檢測了另外12 例陽性病人的尿液標本,評價了以尿液作為檢驗樣本的可行性。
1 材料與方法
1.1 標本采取
2019 年12 月25 日至2020 年3 月4 日期間在西南醫科大學附屬醫院發熱門診就診病人和有武漢接觸史的人群進行了SARS-CoV-2 病毒檢測,共收集到陽性標本17份(均屬不同病人),其中包括咽拭子標本5份,尿液標本(隨機尿)12 份。病人納入標準依據《新型冠狀病毒肺炎診療方案(試行第七版)》[12]中病原學檢測標準:標本收集之前病人尚未接受藥物治療以及其他治療,標本收集后RT-PCR檢測結果陽性。
1.2 儀器與試劑
儀器:EX3600 核酸自動提取儀(上海之江生物科技股份有限公司)、Bio-Rad CFX96 實時熒光定量PCR儀(美國Bio-rad 公司)、Bio-Rad QX200 微滴式數字PCR系統(美國Bio-rad公司)。
試劑:Bio-Rad Droplet Generation Oil(美國Bio-rad公司)、Bio-Rad Droplet Reader Oil(美國Bio-rad公司)、Bio-Rad 2×ddPCR supermix for probes(美國Bio-rad 公司)、引物(中國生工)、探針(中國生工)、新型冠狀病毒2019-nCoV 核酸檢測試劑盒(上海之江生物科技股份有限公司)。
1.3 方法
本文的方法學研究主要參照康鳳鳳等[13]和黃斐等[14]的報道,并參考2012 年6 月美國臨床和實驗室標準研究院頒布的EP17-A2文件[15]。
1.3.1 核酸提取 咽拭子SARS-CoV-2 RNA的提取:取3 倍于咽拭子體積的4%NaOH 溶液,加入咽拭子采集管中液化30 min,液化過程中每10 min振蕩一次,直至樣本無拉絲。取1 mL 液化后樣本于13 000 rpm 離心10 min,棄上清后用生理鹽水洗滌,13 000 rpm 離心10 min,留取300 μL 上清,棄除多余的上清后將剩余的300 μL上清與沉淀混勻,將混合物吸入到EX3600核酸自動提取儀配套的核酸提取預裝板A 孔中(一次性可以提取36個標本),將預裝版置于設備固定位置,啟動核酸提取程序提取核酸。
尿液SARS-CoV-2 RNA 的提取:取尿液1.5 mL,8 000 rpm 離心5 min,棄上清1.2 mL,剩余混勻后進行核酸提取,具體步驟同上。
1.3.2 標準質粒制備與稀釋 CDC-陽性質粒V2,全長2 983 bp,載體pUC57,由生工生物工程(上海)股份有限公司合成。標準質粒起始濃度為7.84×1010copies/μL。用ddH2O 將標準質粒做10 倍系列稀釋,共7 個濃度(7.84×107copies/μL~7.84×101copies/μL)。
1.3.3 引物和探針 引物序列采用國家微生物科學數據中心(National Microbiology Data Center,NMDC)公布的信息,目的序列為新冠肺炎SARS-CoV-2 病毒核殼蛋白(nucleoprotein,N)基因,序列信息見表1。
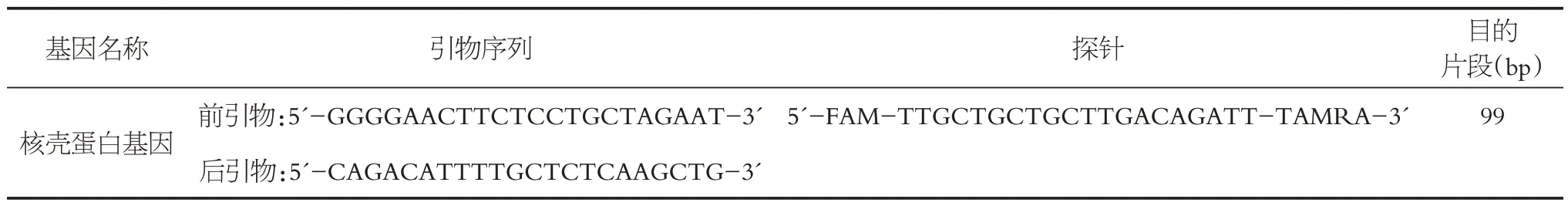
表1 SARS-CoV-2病毒核殼蛋白基因引物信息Table 1 Primer information of SARS-CoV-2 virus nucleocapsid protein gene
1.3.4 ddPCR 反應體系和條件優化 進行ddPCR 之前,通過溫度梯度PCR,設置51 ℃~62 ℃之間不同的溫度對退火溫度進行優化。使用Bio-Rad QX200微滴式數字PCR 系統進行實驗,具體操作步驟參照實驗儀器及試劑說明書,略有改動,主要包括PCR反應體系制備(見表2)、微滴發生、PCR 反應程序設定和微滴信號檢測等。

表2 ddPCR反應體系Table 2 ddPCR reaction system
將上述反應體系混勻后加入微滴發生卡中間一排,在微滴發生卡Oil標志列加入70 μL微滴生成油,及時蓋好專用膠墊后將微滴發生卡水平放置在微滴發生器的槽中制備油滴,待指示燈亮后取出微滴發生卡,將droplet 列微滴(約45 μL)全部轉入96 孔板,封鋁膜后置于PCR 儀中進行擴增。擴增程序為:95 ℃10 min,94 ℃30 s,60 ℃1 min,溫度變化設置為2 ℃,共40個循環;擴增結束后98 ℃酶失活10 min。每個模板設置2個技術重復。擴增結束后,將96孔板放入微滴讀取儀中檢測探針信號,并使用QuantaSoft 軟件(Bio-Rad,USA)分析數據。
1.3.5 假病毒樣本的ddPCR 擴增 假病毒、陽性對照和陰性對照均來自新型冠狀病毒2019-nCoV核酸檢測試劑盒(上海之江生物科技股份有限公司)。假病毒標準溶液濃度為108copies/mL,分別稀釋為105copies/μL、104copies/μL、103copies/μL、102copies/μL、10 copies/μL和1 copies/μL,共6個濃度進行重復性實驗。假病毒核酸稀釋后,在最佳反應條件下進行ddPCR擴增。每次反應中設置一個陰性對照和一個空白對照。將反應體系離心混勻,放入微滴發生卡中,通過微滴發生器產生微滴,之后將制備好的微滴(水、油分層)緩慢加入96孔板,進行PCR反應。反應程序同上,每個假病毒標本均做3個相同模板的平行反應。
1.3.6 空白限評估 空白限評估(limit of blank,LOB):參照黃斐等[14]的研究方法,檢測8份(3次重復)不同濃度陰性樣本核酸中SARS-CoV-2 的拷貝數,計算應用該檢測平臺可能出現的假陽性微滴數及概率大小。
1.3.7 統計學分析 本研究采用SPSS17.0 軟件進行統計學分析,實驗所得數據以均數±標準差表示,采用兩組獨立實驗的t檢驗方法比較兩組間差異性。
2 結果
2.1 陽性質控制備與引物特異性驗證
通過溫度梯度PCR,退火溫度設為51℃~62 ℃,確定引物的最佳退火溫度為60 ℃。以稀釋后的7個不同濃度質粒為模板,以核殼蛋白基因序列為目的基因,驗證引物特異性并確定陽性質控的最佳濃度。RT-qPCR結果顯示見圖1,每兩個相鄰濃度模板之間擴增曲線相差約3.3個循環,除模板濃度(編號g)(7.84×101copies/μL)的Ct 值大于30 之外,其余各濃度模板擴增曲線擴增效率良好。陰性對照無擴增,表明該體系無污染。
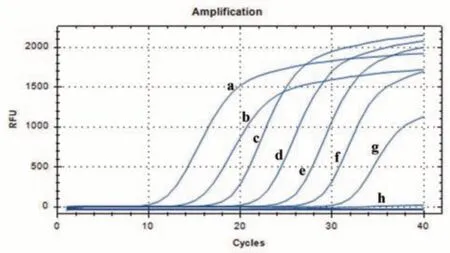
圖1 不同濃度CDC-陽性質粒V2模板擴增曲線Figure 1 Amplification curve of CDC-positive plasmid V2 template at different concentrations
不同濃度質粒模板經40個循環擴增后,溶解曲線為單峰見圖2,無引物二聚體及其它非特異性擴增,表明引物特異性良好,能用于SARS-CoV-2的檢驗。
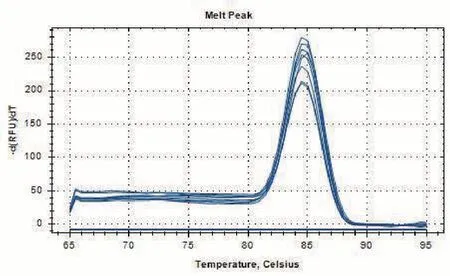
圖2 不同濃度CDC-陽性質粒V2模板溶解曲線Figure 2 Template dissolution curves of CDC-positive plasmid V2 at different concentrations
2.2 ddPCR反應檢測結果的精密度評價
以上述7 個不同濃度的陽性質粒為模板進行ddPCR 反應。結果顯示,以陽性質粒為模板(3.92 ×104copies/μL)進行ddPCR 擴增,微滴發生器生成的微滴數大于10 000,見圖3。在陰性對照中,無陽性液滴生成,表明反應體系和微滴發生程序正常,能滿足基本擴增和檢測。
圖3 ddPCR方法擴增CDC-陽性質粒V2模板一維散點圖Figure 3 One dimensional scatter diagram of CDC-positive plasmid V2 template amplified by ddPCR
ddPCR 可靠性檢測結果顯示:所有反應中油滴總數均超過10 000,最低數量為11 343,最高數量為15 136,表明該數字PCR 平臺運轉良好,微滴生成數量能夠滿足泊松分布函數。與質粒模板的理論濃度相比,ddPCR檢測結果較理論值偏低,見表3。兩個機械重復之間相比較,ddPCR 結果重復性較好。ddPCR 檢測結果的變異系數CV值介于0.04~12.09,表明ddPCR檢測結果的準確度較好。
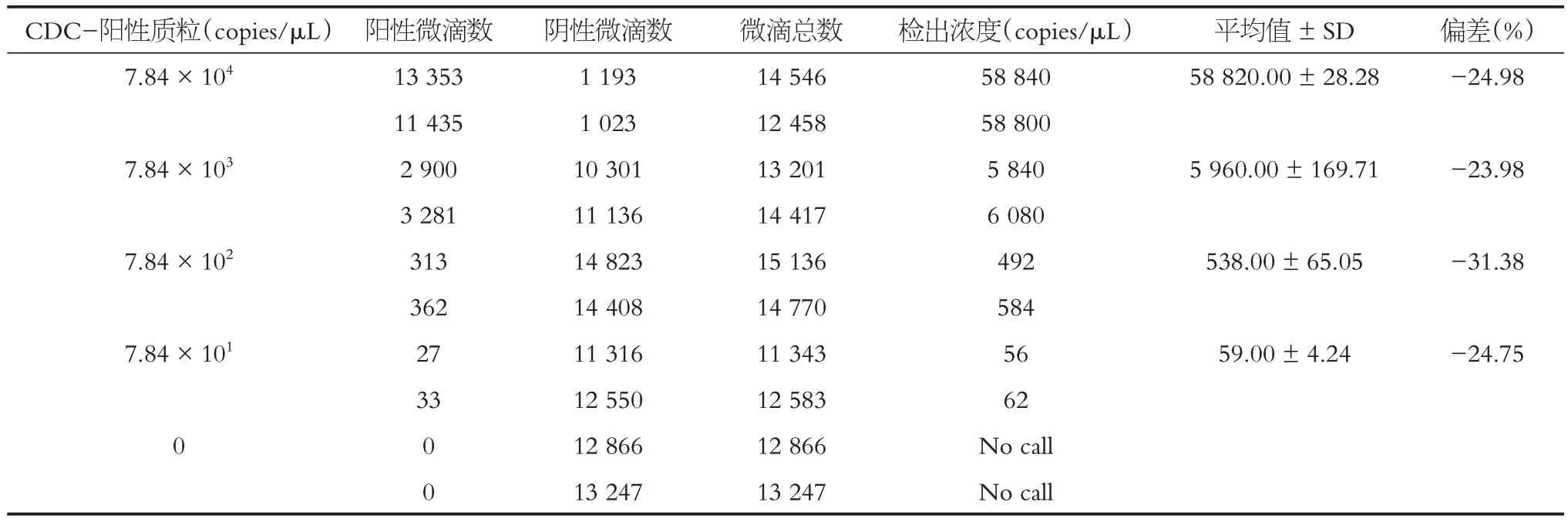
表3 核殼蛋白基因的ddPCR精密度檢驗Table 3 ddPCR precision test of nucleoprotein gene
以ddPCR檢出結果和質粒標準濃度之間做相關性分析,結果顯示兩者之間具有極強的相關性,兩者之間的線性關系見圖4,ddPCR 檢出結果與理論值呈極度正相關,ddPCR 結果正確可靠。當模板濃度超過7.84×105copies/μL 時,微滴分析儀讀取不到陰性微滴,全部體系均為陽性微滴,超過機器檢出限,導致讀取結果錯誤,ddPCR檢測上限應低于7.84×105copies/μL。
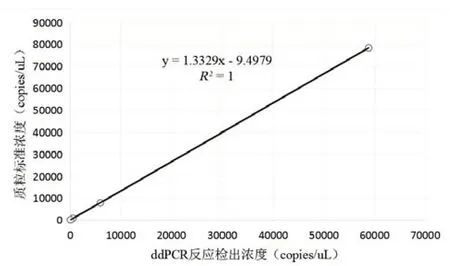
圖4 ddPCR方法與RT-qPCR之間的線性相關性Figure 4 Linear correlation between ddPCR and RT-qPCR
2.3 ddPCR反應與RT-qPCR反應組間重復
將標準質粒的7 個濃度稀釋液作為模板,以核殼蛋白(nucleoprotein,N)基因為為目的序列設計引物,進行RT-qPCR 反應,構建的標準曲線為:y=-3.317lgx+39.831,線性相關系數為R2=0.999,y為Ct值,x為濃度(copies/μL)。根據此標準曲線,通過對未知樣本測定的Ct 值便可得出樣本中SARS-CoV-2 的起始拷貝數,見表4。

表4 ddPCR與RT-qPCR之間的組間重復Table 4 Intergroup duplication between ddPCR and RT-qPCR
2.4 ddPCR反應重復性和可報告范圍
在重復性分析實驗中,ddPCR 定量檢測中CV最小值為2.31%,最大值為38.35%,結果表明,ddPCR 方法具有較好的重復性。不同濃度假病毒方法間重復實驗結果表明,該平臺系統偏差為-17.33%~-3.80%,見表5。在重復性實驗中,使用ddPCR檢測到的所有結果均未超出假病毒標準品的理論濃度,表現出較高的一致性。
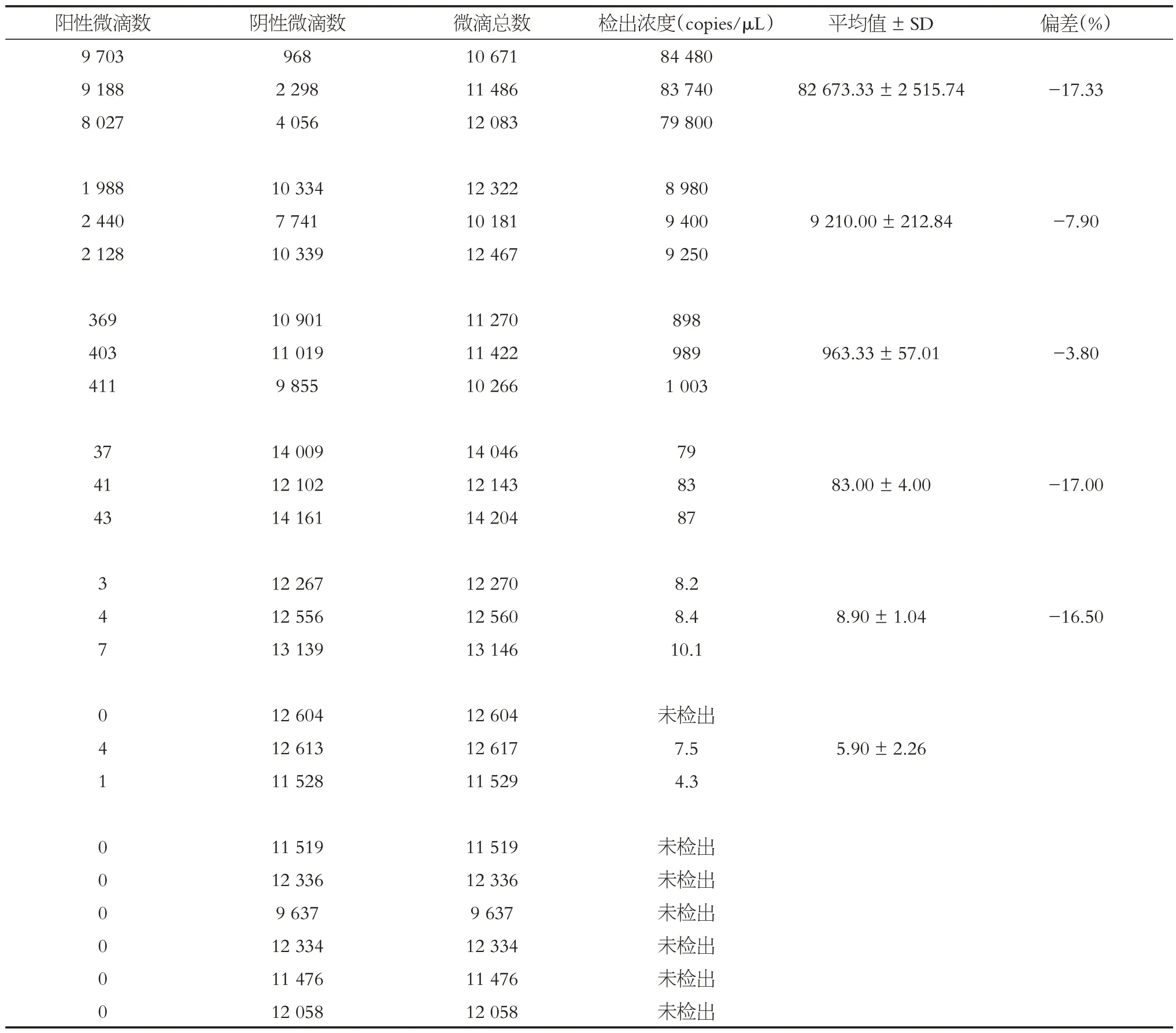
表5 不同濃度假病毒樣本ddPCR方法組間重復Table 5 The ddPCR method of pseudovirus samples with different concentrations were repeated between groups
2.5 空白限評估
ddPCR 檢測陰性標本核酸中SARS-CoV-2 拷貝數,結果發現不同濃度(隨機)樣本產生的微滴數在11 101~14 805之間,陽性微滴數>1即判斷為假陽性,在本實驗中該平臺假陽性出現概率為1/24。LOB最大估計值為0.09 copies/μL。
2.6 尿液標本中SARS-CoV-2拷貝數檢測
為了能使標本量化檢測,同時避免咽拭子等取樣工作帶來的暴露風險,本研究嘗試用尿液檢測SARSCoV-2。12份尿液標本全部來自確診病人。臨床上使用某公司生產的核酸檢測試劑盒檢測病人痰液SARS-CoV-2陽性,而檢測尿液結果全部為陰性,表明尿液中該病毒核酸為低拷貝。
使用ddPCR 檢測這12 份尿液樣本,其靈敏度增加,共9例檢出,3例未檢出,檢出率為75%。所檢出濃度范圍為5.4 copies/μL~30 copies/μL。
從圖5、圖6 可以看出,陰性對照均無陽性微滴檢出,陽性對照分別檢出陽性微滴數2 226和2 561,分別對應檢出濃度為4 520 copies/μL和5 500 copies/μL。
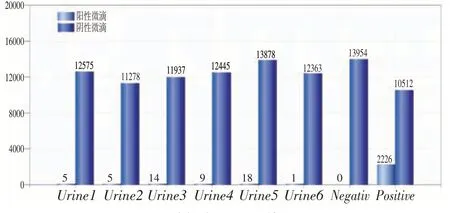
圖5 尿液標本1~6號檢測結果Figure 5 Detection results of urine samples 1~6
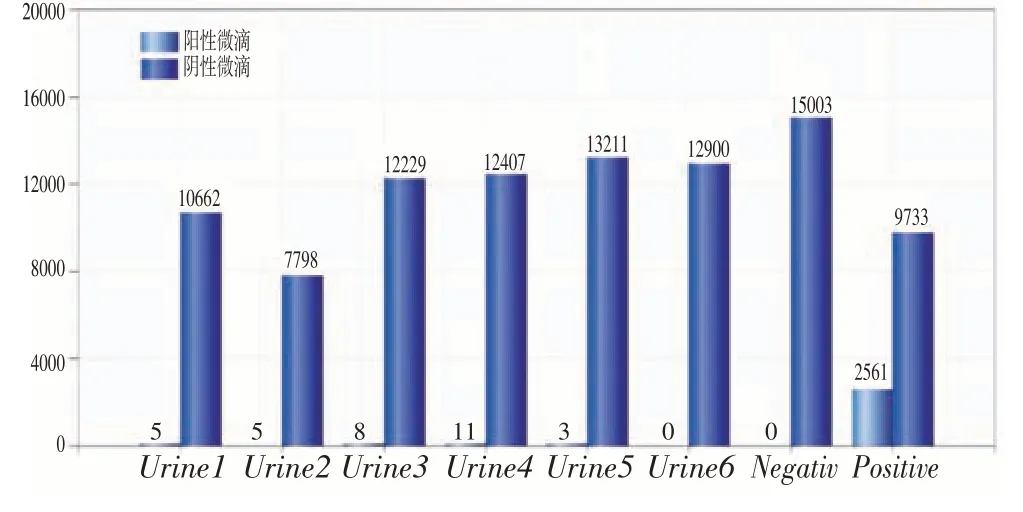
圖6 尿液標本7~12號檢測結果Figure 6 Detection results of urine samples 7~12
尿液標本同時使用RT-qPCR 和ddPCR進行檢測,結果12 份尿液標本使用ddPCR 技術檢出9 份,使用RT-qPCR 檢出0 份,表明ddPCR 方法在低拷貝核酸定量檢測中具有明顯優勢。
3 討論
SARS-CoV-2 爆發以來,中國政府及時采取強有力的防控措施,使得疫情得到初步控制。但是,SARSCoV-2在許多國家和地區還有蔓延趨勢。研究報告表明,關于該病毒的致病性、遺傳特征等方面的認知相對缺乏[15],因此很難在短時間內制定一套有效的治療方案,而快速診斷疑似病人并采取隔離防控措施,成為疫情防控的關鍵。
SARS-CoV-2 傳播能力強而且存在無癥狀感染的特性。相比于CT(computed tomography)或抗體檢測,核酸檢測克服了滯后性,同時也是目前臨床上感染者確診和出院的主要依據[16]。但核酸檢測易出現假陰性,標本采集部位、方法以及RNA 提取等過程均是SARS-CoV-2 病毒核酸檢測出現假陰性的原因[8]。另外,RT-qPCR由于其檢出限的限制,在臨床上的應用弊端日漸突出,加之不同公司生產的試劑盒質量差別很大,致使許多疑似病例甚至陽性感染者無法在第一時間檢出陽性結果,從而導致診斷延遲,給疫情防控帶來巨大挑戰。
ddPCR 技術優勢明顯,是繼常規PCR 技術發展起來的一項精密檢測技術,最初ddPCR 技術被用來分離單基因[17-18],在臨床檢驗中使用較少。有報道指出,當ddPCR 應用于檢測系統時,能夠檢測到低至0.001%的突變基因,相比于RT-qPCR,靈敏性提高1 000 倍[19]。趙欣[20]的研究結果顯示,ddPCR 在臨床樣本定量檢測時其檢出率高于RT-qPCR,這與本研究得出結果相同。本研究中,RT-qPCR 可檢出4 號咽拭子中1.41 copies/μL的SARS-CoV-2,卻無法檢出尿液中5.4~30 copies/μL(ddPCR檢出值)的SARS-CoV-2。假設上述兩種方法檢出值都在真值范圍內,這一現象無法僅僅以“尿液中該病毒核酸為低拷貝”作出解釋。回到RT-qPCR 檢測,在臨床上針對新冠病毒的“判陽”是依據Ct值大小,如第九版新冠肺炎診療方案中明確規定連續兩次新冠核酸檢測Ct 值≥35 即可解除隔離或出院。在本研究中,4 號咽拭子中核酸濃度1.41 copies/μL 對應的Ct 值為36.03,通過常規PCR 技術檢測應該判定為陰性,而ddPCR 與之相對應的檢測結果為37.00 copies/μL。由此可見,ddPCR 檢測可以補充RT-qPCR 檢測結果,而RT-qPCR 不能補充ddPCR 的檢測結果。因此,當ddPCR 檢測結果為5.4~30 copies/μL 時,RT-qPCR 無法檢出就得到了很好的解釋。RT-qPCR檢出濃度是根據Ct value帶入標準曲線計算所得,為理論值,4號咽拭子Ct 值兩次重復均超過35,隨著Ct 值增大,結果準確性降低,國家微生物科學數據中心指南(https://nmdc.cn/nCoV)表明當RT-qPCR 結果大于37,為不準確。ddPCR將含有核酸分子的反應體系分隔成“油包水”的小液滴,在模板量適當的前提下,確保每個小液滴最多包含一條核酸分子,經PCR擴增后,利用微滴檢測儀對每個微滴進行逐個掃描檢測,有熒光信號的微滴判讀為“1”,沒有熒光信號的微滴判讀為“0”,最后根據泊松分布原理及陽性微滴的個數,分析軟件即可給出靶分子的絕對起始拷貝數及濃度,這個濃度的準確性有待進一步探討,趙欣在其碩士論文中也表示,RT-qPCR的定量值始終比ddPCR高10倍,推測其原因可能是標準質粒濃度被高估所致[20]。
臨床上核酸檢測SARS-CoV-2的取樣主要包括鼻咽拭子、口咽拭子、痰液等,當感染者病毒載量低時不能取到陽性標本,加之醫護人員取樣操作帶來的差異,導致所取樣本無法量化,也是核酸檢測假陰性的原因之一。同時,咽拭子取樣操作使得醫護人員暴露風險增加,在防護物資緊缺時增加醫護人員的感染風險。有研究表明新型冠狀病毒還會導致不同程度的心理抑郁[21],因此快速、準確檢出病毒,是疫情防控關鍵的一環。本研究開發新的取樣方法和標本內容,以尿液為實驗材料,定量至1.5 mL進行實驗,以期在保證陽性檢出率的同時,更加安全的進行傳染性疾病的取樣工作,更完整地鑒定感染病例并避免交叉感染。
在低拷貝核酸樣本的檢測中,ddPCR 技術與RTqPCR相比具有顯著的優勢[22-24]。臨床上根據檢測結果進行的確診,不同試劑盒廠家建議只需滿足在同一份標本中SARS-CoV-2 的ORF1ab基因及核殼蛋白基因至少1 個靶標特異性RT-PCR 檢測結果為陽性即可,并且有研究報告指出,在檢測SARS 冠狀病毒時,ORF1b基因和核殼蛋白基因具有相似的準確性[25],因此本研究主要以核殼蛋白基因為靶序列。雖然本研究證實,單拷貝核酸通過ddPCR 技術檢測具有優越的靈敏性,但本研究依然存在局限性。①由于瀘州本地陽性病例較少,使得本研究樣本量不夠大,重復性不好;②ddPCR 儀器操作要求較高,很容易在不同的加樣孔之間造成污染;③ddPCR 檢測成本較RT-qPCR 技術高,普及困難。本研究的結果顯示,12例痰液檢測為陽性的感染者尿液標本,RT-qPCR檢出0例,表明尿液中病毒載量低。ddPCR 技術檢出9 例,表明ddPCR 技術在低載量病毒核酸檢測過程中具明顯優勢,這也為其他重大傳染性疾病的檢出提供新的思路與方法,其自動化程度是值得繼續研究與開發的方向。
4 結論
在低拷貝核酸樣本的檢測中,ddPCR 技術與RTqPCR相比,ddPCR技術在低載量病毒核酸檢測過程中具有明顯優勢。這一結果也為其他類似的重大傳染性疾病的檢出提供了新的思路與方法。
(利益沖突:無)

