黑二氧化鈦的制備及其在催化領域的應用
李 歌,馬子然,趙俊平,王寶冬*
(1.北京低碳清潔能源研究院,北京 102211;2.國網能源和豐煤電有限公司,新疆 伊犁 834411)
二氧化鈦 (TiO2),白色,具有高亮度和折射率,自19世紀20年代開始工業化生產以來,已被廣泛用作白色顏料。其低成本、惰性和無毒等優點成為油漆、軟膏、食用色素和防曬霜等產品的主要組成部分。自從 1972 年對其表面的紫外線 (UV) 光誘導光電催化分解水的研究以來,已被廣泛用于各個領域。其性能在很大程度上取決于其光學、電學、結構、形貌及尺寸、結晶度等表面性質。為了提高其性能,研究者們付出了巨大的努力來調整這些屬性[1-5]。然而,TiO2由于具有較大的帶隙,無酸堿性和氧化還原性限制了其在催化領域的應用。通過缺陷工程調控催化劑,不僅可以產生高效的催化活性位點,同時還可以提供電荷和能量轉移的通道,是有效提高催化劑性能的手段之一。近年來,研究人員已利用缺陷工程來調控WO3、TiO2、SiO2、MoO3、ZnO、In2O3、MnO2、CeO2和BiVO4等金屬氧化物的結構。2011年,Chen X等[6]以TiO2為原料,利用純氫,在2.0 MPa壓力和200 ℃條件下5天制備了具有氧化還原能力的氫化TiO2(稱為黑TiO2)。這種氫化TiO2在可見光范圍內的吸收能力得到了大幅提升,表現出優異的光催化活性,這項發現引起了科研工作者們對氫化TiO2材料的研究興趣。氫化TiO2的制備原理是利用缺陷工程,采用表面氫化還原法在TiO2表面引入無定型Ti3+層,進而改變能級,同時形成較多的氧空位,改變氧空位的密度,使其生成更多的氧化性能較強的·OH自由基。迄今為止,氫化TiO2的研究取得了較大的進展。在光催化降解污染物、水分解制氫、CO2光催化還原、催化乙烯的聚合、催化還原NOx、染料敏化太陽能電池(DSSC)、鋰電池、燃料電池、超級電容器、微波吸收劑和場致發射等領域取得了很多重要的研究成果[6-90]。大多數研究指出缺陷物種,如Ti—H鍵、表面OH基團、氧空位和Ti3+物種對提高光催化效率和減少光生載流子復合的形式出現有益[7-29]。本文根據當前黑色TiO2納米材料的研究現狀,簡述黑色TiO2納米材料的結構性質、制備方法及其在催化領域的應用。
1 黑TiO2的結構性質
原始白TiO2可以通過各種方法還原成黑TiO2。黑TiO2中的Ti3+離子、表面羥基、氧空位和Ti—H鍵以及結構修飾,誘導其顏色的變化以及優異的光學、電子和催化性能[30],見圖1。黑TiO2通常在顆粒表面有一定程度的無序層(缺陷),晶核保持完整沒有任何缺陷[31]。黑TiO2納米材料可吸收整個太陽光譜。在黑TiO2形成過程中,還原過程導致晶格無序,進而產生中間帶能隙。這種中間帶能隙分布可使其納米顆粒吸收較大范圍的光,是光催化活性大大提高的主要原因。

圖1 (a)白色TiO2和(b)黑TiO2的吸收光譜插圖為黑TiO2的擴展吸收[30]Figure 1 Absorption spectra of white TiO2(a) and black TiO2(b) The inset shows the extended absorption of black TiO2[30]
1.1 表面結構紊亂
黑TiO2的表面存在無序層,具有典型的結晶/無序核殼的結構特征。由于黑TiO2表面晶格紊亂,電子結構得到改善,表面活性增強,不僅具有優異的光吸收性能,還具有優異的電學性質。通過高分辨率透射電子顯微鏡(HRTEM)可以觀察到表面無序層的存在。Chen X等[6]報道了一種獨特的黑TiO2納米晶體,其表面結構通過加氫進行處理。原始的TiO2納米晶體顯示出良好分辨的晶格條紋。氫化后,黑色TiO2擁有結晶的TiO2晶核和高度無序的表面覆層,厚度約1 nm。這種具有無序的核-殼結構的黑色TiO2納米粒子,在外層很容易看到與標準結晶銳鈦礦的結構偏差。在其他研究中,無序結構還通過不同方法成功地引入了氫化TiO2納米顆粒的近表面區域。Wang G G等[32]在500 ℃熱等離子體爐中用H2等離子體(200 W)制備黑色TiO2納米顆粒,結果表明,H摻雜的黑色TiO2在晶核周圍具有層穩定的非晶外層,形成了無定形的殼晶核結構(TiO2@ TiO2-xHx)。
1.2 Ti3+和氧空位
通過不同方法制備的黑色TiO2中已經觀察到Ti3+和氧空位[30-34]。原則上,在 TiO2上形成氧空位會導致不成對電子或 Ti3+中心,它們可以在 TiO2的電子結構中形成中間能級,更加有利于電子的躍遷,提高其光催化活性。并且Ti3+離子的出現,可以促進Ti3+/Ti4+離子對的氧化還原循環,進而提高催化劑氧化還原性能。適量的表面氧空位不僅可以拓寬材料對光的吸收范圍以降低其禁帶寬度,還可以增加材料表面吸附態氧的數量及促進表面羥基化,進而生成超氧陰離子和羥基自由基等活性氧物種。利用X射線光電子能譜(XPS)、電子順磁共振(EPR)和拉曼光譜等來表征Ti3+和氧空位的存在。Liu X等[31]發現,以TiH2和H2O2為前驅體通過簡單的界面離子擴散-氧化還原反應合成的TiO2-x納米顆粒的整體和表面均引入了Ti3+和氧空位。XPS數據顯示,Ti2p3/2(457.4 eV)和Ti2p1/2(463.2 eV)的峰位于較低的結合能處,表明黑TiO2納米顆粒中存在Ti3+。Wang G G等[32]通過將原始的TiO2在高壓(1 MPa)H2氣氛中于400 ℃焙燒2 h,使氫化TiO2納米片具有暴露的(001)面。拉曼光譜表明,氫化TiO2納米片的峰強度低于TiO2,并且其在144 cm-1和636 cm-1處的拉曼信號向更高的頻率移動,表明形成了氫處理的空位。Valentin C D等[33]研究表明,在還原的TiO2中存在不同類型的Ti3+中心。
1.3 Ti-OH和Ti-H基團
黑色TiO2納米材料中報道有Ti-OH和Ti-H基團[6,28,34-35]。TiO2表面上的氫與晶格氧結合形成 Ti-OH基團,從而在Ti位點捕獲電子。這個額外的電子有助于Ti3+形成,并產生中間態能級。利用XPS、FT-IR 、1H核磁共振光譜和XRD可以檢測到Ti-OH和Ti-H的存在。Chen X等[6]在200 ℃下合成5 d的氫化黑色TiO2納米顆粒的O1s XPS光譜中發現Ti-OH肩峰。Wang Z等[28]在黑色TiO2-xHx中發現了另一個以457.1 eV為中心的Ti2p峰和一個在約531.8 eV處較寬的O1s峰,這分別歸因于表面Ti3+和Ti-OH基團。他們還通過FT-IR表征了Ti-OH基團,在通過H2等離子體處理制備的氫化TiO2的FT-IR光譜中觀察了3 685 cm-1、3 670 cm-1、3 645 cm-1和3 710 cm-1處的特征峰[28]。前三個峰是四面體配位空位的特征峰,最后在3 710 cm-1處的特征峰與末端OH基相對應,這可能歸因于TiO2網絡中嵌入的H原子。他們進一步通過1H核磁共振波譜證實了Ti-OH基團的出現。Zhang C等[34]在1 MPa 純H2氣氛下,于400 ℃氫化2 h制備了黑TiO2納米片,并發現在黑TiO2表面存在Ti—H鍵。Zheng Z等[35]在(200~600) ℃超高純度H2氣氛中處理1 h制備了黑TiO2納米管,在XRD中發現,約59.281°的衍射峰證明了Ti—H鍵的形成。
2 黑TiO2的制備方法
2.1 氫 化
Chen X等[6]報道了黑色TiO2的合成,在2 MPa氣氛中于200 ℃對結晶TiO2進行氫化5 d,見圖2。從圖2(a)可以看出,氫化引起的黑色TiO2表面上的無序層是有效帶隙減少的原因,同時對于載流子捕獲有益。納米晶體中存在的擴展無序層會產生中間能隙狀態,而不是離散的供體能級,其將有效地與導帶邊緣重疊。原始TiO2的結晶狀態和黑TiO2的無序表面[圖1(b)],也可以從HRTEM圖像中看到[圖2(c)和(d)]。

圖2 (a)黑TiO2的結構和電子DOS圖;(b)白TiO2和黑TiO2的樣品照片;(c)TiO2的HRTEM;(d)黑TiO2的HRTEM[6]Figure 2 (a)Structure and electronic DOS diagram of black TiO2;(b)Photos of white TiO2 and black TiO2;(c)HRTEM image of TiO2;(d) HRTEM image of black TiO2[6]
Leshuk T等[36]在2 MPa的H2下于250 ℃、350 ℃和450 ℃對原始TiO2納米顆粒進行氫化。隨著氫化溫度的升高,從很淺的黃色到灰色逐漸變成黑色(見圖3)。紫外/可見光譜表明,在低于450 ℃下進行氫化處理不會改變顆粒的帶隙。在450 ℃和2 MPa下氫化24 h的樣品觀察到顏色變化和較大的波長吸收。

圖3 (a)250 ℃、350 ℃和450 ℃氫化24 h前后的TiO2照片;(b)相應的Tauc圖[36]Figure 3 (a)Photographs of TiO2 before and after hydrogenation at 250 ℃,350 ℃ and 450 ℃ for 24 h;(b)Corresponding Tauc diagram[36]
Wang G G等[32]報道了在超高純氫氣氛下于(200~550) ℃將金紅石TiO2納米線陣列氫化3 h合成黑色TiO2。氫化金紅石型TiO2納米線的顏色在350 ℃時變成黃綠色,450 ℃時變成黑色。由于氫化處理,這種氫化金紅石型TiO2納米線具有可見光吸收。Naldoni A等[37]通過在H2氣氛下加熱無定形TiO2,然后在惰性環境中快速冷卻來合成黑色TiO2納米顆粒,在真空下對TiO2粉進行預處理,然后在O2氣氛下于200 ℃熱處理1 h,隨后在氫氣氣氛中于500 ℃還原1 h。與P25結晶前驅體相比,無定形前驅體更適合用于制備具有較大波長吸收的黑TiO2。用類似方法,Zhang K等[38]使用生物模板(Typha angustifolia)獲得介孔黑色TiO2納米片。Liu N等[39]報道了使用銳鈦礦型TiO2納米管作為前驅體的黑TiO2納米材料的合成。
Sun C等[40]報道了在高氫氣壓力下將氫摻入銳鈦礦型TiO2納米晶體中,獲得了氫化的黑TiO2(101)。他們合成了主要具有(001)晶面和(101)晶面的銳鈦礦型TiO2納米晶體。具有(101)和(001)晶面的TiO2儲氫能力分別為1.4%和1.0%。基于DFT理論計算表明,氫占據了相鄰鈦氧形成的空隙。在八面體銳鈦礦中,(101)晶面比(001)晶面更容易引入氫。
Su T等[41]研究了溫度對氫化TiO2的影響,氫化TiO2在10%H2-N2氣流下(300~600) ℃加熱5 h,隨著氫化溫度的升高,氫化的TiO2表現出更大的吸收譜,并且帶隙隨著處理溫度的降低而減小。顯著的吸收譜變化主要歸因于捕獲到了導帶最低值以下的電子。
Pan X Y等[42]研究了氧空位和Ti3+物種的形成機理以及當將TiO2進行氫化處理時的優化條件。電子自旋共振(ESR)光譜結果表明,在氫化溫度為(500~600) ℃,氧空位和Ti3+物種的濃度最大。Liu H等[43]報道的光催化活性支持了這一點。在560 ℃處理的TiO2樣品氧空位最高。Zhang K F等[44]報道了在中孔黑色銳鈦礦型TiO2納米片(MBTN)中僅存在Ti3+物種,在氫氣溫度600 ℃時,未檢測到氧空位,證明其在高溫下轉化為Ti3+的可能性。Morgan B J等[45]報道銳鈦礦晶型比金紅石晶型更容易形成氧空位。許多文獻研究了不同溫度范圍和其他合成條件下的氧空位和Ti3+物種。缺陷的產生機制取決于合成途徑和條件。
2.2 氫等離子體
不同于傳統的氫化法制備黒色TiO2,通過氫等離子體增強技術,能夠有效地降低制備黑色TiO2所需的嚴苛條件,有利于大規模制備。Wang G G等[32]在熱等離子爐中使用200 W等離子輸入功率,通過氫等離子體制備氫化的黑TiO2納米顆粒。這種氫化的黑TiO2納米顆粒在可見光和近紅外區域具有明顯的吸收特性,見圖4。

圖4 (a)TiO2、高壓氫化TiO2(HP-TiO2)和H2等離子體還原的黑色TiO2(TiO2-xHx)的吸收光譜;(b)原始TiO2和TiO2-xHx的照片[46]Figure 4 (a)Absorption spectra of TiO2,high-pressure hydrogenated TiO2 (HP-TiO2) and H2 plasma-reduced black TiO2 (TiO2-xHx); (b)Photographs of pristine TiO2 and TiO2-xHx[46]
Teng F等[46]采用氫等離子體輔助化學氣相沉積方法,制備了黑TiO2納米管。在熱燈絲(2 000 ℃)下,前驅體TiO2在(350~500) ℃加熱3 h,形成黑色的TiO2納米管。Yan Y等[47]也使用了這種方法,在該溫度下,隨著銳鈦礦相向TiO2-B相轉變,納米帶的形貌發生了變化。
2.3 化學還原法
化學還原法主要包括鋁還原法、鋅還原法、咪唑還原法、NaBH4還原法和CaH2還原法等。Ren R等[48]通過170 ℃下使5 mL質量分數50%二(2-羥基丙酸)二氫氧化二銨合鈦與60 mL的0.08 g·L-1葡萄糖反應8 h,然后在500 ℃退火3 h,制備TiO2前驅體。將12 g的NaBH4和0.5 g的TiO2前驅體分散在60 mL水中,180 ℃反應16 h,得到還原的TiO2納米顆粒,其吸收邊為438.2 nm(見圖5)。Tan H Q等[49]用混合的TiO2納米粒子(4.0 g)和NaBH4(1.5 g)在(300~400) ℃反應(5~60) min,用去離子水和乙醇洗滌幾次,以除去未反應的NaBH4,然后在70 ℃干燥,制備了一系列從淺藍色到黑色的還原TiO2。所得樣品具有結晶核/非晶殼結構(TiO2@TiO2-x)。氧空位導致在TiO2納米晶體表面形成了無序的TiO2-x殼。

圖5 原始TiO2納米顆粒和NaBH4還原的TiO2納米顆粒的UV-Vis譜圖[49] Figure 5 UV-Vis spectra of original TiO2 nanoparticles and TiO2 nanoparticles reduced by NaBH4[49]
黑TiO2可以通過各種金屬還原而合成。如鋁、鋅和鎂可作為還原劑獲得黑TiO2。Cui H L等[50]使用陽極氧化的Ti箔作為Ti的前驅體,將鈦箔在乙二醇、質量分數0.4%NH4F和質量分數3%H2O的混合物中于100 V陽極氧化5 min,產生TiO2納米管。除去第一層,然后在空氣中500 ℃焙燒4 h。將合成的TiO2納米管和鋁粉在500 ℃和850 ℃下加熱,使TiO2將氧氣釋放到熔融鋁中,得到還原的黑TiO2。黑色銳鈦礦型TiO2納米管的吸收范圍從可見光擴展到近紅外區域。Sinhamahapatra A等[51]用鎂還原TiO2納米顆粒,得到黑TiO2。將混合的TiO2和鎂粉在5%H2-Ar氣氛下于650 ℃加熱5 h,然后洗滌并干燥。通過改變TiO2和Mg物質的量比(BT-X)制備了一系列還原的黑TiO2。其紅外區域的吸光度隨著還原過程中所用Mg的增加而增加(見圖6)。

圖6 鎂處理的TiO2樣品的吸收譜圖(CT:工業納米TiO2,CT-Ar:樣品在Ar氣氛下退火,BT-X中X:Mg與TiO2的物質的量比)[51]Figure 6 Absorption spectra of magnesium-reduced TiO2 sample(CT: Commercial Nano-TiO2,CT-Ar: The sample is annealed in an Ar atmosphere,X in BT-X:the molar ratio of Mg to TiO2)[51]
Xin X等[52]通過氧化-水熱反應合成了黑板鈦礦。將TiH2(0.256 g)和H2O(2 mL)混合,加入H2O2(30 mL,質量分數30%),攪拌12 h,形成黃色凝膠,再加入NaOH(1.0 mol·L-1)調節pH=9.0。然后添加NaBH4(0.4 g)并在180 ℃反應 24 h,用鹽酸(1.0 mol·L-1)洗滌樣品。在300 ℃退火后,TiO2顏色變為棕色(T300),500 ℃變為黑色(T500),700 ℃時變為淺灰藍色(T700)。光吸收增強順序為T500>T300>T700。
2.4 化學氧化法
化學氧化法通常采用低價態 Ti 物質作為原料,如Ti、TiO、TiH2和TiCl3等來獲得黑TiO2。在這些低價態 Ti 物質的氧化過程中,可加入一些還原劑以防止低價態 Ti 物種的完全氧化,即在產生的結果中留下豐富的 Ti3+中心。Liu X等[53]將 TiH2粉末(0.60 g)與 H2O2溶液(60 mL,質量分數25%)在室溫下攪拌 5 h,采用水熱法,在160 ℃氧化 (20~27) h ,制備了還原的 TiO2-x納米粒子。TiO2納米粒子呈藍色或淡藍色。這些粒子在紫外至可見光區域顯示出較強的吸收,在常溫或40 ℃水中儲存1 個月后仍保持其淡藍色。Grabstanowicz L R等[30]用兩步法制備了TiO2黑色粉末,見圖7。

圖7 從 TiH2到黑色TiO2的合成方法[30]Figure 7 Synthesis method for black TiO2 from TiH2[30]
首先,將 H2O2(15 mL)加入 TiH2粉末(0.96 g)水懸浮液(10 mL)中,室溫攪拌 3 h,得到凝膠狀漿液,加入額外的 H2O2(12 mL和 15 mL)攪拌(4 h和16 h)以形成黃色凝膠。然后將凝膠在 100 ℃真空烘箱中烘干 (12~20) h,變成黃色粉末,最后在Ar氣氛中630 ℃焙燒3 h。黑色 TiO2具有金紅石相,在可見光和近紅外區域的吸收顯著增強。Pei Z等[54]采用水熱法,氧化 TiO 粉末制備了灰色 TiO2。即一氧化鈦(400 mg)與 HCl 溶液(20 mL,3 mol·L-1)在 160 ℃反應 24 h。Kako T等[55]通過在(550~900) ℃加熱 Ti2O33 h制備了彩色金紅石相TiO2。樣品的顏色從灰綠色到黃色和灰白色,可很好地吸收可見光。
2.5 電化學還原
電化學還原法制備黑TiO2。通過在陰極施加偏壓,半徑小的離子可以摻雜到TiO2中或者Ti4+將被還原為Ti3+。因此,電化學還原法是一種有效制備黑TiO2的方法。陽極氧化法是在鈦箔上原位生長TiO2納米管陣列,其可以直接取代電化學中的電極。許多研究報道采用陽極氧化法制備黑二氧化鈦納米管陣列。
Xu C等[56]采用兩步電化學還原工藝制備了黑TiO2納米管。在質量分數0.3%NH4F和體積分數10%H2O2乙二醇電解液中,以碳棒為陰極,Ti為陽極,150 V下進行1 h陽極氧化。移除第一個形成的TiO2納米管并進行第二次陽極氧化,隨后分別在150 ℃和450 ℃下加熱3 h和5 h。在0.5 mNa2SO4水溶液中,以納米管為陰極,Pt電極為陽極,在室溫5 V下進行電化學還原摻雜(5~40) s,得到黑色的TiO2納米管。
Kim C等[57]制備了藍色和黑色的TiO2納米管陣列,見圖8。首先于45 V下在含有H2O(質量分數2.5%)/NH4F(質量分數0.2%)的乙二醇中制備TiO2納米管陣列5 h。空氣中450 ℃退火后,在磷酸鹽緩沖溶液中以恒定電流(0.017 A·cm-2)還原90 s,得到藍色TiO2納米管陣列。通過電化學質子插入,并在氮氣中于450 ℃退火制備了黑色TiO2納米管陣列。

圖8 藍色和黑色TiO2納米管陣列(NTA)的制造過程示意圖[57]Figure 8 Schematic diagram of the manufacturing process of blue and black TiO2 nanotube arrays (NTA)[57]
2.6 激光燒蝕
激光輻照過程不需要高壓、高溫或化學試劑,可在水或有機溶劑中,制備穩定的納米顆粒,制備過程“綠色”且低成本。激光合成或改性的納米顆粒的物理化學性質、平均粒徑和粒徑分布取決于實驗參數,如輻照時間、激光波長和激光脈沖的能量密度。激光燒蝕的樣品在很大程度上取決于溶劑,因為溶劑可以在原料上被吸收或與形成的物種反應,最終影響產物。激光燒蝕技術具有很多優點,如制備周期短、實驗裝置簡單、操作方便和制備的溶液穩定性較高。Chen X等[58]采用脈沖激光輻照制備了黑TiO2納米球,見圖9(a)。用脈沖激光(k=355 nm,脈沖寬度=8 ns,頻率=10 Hz,功率=0.35 W,瞬時功率=4.4 mW)對1 mL H2O中的20 mg TiO2進行輻照(5~120) min,5 min后TiO2顏色變灰,120 min后變黑,見圖9(b)。

圖9 (a)實驗裝置示意圖;(b)激光改性前后TiO2的紫外-可見吸收光譜圖;插圖為激光改性前后原始TiO2、TiO2-5、TiO2-15、TiO2-30、TiO2-60和TiO2-120的照片[58]Figure 9 (a)Schematic diagram of the experimental device;(b)Ultraviolet-visible absorption spectra of TiO2 before and after laser modification The insetare photos of original TiO2,TiO2-5,TiO2-15,TiO2-30,TiO2-60 and TiO2-120 before and after laser modification[58]
Filice S等[59]在不同溶劑中,通過紫外激光輻照對二氧化鈦膠體進行了改性。基于密度泛函理論,水平上的結構預測,通過光譜表征和從頭計算研究了溶劑(水或乙醇)與二氧化鈦表面的相互作用。這兩種溶劑與二氧化鈦表面的氧空位相互作用,導致二氧化鈦中的缺陷被部分或完全鈍化。在紫外光和太陽光照射下,改性樣品的光催化產氫量均有所增加。在激光過程中使用乙醇作為溶劑是提高TiO2樣品在可見光下活性的最佳選擇,見圖10。

圖10 乙醇中激光處理的TiO2膠體光催化制氫效果圖[59]Figure 10 Photocatalytic hydrogen generation using laser-treated TiO2 colloidal in ethanol[59]
Chen X D等[60]采用液相激光燒蝕法成功制備了具有豐富氧空位的金紅石 TiO2納米粒子 (NPs),然后將其組裝到自漂浮蒸發器中。結果表明,氧空位的存在縮小了帶隙并形成導帶尾態,從而顯著提高了光吸收率和光熱轉換效率。此外,泡沫鎳(NF) 載體的光捕獲結構也有助于提高激光 TiO2(L-TiO2)/NF 的太陽能吸收效率。
3 黑色二氧化鈦在催化領域的應用
3.1 光催化
黑色 TiO2表面的無序層,有利于載流子的捕獲。并且TiO2納米晶體中的無序層會產生中間態能隙,而不是離散的施主能級,將有效地與導帶邊緣重疊,在一定程度上縮小了禁帶寬度,引發了黑色 TiO2納米材料光響應范圍的紅移,因此具有更強的光催化特性。
1972年,Fujishima A等[61]在TiO2電極上發現了光催化分解水的現象,開創了多相光催化的新時代,促使全世界的研發焦點聚焦在TiO2光催化劑的能量轉換和存儲上。從熱力學角度分析,水分解電勢為 1.23 eV,所以在理想反應狀態下,半導體的禁帶寬度約為 1.23 eV 。假設產生氧和氫的超電勢被成功移除,那么半導體的電子結構應與水的氧化還原電位完全一致。該帶隙響應波長為 1 000 nm。因此,理想情況下,TiO2的顏色應調整為黑色,能隙為 1.23 eV,光吸收在近紅外區域波長接近 1 000 nm。2011 年,TiO2氫化的相關研究指出氫化是調整 TiO2帶隙的一種有效方法[6],可使 TiO2變為黑色,其帶隙約為 1.5 eV,激發光初始電壓約為 1.0 eV。此后,在光催化水制氫方面取得了大量的研究進展。
Lu H等[62]在室溫下3.5 MPa氫氣對P25粉末進行20 d處理,所得黑色TiO2納米晶體顯示出優異的光催化活性,具有3.94 mmol·(g·h)-1的高H2生成速率,而原始P25僅有0.19 mmol·(g·h)-1的H2生成速率。作者認為較高的光催化活性與Uv-vis的吸收特性和黑色TiO2的表面無序結構有關。Tian J等[63]通過在不同溫度和環境壓力H2/Ar流動氣氛下對TiO2納米帶進行退火,從而獲得了氫化的TiO2納米帶。氫化產生的氧空位和Ti3+物種可以減少黑色TiO2納米帶的帶隙并改善光生電荷的分離,從而導致黑色TiO2納米帶[6.32 mmol·(g·h)-1]比未處理的TiO2納米帶具有更高的光催化活性[0.65 mmol·(g·h)-1]。Zhu Y等[64]在少量Pt存在下,于(200~700) ℃、8%H2-N2和大氣壓下焙燒P25,合成黑色的TiO2。所獲得的具有晶體無序核-殼結構的TiO2/TiO2-x表現出最佳活性,在5 h輻射下產生1.936 mmol H2,分別是Pt/P25和P25的3倍和38倍。結果表明,由于抑制了電子空穴的重組,加氫過程中氧空位的引入和帶尾態是其催化活性增強的原因。Chen X等[6]在40 ℃加熱前驅體溶液(四異丙醇鈦、乙醇、鹽酸、去離子水和Pluronic F127有機模板) 24 h,然后在110 ℃干燥24 h,最后在 500 ℃焙燒 6 h,制備得到氫化TiO2納米顆粒。在模擬太陽光照射下(約 1 太陽功率),0.02 g 的0.6%Pt-黑色 TiO2納米晶體每小時產生 0.2 mmol H2,以甲醇為犧牲試劑。這種產氫速率比大多數半導體光催化劑的產氫速率高約兩個數量級。催化劑的能量轉換效率(產生的氫氣能量與入射太陽光能量的比值)達24%。在 15 d的15個測試循環中,高 H2產率保持不變,無需催化劑再生,表明黑色 TiO2具有出色的穩定性。Wang G等[65]揭示了氫化處理對在摻氟氧化錫(FTO)玻璃基板上制備的金紅石 TiO2納米線陣列[直徑(100~200) nm]的光催化性能有顯著影響。他們發現經過氫化處理的金紅石 TiO2納米線薄膜的顏色從白色(未經處理的樣品)到黃綠色(350 ℃),最后到黑色(450 ℃或以上)。在模擬日光照射(100 mW·cm-2)下,氫化二氧化鈦納米線樣品的光電流密度至少比原始二氧化鈦納米線高2倍。此外,光電流密度隨著氫退火溫度的升高而增加,最高可達 350 ℃。由氫化 TiO2納米線薄膜構成的陽極在氣體產生的每個循環(H2和 O2)中測得的光電流幾乎相同,表明其具有出色的穩定性。Zheng Z等[66]評估了氫化處理對銳鈦礦型TiO2納米線的光催化活性的影響,結果表明,氫化二氧化鈦納米線的產氫速率[2.15 mmol·(h·gcat)-1]分別比空氣處理的二氧化鈦和工業二氧化鈦 (P25) 高 3.2 倍和 3.8 倍。Gao J Q等[67]研究了表面氧空位與誘導晶格應變對黑色 TiO2上可見光驅動的光催化 H2析出的協同作用。對黑色 TiO2晶格參數的實驗測量和理論計算表明,在兩步鋁熱還原過程中,表面氧空位引起內部晶格應變,從而調節了黑色 TiO2的能帶結構并優化了光致電荷行為。在可見光照射下,經過應變改性的黑色 TiO2的析氫速率增加了 12 倍,達 1.882 mmol·(g·h)-1(等于 4.705 μmol·cm-2·h-1)。由表面氧空位引起的亞穩態導致高能表面的形成,增強了可見光吸收和提高光致電荷分離效率。Song H等[68]報道了通過鋁還原法制備具有超薄空心球形態、高結晶質量、小晶粒尺寸 (~8 nm) 和超高表面積 (168.8 m2·g-1) 的黑色 TiO2納米材料(見圖11)。

圖11 (a)TiO2納米結構和黑色TiO2納米結構形成示意圖;(b)TiO2 納米結構和黑色 TiO2 納米結構的光催化產氫效率圖(在全光譜太陽光下,20 mg 光催化劑負載質量分數1%Pt); (c)黑色TiO2納米結構光催化制氫循環試驗(循環測試以 7 d為周期進行測試,總光照時間為 70 h)[68]Figure 11 (a)Schematic illustration of the formation of TiO2 nanostructures and black TiO2 nanostructures;(b)Photocatalytic hydrogen generation of TiO2 nanostructures and black TiO2 nanostructures (under the full spectrum of solar light,20 mg photocatalysts,Pt mass fraction of 1%);(c)Cycling tests of photocatalytic hydrogen production of black TiO2 nanostructures(7 days as a cycle,70 h of overall light irradiation time)[68]
電子順磁共振(EPR)譜證明黑色TiO2納米結構中存在氧空位,可以增加供體密度,有效促進光生電子-空穴對的分離和傳輸。黑色 TiO2納米結構表現出在全光譜太陽光下的高產氫率[56.7 mmol·(h·g)-1],是原始 TiO2納米材料的近 2.5 倍,優于之前報道的其他黑色 TiO2光催化材料。
黑色二氧化鈦作為一種太陽能驅動的光催化劑,引起了環境治理領域科學家和工程師的極大關注。黑二氧化鈦在光照射下,價帶電子被激發到導帶,形成了電子和空穴,與吸附于其表面的O2和H2O作用,生成具有很強氧化分解能力的自由基,從而可高效分解有機物。黑色二氧化鈦作為光催化劑被廣泛用于降解有機污染物。
Zhang Z等[69]制備了Cr-SrTiO3涂層黑色TiO2,與獨立的黑色TiO2光催化劑相比,其顯示出增強的可見光吸收和對異丙醇(IPA)的優異光降解活性。采用水熱法,在1 h反應時間內,IPA降解為丙酮和CO2的性能最佳。Fujiwara K等[70]合成了另一種復合黑色TiO2納米催化劑,制備了具有Ti亞氧化物(即Ti4O7和Ti3O5)的黑色TiO2-Ag/TiOx粒子。這些化合物是通過火焰噴霧熱解法合成的,在Ag-TiO2表面通過強金屬-載體相互作用形成Ti亞氧化物。進一步地研究揭示了局部Ti3+態的存在,使得復合材料在降解MB染料和還原鉻(Cr6+)離子方面表現出優異的可見光活性。Jiang J J等[71]通過水熱處理和原位固態化學還原方法合成了Ti3+/N-共摻雜 3D 類海膽黑色 TiO2(b-N-TiO2),結果表明N和Ti3+共摻雜到銳鈦礦TiO2的晶格中。制備的 b-N-TiO2具有~2.43 eV 的窄帶隙,具有三維 (3D) 海膽狀納米結構,其纖維狀結構長度 (200~400) nm,寬度 25 nm。b-N-TiO2的甲基橙光催化降解率和析氫率分別為 95.2% 和 178 μmol·(h·g)-1,分別是原始 TiO2的 3 倍和 8 倍。優異的光催化活性主要歸因于 N 和 Ti3+共摻雜的協同效應縮小了帶隙,獨特的 3D 海膽狀結構有利于光生載流子的分離和傳輸,并提供更多的表面活性位點。Katal R等[72]
通過在真空氣氛下于不同溫度[(500~800) ℃]焙燒P25 顆粒制備黑色 TiO2,制備的黑色 TiO2表現出與在氫氣氣氛下制備的黑色 TiO2相同的性能。所得黑色二氧化鈦用于在太陽光照射下光催化降解水溶液中的對乙酰氨基酚(ACE); 發現在 500 ℃下燒結的 P25 顆粒在太陽光照射下對 ACE 降解具有最高的光催化性能。還比較了制備的黑色TiO2在真空和氫氣氣氛下的光催化活性,結果表明,兩種樣品的光催化活性非常接近。
光催化還原二氧化碳轉化為太陽能燃料是解決能源危機和全球變暖有希望的解決方案。氧空位和Ti3+物種的反應性與更需要能量的H2生成過程有關,如CO2還原[73]。在許多情況下,H2被視為形成其他富能化合物的中間產物,如醇類和生物質[74]。
Fang W等[75]制備了TiO2光催化劑,其含有大量的Ti3+物種,這些物種通過約(1~2) nm的非晶態表面層“保護”免受氧化。此外,他們通過改變合成路線中氟離子的濃度來控制暴露面(001)和(101)的方向。(001)和(101)晶面起到空穴和電子收集器的作用,改善了它們的分離。此外,這種可調的形貌導致了CO2選擇性還原為CO和CH4。優化后的樣品含有20%的(001)晶面(8,5c),對CH4的光催化選擇性從(101)晶面為主的51.7%提高到83.4%。總之,增強的光吸收、改進的載流子分離和優先暴露晶面,導致了TiO2-x表面在無貴金屬的情況下可實現CO2光催化還原。
Xing M等[76]提出了另一項關于氟化TiO2-x對選擇性無金屬CO2光還原甲烷影響的研究。在這項工作中,TiO2-x介孔單晶(MSC)摻雜有F原子,根據DFT計算,F原子取代了TiO2-x晶格間隔中的氧空位,由于F原子的強電負性,吸引了Ti3+中的電子,使Ti4+再生。結果出現了一個內部強電場,導致Ti3+含量上升,并使材料具有更強的還原電位[見圖12(a)]。用動力學更好地解釋了氟化材料的更高選擇性,使中間產物CO快速還原為甲烷[見圖12(b)和12(c)]。材料穩定性很好,但在連續光照條件下僅評估了16 h。

圖12 (a)MSC氟化導致導帶提高的示意圖;(b)在模擬太陽光、CO2和H2O存在下不同樣品不同時間光催化生成CH4的效率; (c)MSC氟化前后選擇性的對比[76]Figure 12 (a)Schematic diagram of the increase in conduction band caused by MSC fluorination;(b)Efficiency of photocatalytic production of CH4 in different samples at different times in the presence of simulated sun light,CO2 and H2O vapor; (c)Comparison of selectivity before and after MSC fluorination[76]
氨氣 (NH3) 是現代社會必不可少的化學物質。常見的氨氣制備方法是H2和 N2在極高壓力 (>20 MPa) 和高溫 (>673 K) 條件下采用 Haber-Bosch工藝制備。Hirakawa H等[77]采用氫化法制備了具有大量表面氧空位的黑TiO2,當在含有 N2的純水中用紫外線光照射時,成功生成了 NH3。催化劑上的氧空位和Ti3+是N2還原的活性位點、吸附位點和光形成的導帶電子的俘獲位點。因此,這些特性促進了 N2還原 生成NH3,太陽能到化學能的轉換率為0.02%。
3.2 電催化
由于化石燃料的枯竭和相關的環境問題,可持續和環境友好的能源儲存轉換方法對現代工業變得越來越重要。鋰離子電池 (LIB) 取得了顯著的成功,并將在未來幾年持續改進。然而,由于正極材料的理論容量限制,LIBs的實際能量密度僅約為200 Wh·kg-1(相對于汽油的12 200 Wh·kg-1),限制了其在許多領域的應用。對負極進行改性,提高其能量密度尤為重要。黑色二氧化鈦由于其獨特的核殼結構,不僅具有優異的導電性還具有非常好的離子擴散通道,含有的缺陷態,不僅能提高電子傳輸速率,還可以提高其離子擴散速率,同時,由于結晶核與非晶殼的差異,還能構建一個內建電場,從而實現離子電池性能的進一步提升。Yang Y C等[78]通過電化學方波交流電壓法成功制備了黑色缺陷TiO2納米晶體。伴隨劇烈析氫的鈦箔表面的重復氧化還原,對于黑色 TiO2納米晶體的形成起關鍵作用。當用作鋰離子電池負極材料時,黑色 TiO2納米晶體電極在 0.5C (1C=168 mA·g-1) 下循環 200 次后表現出 271 mAh·g-1和 266 mAh·g-1的高可逆容量,以及良好的倍率能力,這可能與小粒徑(約 6 nm)、表面/界面Ti3+缺陷導致贗電容鋰存儲和電子電導率增加有關。
鋰氧電池 (LOB) 作為一種有吸引力的二次電池已被廣泛研究,因為其具有超高的能量密度。但其充電電壓高、循環穩定性差和倍率性能低使其實際應用非常有限。由于正極是 LOBs 的主要反應部位,改善陰極催化劑結構和催化活性是提高電化學性能的主要方法。Ge J J等[79]通過在氬氣中焙燒合成了有色二氧化鈦納米粒子。拉曼和 XPS 證實黑色 TiO2中存在比灰色 TiO2具有更多的氧空位和Ti3+。HRTEM 分析還揭示了 TiO2表面上 (2~3) nm 的缺陷層。由氧空位和 Ti3+離子誘導的高導電性和良好的催化活性,黑色 TiO2基正極具有良好的電化學活性和增強的 LOB 循環穩定性。與灰色TiO2(4.3 V)相比,黑色 TiO2納米顆粒顯示出低過電位,充電電壓為 3.7 V。充電電壓顯著降低約 600 mV,減少了電池的副反應和極化,從而提高電池的循環性能。當斷流容量為 500 mAh·g-1時,可運行108個循環,端電壓無明顯變化,表明黑色TiO2是一種有效的LOB催化劑(見圖13)。

圖13 (a)黑色 TiO2、灰色 TiO2和純 CNT 陰極在 100 mA·g-1 電流密度下的初始放電/充電曲線; (b)不同電流密度下黑色 TiO2陰極的初始放電/充電曲線; (c)容量限制為 500 mAh·g-1 下黑色 TiO2、灰色 TiO2和純 CNT正極的初始放電/充電曲線; (d)容量限制為 500 mAh·g-1 下黑色 TiO2 的充放電曲線; (e)黑色 TiO2、灰色 TiO2 和純 CNT 陰極的循環性和端電壓[79]Figure 13 (a)The initial discharge/charge curve of black TiO2,gray TiO2,and pure CNT cathode at a current density of 100 mA·g-1; (b)The initial discharge/charge curve of black TiO2 cathode at different current densities;(c)The initial discharge/charge curve of black TiO2,gray TiO2 and pure CNT cathode at capacity limit of 500 mAh·g-1;(d)The charge and discharge curve of black TiO2 at a capacity limit of 500 mAh·g-1;(e)The cyclicity and terminal voltage of black TiO2,gray TiO2 and pure CNT cathode[79]
由于其成本低和豐富的鈉來源以及隨時可用的鈉,鈉離子電池(SIBs)近來備受關注。高容量和穩定性的負極材料是SIB用于工業化的關鍵。由于鈉的直徑離子比鋰離子大,鈉離子不像鋰離子那樣容易嵌入石墨。因此,尋找合適的負極材料為SIBs的工業化迫在眉睫。TiO2資源豐富且結構穩定、反應電壓高(≈0.6 V,vs.Na)和理論容量高達 335 mAh·g-1。上述優點使 TiO2成為 SIBs 的候選負極材料。Chen J等[80]研究了不同退火工藝下,物相和缺陷的協同作用對自支撐 TiO2-x納米管陣列 (TNTA)的演化規律,展示了與傳統 TiO2納米粒子不同的特性。物相組成和氧空位(OV)濃度調整策略相結合,系統地闡明協同效應影響 TNTA 的鈉儲存特性。特別是在空氣中 300 ℃退火的獨特多孔壁黑色非晶 TNTA 和在 N2中 600 ℃退火的核殼黑色銳鈦礦 TNTA ,分別在所有非晶和銳鈦礦樣品中顯示出最佳的儲鈉性能。循環伏安法 (CV) 動力學分析表明,TNTA 中存在贗電容和擴散控制的電荷存儲機制,詳細闡明了贗電容容量和擴散控制容量與 OV 濃度和物相的相關性。在無定形和銳鈦礦 TNTA 中具有高 OV 濃度的樣品中,贗電容容量和擴散控制容量均得到增強。密度泛函理論 (DFT) 計算進一步表明,高 OV 密度對應于低鈉插入能量和高容量,這與實驗結果相匹配。
黑TiO2還可用于鎂離子電池的電極材料,由于二價Mg2+離子極性大,Mg2+插入電極材料的動力學緩慢,嚴重限制了鎂電池的性能。Wang Y R等[81]以超薄二維 TiS2納米薄片作為前驅體來制備具有豐富氧空位 (OV) 和孔隙率的超薄黑色 TiO2-x(B-TiO2-x) 納米薄片,發現 B-TiO2-x電極材料中 OV 的存在可以大大提高可充電鎂電池的電化學性能。實驗結果和密度泛函理論模擬都證實了 OV 的引入可以顯著提高電導率,增加 Mg2+離子存儲的活性位點數量。富含空位的 B-TiO2-x納米薄片在高電流密度下長期循環后表現出高可逆容量和良好的容量保持率(見圖14)。
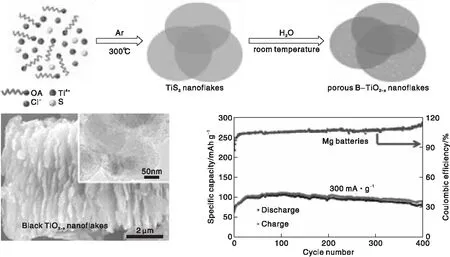
圖14 B-TiO2-x納米薄片的制備路線、形貌及其長期循環后的電容量[81]Figure 14 Preparation route,morphology and capacitance after long-term cycling of B-TiO2-x nanosheets[81]
3.3 光電催化
黑TiO2是一種半導體材料,其光電催化反應是以光照后半導體內產生電子-空穴對為起點。黑TiO2光電催化的基本原理是,當光子能量大于等于黑TiO2禁帶寬度的光照射在黑TiO2表面時,價帶電子吸收光子能量躍遷到導帶而成為導帶電子,同時在價帶上產生空穴,光生電子-空穴對經黑TiO2表面空間電荷層電場分離后,分別參加電極反應。作為光電催化劑,黑TiO2禁帶寬度適中、耐光腐蝕和化學穩定性好,為此人們對其光電催化性能進行了廣泛研究。光電催化主要是應用在分解水制氫、CO2還原和降解有機化合物等領域。
Li S等[82]通過鈦片的陽極氧化和氫化工藝成功制備了氫化二氧化鈦納米管(H-TNTs)電極。TiO2納米管 (TNT) 晶體結構中的氧空位可作為增強 TNT 電子導電性的供體。通過光電化學表征證實和評估了電子電導率和光電催化性能,重要的是H-TNTs 電極能夠不加選擇地降解鄰苯二甲酸氫鉀(強吸附劑)和葡萄糖(弱吸附劑)。對于相同濃度的有機化合物,H-TNT 的響應光電流比 TNT 樣品的光電流大 2 倍,表明 H-TNTs 電極可以成為一種理想的傳感器,用于測定單個有機化合物的光電催化性能,或作為有機化合物的聚合參數(如化學需氧量)。Zhang Z等[83]通過控制陽極氧化的持續時間和在氬氣氣氛中退火,通過兩步陽極氧化程序合成了黑色 TiO2納米管陣列。在陽極氧化和氧化過程中,黑色 TiO2納米管陣列中引入了氧空位。黑色 TiO2納米管陣列由于大量的氧空位,表現出優異的光電催化性能和穩定的光電化學性能,保證了電荷分離效率和強可見光吸收。通過羅丹明 B (RhB) 的分解率來監測樣品的光電催化活性。值得注意的是,黑色 TiO2納米管陣列在電化學阻抗譜 (EIS) 中表現出較低的電荷轉移電阻。Ar氣退火制備的 TNT-6h 納米管陣列(1.2 mA·cm-2) 的光電流密度比在空氣中退火的 TiO2納米管陣列(0.1 mA·cm-2)高近 12 倍(見圖15)。黑色 TiO2納米管陣列中氧空位的形成受陽極氧化持續時間和退火氣氛的影響。一定數量的氧空位顯著改善光生電子和空穴的分離效率,從而提高光電催化效率。Li H等[84]研發了一種簡便的電化學方法,通過在乙二醇電解質中對 TiO2進行陰極偏置來改性銳鈦礦型 TiO2。所得黑色 TiO2高度穩定,帶隙明顯更窄,導電性更高。此外,大大提高了光轉換率(可見光區從48%增加到 72%,紫外區從接近 0% 到 7%),處理后的 TiO2光催化效率和電荷存儲能力增加了 42 倍。

圖15 (a)氬氣退火制備的黑色-TNTs的FESEM照片;(b)在黑暗中收集的線性掃描伏安曲線,使用三電極系統(對電極:Pt,參比電極:Ag/AgCl,工作電極:L樣品)檢測光電化學性質;(c)在 AM 1.5模擬太陽光下收集的線性掃描伏安曲線; (d)air-TNTs 和 Ar-TNTs 的瞬態光電流響應0.5 V vs.Ag/AgCl[84]Figure 15 (a)FESEM image of black-TNTs prepared by argon annealing;(b)the linear scanning voltammogram collected in the dark,using a three-electrode system (counter electrode:Pt,reference electrode:Ag/AgCl,working electrode:sample) to detect photoelectrochemical properties;(c)the linear scanning voltammogram collected under the AM 1.5 solar simulation;(d)the transient photocurrent response of air-TNTs and Ar-TNTs 0.5 V vs.Ag/AgCl[84]
黑TiO2的表面電位、平帶電位、偏置電壓的施加及黑TiO2薄膜性能等都會影響光電催化的可能性及轉換效率。光電催化劑普遍存在的問題是:光能轉換效率低,大多在1%~3%,甚至更小;催化劑活性不夠高;催化劑選擇性不夠好,大多是系列產物分布;催化劑壽命不夠長,連續使用期僅數月或數年。
3.4 熱催化
熱催化主要利用黑TiO2中豐富的氧缺陷和較高的氧傳導能力,可促進反應物的氧化過程,在環保和生物制天然氣等領域有應用。
Meng F等[85]采用浸漬法制備了CrOx基催化劑(CrOx/黑TiO2,CrOx/TiO2)用于NO的催化氧化。催化活性測試結果表明,CrOx/黑TiO2比CrOx/TiO2對NO的氧化具有更高的催化活性,結果表明,CrOx/黑TiO2和CrOx/TiO2具有不同的構效關系。CrOx組裝在黑色TiO2表面的氧空位中,而CrOx高度分散在TiO2表面上。結合XPS、TPR和TPD等結果,表明CrOx與CrOx/黑TiO2催化劑上的氧空位之間的強相互作用有利于產生更多的Cr6+含量和化學吸附氧,從而可以吸附并激活NO分子并加速NO氧化。CrOx/黑TiO2表現出良好的穩定性,并具有良好的抗H2O和SO2性能。此外,穩態動力學研究表明,CrOx/黑TiO2的活化能低于CrOx/TiO2的活化能。
Zeng Y等[86]通過溶膠-凝膠法制備的黑色二氧化鈦用于氨氣催化還原NO。催化活性測試表明,黑色TiO2具有較高的催化活性,在(300~360) ℃幾乎達到1.5%V2O5/TiO2催化劑的NO去除效率,而且具有較高的催化穩定性、抗H2O+SO2和N2選擇性(見圖16)。在黑色TiO2上觀察到大量的氧空位,這些氧空位可以促進表面羥基的形成,這些羥基被認為是NH3吸附的酸性中心。同時,改變了鈦物種對黑色TiO2的氧化還原電位,從而有效地改善了黑色TiO2的氧化還原性能。因此,作者認為黑色TiO2的高NH3吸附容量和優異的氧化還原性能通常是其在NH3-SCR中具有優異催化活性的原因。

圖16 (a)黑 TiO2-500 催化劑的 NO 轉化率; (b)空速對NO 轉化率的影響; (c)長期穩定性和耐水性;(d)耐硫性能[86]Figure 16 (a)NO conversion of black TiO2-500 catalyst;(b)effect of GHSV on NO conversion;(c)long-term stability and water resistance;(d)sulfur resistance[86]
李歌等[87]以鈦鐵礦為原料制備了TiO2納米粉體,采用氫化法制備了黑TiO2納米材料,并對其NH3-SCR脫硝活性進行了測試,結果顯示,在(300~400) ℃時,黑TiO2納米材料的脫硝活性超過90%,N2選擇性超過85%。
Han C Y等[88]通過溶膠-凝膠法制備了黑色二氧化鈦,并對催化臭氧的脫硝活性進行了測試,O3與NO 物質的量比為 0.6,與單獨的 O3相比,NOx去除率提高了21.2%。與TiO2催化劑相比,黑色 TiO2的 NO 轉化率也提高了 8.6%。此外,離子色譜(IC)結果表明,HNO3是這種催化臭氧化去除黑色 TiO2過程的主要產物。
Zhou H R等[89]研發一種載體氧缺陷介導方法,將“生物質氧化到CO2”與“CO2催化加氫到CH4”兩個過程耦合起來,實現了較溫和條件下的生物質資源直接甲烷化過程。研究發現,生物質分子被Ru/TiO2催化劑的晶格氧氧化至CO2,并在催化劑上生成氧缺陷;隨后,CO2加氫還原到CH4過程中,裂解出的氧原子填充氧缺陷從而恢復催化劑。該催化過程在溫度低至120 ℃時仍可穩定催化甘油水溶液產生CH4(見圖17)。研究工作為生物質資源的有效利用提供了新思路。

圖17 載體氧缺陷介導的生物質直接甲烷化新方法[89]Figure 17 A new method for direct methanation of biomass mediated by carrier oxygen deficiency[89]
3.5 其他催化
Zeng L等[90]采用低溫常壓低濃度氫氣短時退火制備了改性TiO2。氫化TiO2(H-TiO2)和氫化碳摻雜的TiO2(H-C-TiO2)室溫下無需光照即可分解氣態甲醛。與純TiO2相比,H-TiO2和H-C-TiO2可以引入更多的氧空位和表面羥基,這對在黑暗中催化氧化氣態甲醛有重要貢獻。Barzan C等[91]采用氫化法制備了黑TiO2材料,其在溫和條件下(室溫、低壓、沒有任何活化劑)可將乙烯轉化為高密度聚乙烯 (HDPE),進而形成 HDPE/TiO2復合材料。結合UV-vis 和 IR 光譜可以證明乙烯聚合發生在 Ti4-n缺陷位點上,這些位點表現為位于帶隙中的淺陷阱缺陷,與廣泛使用的 Ziegler-Natta 催化劑中的活性位點不同,不含任何烷基 (Ti-R) 或氫化物 (Ti-H) 配體。
目前黑TiO2催化劑的研究已成為前沿熱點,在光催化、電催化、光電催化和熱催化等各個方向的研究也越來越多(見表1)。并且,研究人員發現缺陷在黑TiO2催化劑中起到的作用并不是單一作為活化分子的位點,還可以改變表面電子結構,優化反應吸附能;吸附異質原子,形成新的活性中心;引入缺陷能級,調節電子、能帶結構;重構缺陷形成新的活性位點。目前,隨著研究的深入已經可以通過設計黑TiO2催化劑的缺陷結構實現對缺陷作用的豐富和拓展,以合成具有更高活性、更多功能的催化劑。

表1 黑TiO2 催化劑的制備方法、性質和應用table 1 Preparation methods,properties and applications of black TiO2 catalysts
4 結 論
隨著缺陷催化劑的快速發展,關于缺陷催化劑的合成、表征及催化應用的研究越來越多。研發人員們已采用多種方法制備出不同缺陷分布的黑TiO2。除了常見的氫化法、氫等離子體法、化學氧化/還原法和激光法外,還有真空/惰性氣體高溫焙燒法[72,79-81]、陽極氧化退火法[82-83]以及在反應合成過程中引入缺陷的溶膠-凝膠法[85,86,88]和水熱法[75-76]等。不同的制備方法產生不同類型的缺陷,熱處理法(氫化、惰性氣體高溫焙燒)和高能粒子轟擊(等離子體、激光等)制備的黑TiO2的缺陷主要分布在材料表面,而直接在TiO2合成過程中引入的缺陷大多分布在體相。由于催化過程主要發生在催化劑表面,因此合理調控表面和體相缺陷的比例而適用于不同應用領域至關重要。
另外,目前關于黑TiO2催化劑的研究均限于實驗室研發階段,尚未見任何關于放大生產的報道。現有的制備方法,存在成本高、安全性差、能耗高和無法重復等問題,限制了其大規模生產,未來急需尋找一種安全性高、成本低和可大量生產黑TiO2的制備方法。
雖然采用很多方法均能制備黑TiO2納米材料,但是黑TiO2納米材料中缺陷的含量卻很難定量出來,現有的技術方法均是通過半定量測試Ti3+的含量來推算缺陷的含量。同時缺陷的種類和含量隨著不同的應用場景而變化,現有的研究還缺少測試方法來隨時觀察缺陷的變化,缺陷和其相對應的光催化、電催化和熱催化的原位構效關系還缺少定量的解釋。因此,還需開發運用更加先進的分析測試表征方法和模擬方法為催化機理的深入研究服務。
黑TiO2由于具有一定量的氧空位,長期在室溫下儲存會被空氣重新氧化,因此黑TiO2經常需要隔絕氧氣來儲存,這無形中提高了存儲的成本。同時催化劑在工業生產中需要成型,常見的成型工藝,比如擠出法和涂覆法等,均需要烘干和焙燒等工藝,在烘干和焙燒過程中氧氣的存在依然會將已還原的黑TiO2氧化,這也限制了其工業應用,因此尋找更好的穩定黑TiO2氧空位的方法或適合黑TiO2的成型工藝至關重要。
此外,黑TiO2催化劑已被用于催化分解有機污染物、光催化制氫和催化還原CO2等。近些年,黑色二氧化鈦的新應用領域不斷涌現。黑TiO2可作為微波吸收材料(MAMs),其TiO2晶體核和非晶殼的核殼結構可以很好地吸收微波[92]。另一個應用是通過光催化消毒的自清潔涂料[93]。未來,其可以和熱催化和電催化聯用,擴展更多的應用領域。在醫學領域,即光熱和光動力療法等,服務于醫藥行業。同時還可應用在環境領域,大氣環保方向,如NOx的選擇性催化還原、VOCs的催化氧化、N2O的催化還原/分解和O3的催化分解等。
5 結語與展望
自2011年開始,黑色TiO2納米材料引起了廣泛的科學研究興趣,并在多個領域展現出光明的應用前景。一系列合成方法逐漸被發掘,豐富的制備方法為材料的合成提供了靈活性,然而在大小、形貌、性質和性能調控方面依然很復雜。結構和化學改性可以被用來改變表面、電學、光學和電子性質。通過改變這些性質,可以達到增強鋰電池、超級電容器、能源電池、場發射電極、微波吸收和癌癥光熱治療效果的目的。伴隨諸多優點的同時,許多問題和挑戰也隨之而來。能否根據應用領域設計不同缺陷位置和含量的黑TiO2,還需開發先進的分析測試表征方法和模擬方法深入研究催化機理,尋求安全性高、成本低、可大量生產黑TiO2的制備方法、成型工藝和儲存方法等問題還需解決。
總之,這種具有獨特光學、電學和氧化還原性質的黑TiO2在光催化劑領域乃至其他醫藥、環境、新能源領域都會有更加廣泛的應用。因此,在未來的研發中應開發新的可工業化的黑TiO2制備方法,深入研究構效關系,改進儲存及成型工藝,拓展新的研發領域等。

