MicroRNA-25在喉鱗癌細胞侵襲轉移中的作用探討
陳立偉,翟性友,黃邦清,劉宸箐,張永俠,趙建東,劉明波
1 解放軍總醫院海南醫院 耳鼻咽喉頭頸外科,海南三亞 572013;2 解放軍總醫院第六醫學中心 耳鼻咽喉頭頸外科醫學部,北京 100048
喉癌是頭頸部常見的惡性腫瘤,96% ~ 98%病理類型為鱗狀細胞癌。當前,手術是治療喉癌的主要手段,而非手術治療,如放療、化療和免疫治療,已經成為可選擇的重要治療手段[1-2]。一項癌癥統計報告顯示,過去40年中喉癌的5年生存率從66%下降至63%,而造成喉癌患者死亡的主要原因是局部的復發和轉移[3-5]。我們試圖在分子水平尋找調控喉癌發生發展的關鍵因子,以期推進喉癌的早期發現、早期治療和有效生物治療靶點的研究。我們前期在研究喉癌轉移機制時成功建立喉癌淋巴結轉移動物模型,應用喉鱗癌細胞系Hep-2細胞注射裸鼠舌緣黏膜下,待腫瘤形成并發生淋巴結轉移后,無菌取裸鼠頸部淋巴結,培養轉移到淋巴結的腫瘤細胞,經反復接種,獲得高轉移性Hep-2細胞亞系。進一步應用microRNA微陣列基因表達實驗(LC Sciences,Houston,TX)對親本Hep-2細胞和高轉移性Hep-2細胞亞系兩組細胞microRNA表達譜進行檢測和分析,發現親本喉癌細胞和高轉移性喉癌細胞亞系中存在明顯的microRNA差異表達現象。經過生物信息學分析及臨床患者組織標本驗證,我們發現microRNA-25(miR-25)和miR-100可能對喉癌侵襲轉移起到重要的調控作用[6]。本研究通過增加和抑制喉鱗癌細胞系Hep-2細胞中miR-25的表達,驗證miR-25對喉鱗癌細胞侵襲、遷移和增殖功能的影響。
材料與方法
1 試劑和儀器 RPMI-1640培養基、DMEM培養基、胎牛血清(美國Gibco公司),LipofectamineTM2000(Lip2000,Invitrogen公司)。
2 細胞培養和細胞轉染 喉鱗癌Hep-2細胞系由解放軍總醫院第六醫學中心耳鼻咽喉頭頸外科醫學部頭頸外科課題組儲存,細胞在含10%胎牛血清(Gibco)的DMEM培養基中于37℃、5% CO2培養箱中培養。Hep-2細胞經消化、離心后,采用完全培養基進行重懸,調整細胞密度為4×105/mL,按照6孔板中每孔2 mL細胞懸液進行接種,常規培養。待細胞生長狀態良好,密度達80%左右時,更換為無血清培養基。實驗設置5組:1)空白對照組,細胞不做任何處理;2)Mimic control組:細胞轉染不會引起任何miRNA表達改變的mimic序列;3)Inhibitor control組:細胞轉染不會引起任何基因表達改變的Inhibitor序列;4)miR-25 mimic組:細胞轉染miR-25的mimic,序列可以引起miR-25的高表達;5)miR-25 inhibitor組:細胞轉染miR-25的抑制序列,可以降低miR-25的表達。轉染過程:取4個EP管,分別加入不含FBS的1640培養基200 μL,再各自加入轉染試劑Lip2000 5 μL,輕吹混勻;取另4個EP管,均加入不含FBS的RPMI 1640培養基200 μL,再加入分別加入Mimic control、miR-25 mimic、Inhibitor control、miR-25 inhibitor 2 μL,輕吹混勻。8個管分別靜置5 min;將加入Mimic control、miR-25 mimic、Inhibitor control、miR-25 inhibitor管中液體分別吸入裝有Lip2000的管內,共400 μL的Mix,靜置20 min;將Mix滴入6孔板內,前后左右搖晃10 ~ 15次;置培養箱內,孵育6 h后更換為含FBS的RPMI 1640培養基;轉染24 h后收集各組細胞,進行后續檢測。
3 RT-qPCR驗證miR-25的表達 采用 Invitrogen公司的Trizol試劑盒及操作方法提取細胞總RNA,紫外分光光度法定量后,采用GoScriptTM公司逆轉錄試劑盒,取2.5 μg總RNA進行逆轉錄反應,逆轉錄產物采用SYBR Green方法進行PCR擴增。反應條件:預變性,95℃,2 min;變性,95℃,20 s;退火,60℃,20 s;延伸,72℃,30 s;40個循環;熔解曲線分析:95℃,1 min;60℃,1 min;95℃,30 s。反應完成后,采用2-△△Ct法作為相對定量差異表達的度量。所有反應都以U6小核RNA用作內參對照,以確定相對microRNA表達水平。
4 Transwell細胞侵襲實驗 各組細胞經轉染處理后制備成細胞懸液,調整細胞濃度為2×105/mL。用Matrigel(1 mg/mL,美國BD公司)膠包被Transwell小室(孔徑8 μm,美國Corning公司)。取細胞懸液200 μL加入Transwell上室,下室中加入500 μL的DMEM完全培養基,盡量排除兩室之間的氣泡。培養12 h后取出Transwell小室,用蘸有PBS的棉簽擦去小室上層的細胞,取下Transwell膜,甲醇固定20 min后,PBS清洗3次,Giemsa染液,染色30 min,PBS清洗3次,棄去PBS后晾干,于顯微鏡下隨機選取5個視野拍照計數,取平均值為最終結果。
5 細胞劃痕實驗 將轉染后24 h的各組Hep-2細胞以1×105/孔接種于24孔板中,待細胞密度達到80%以上融合時,棄去上清,保證Tip頭垂直進行劃痕,各孔劃痕寬度保持基本一致。采用PBS洗滌3次后向各孔中加入無血清培養基,置于37℃、5% CO2培養箱中繼續培養,間隔48 h后觀察細胞分布并進行拍照。細胞劃痕愈合率=(0 h劃痕寬度-48 h劃痕寬度)/0 h劃痕寬度×100%。
6 MTT細胞增殖實驗 收集各組細胞,以1×103/孔接種細胞于96孔板中,在含10%胎牛血清的DMEM培養基中培養,分別于第1、2、3、4天加入20 μL MTT(5 mg/mL,美國Sigma-Aldrich公司),培養4 h后,加入150 μL DMSO,振蕩10 min ,使結晶物充分溶解。490 nm酶聯免疫檢測儀檢測各孔光吸收值。以時間為橫軸,光吸收值為縱軸,繪制細胞增殖曲線。
7 統計學分析 采用Stata軟件進行統計分析。計量資料以x±s表示,兩組間比較用t檢驗,三組間比較用單因素方差分析+多重比較LSD-t檢驗。P<0.05為差異有統計學意義。
結 果
1 Hep-2細胞中miR-25表達的變化 轉染miR-25 mimic 24 h后,RT-qPCR檢測發現Hep-2細胞中miR-25的表達量是正常對照組的2.48倍(P<0.01),而轉染miR-25 inhibitor 24 h后,RT-qPCR檢測發現Hep-2細胞中miR-25的表達量較正常對照組下降了35%(P<0.05)。見圖1。
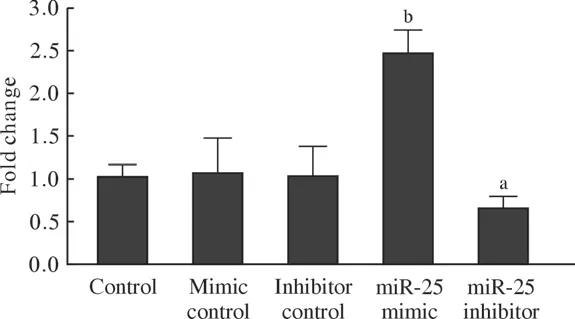
圖1 RT-qPCR檢測Hep-2細胞轉染miR-25 mimic和miR-25 inhibitor后miR-25表達變化(aP<0.05,bP<0.01,vs Control)Fig.1 RT-qPCR detection of miR-25 expression after transfection of miR-25 mimic and miR-25 inhibitor (aP<0.05, bP<0.01, vs control)
2 細胞侵襲能力觀察 Transwell細胞侵襲實驗顯示,miR-25 mimic轉染Hep-2細胞24 h后,Hep-2細胞穿過Transwell小室的腫瘤細胞數量顯著低于對照組(P<0.01),證明miR-25的高表達顯著抑制了喉癌Hep-2細胞的體外侵襲能力。抑制miR-25表達后,得到了與過表達miR-25表達相反的實驗結果,即Hep-2細胞的侵襲能力出現顯著增加(P<0.01)。見圖2。
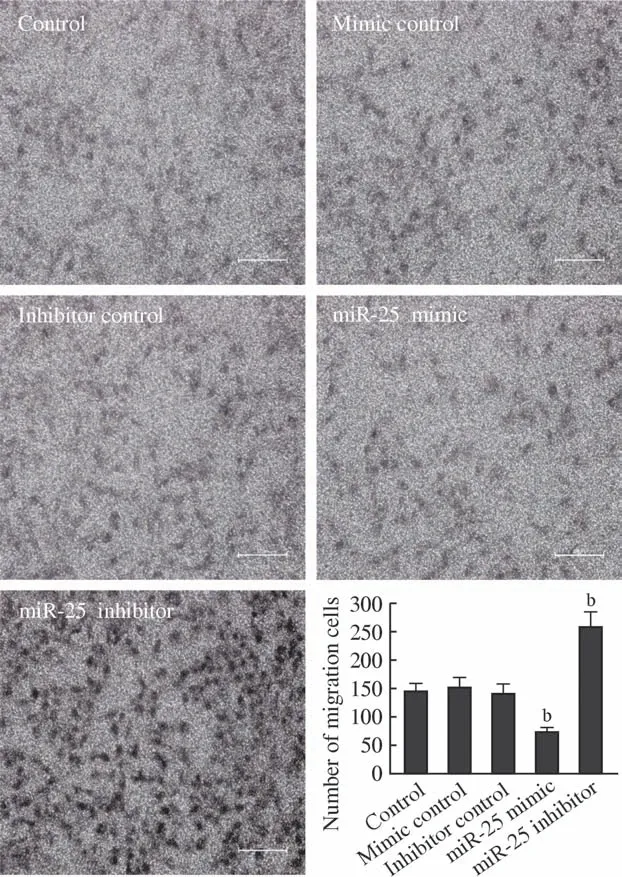
圖2 Hep-2細胞Transwell侵襲實驗(bP<0.01,vs Control)Fig.2 Transwell cell migration test of Hep-2 cells (bP<0.01, vs control)
3 細胞遷移能力觀察 Hep-2細胞中miR-25過表達后,Hep-2細胞劃痕愈合率(32.4%±3.05%)顯著低于正常對照組(47.2%±4.324%);而抑制miR-25的表達后Hep-2細胞劃痕愈合率(87.2%±5.45%)顯著高于正常對照組。見圖3。
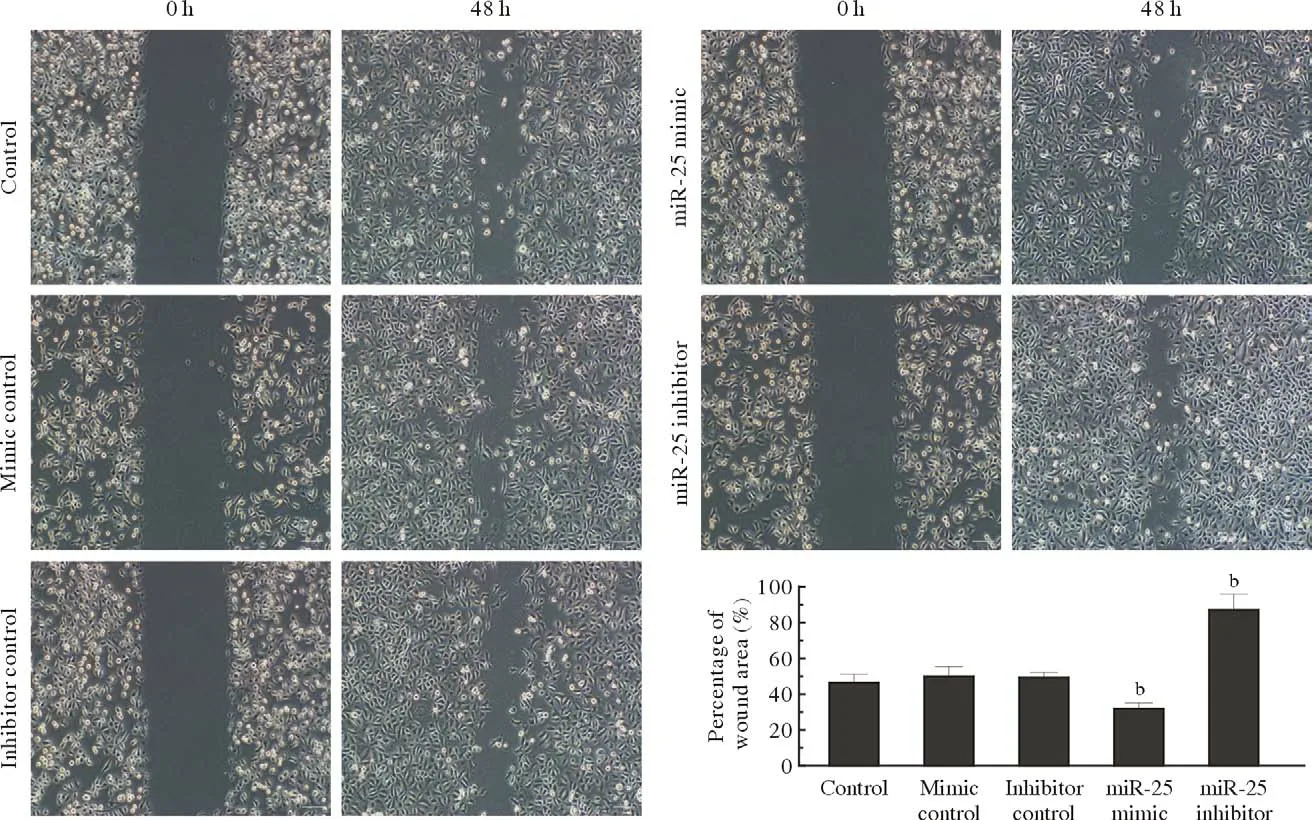
圖3 Hep-2細胞劃痕實驗(bP<0.01,vs Control)Fig.3 Cell scratch test of Hep-2 cells (bP<0.01, vs control)
4 細胞增殖能力觀察 MTT細胞增殖實驗結果顯示,喉鱗癌Hep-2細胞轉染miR-25 inhibitor、miR-25 mimic后,與正常對照組比,miR-25低表達組在第3天時腫瘤活細胞數量顯著增加,第4天時由于96孔板內細胞覆蓋度達到100%,導致差異消失。miR-25過表達組腫瘤活細胞數量顯著減少,Hep-2細胞增殖能力在第3、4天均表現為顯著降低。見圖4。
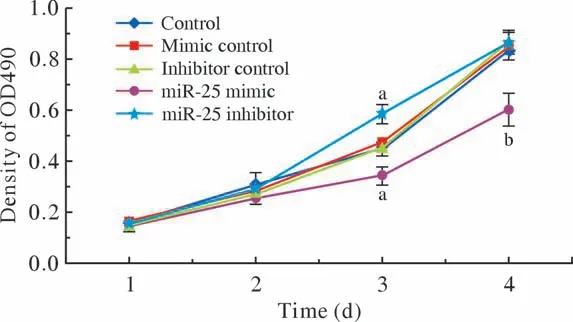
圖4 Hep-2細胞MTT增殖實驗 (aP<0.05, bP<0.01,vs Control)Fig.4 MTT cell proliferation test of Hep-2 cells (aP<0.05, bP<0.01,vs control)
討 論
MicroRNA是單鏈小型非編碼RNA,含有大約22個核苷酸。MicroRNA通過與mRNA3'端的非翻譯區結合,抑制mRNA的翻譯或降解mRNA。大量研究表明,microRNA可以通過調節癌細胞增殖、分化、侵襲、遷移和細胞凋亡在癌癥中起著關鍵作用[7-9]。
在所有 microRNA 中,miR-25 是在人類不同癌癥中研究最多、描述最充分的microRNA之一。miR-25在不同癌癥中的作用報道不一,在前列腺癌和結腸癌中,miR-25表達降低起到腫瘤抑制劑作用[10]。而在乳腺癌、卵巢癌、胃癌、肝細胞癌及肺癌中miR-25表達顯著增加,起到促進腫瘤細胞生長和增殖的致癌作用[11-17]。一項結腸癌的研究報道,人類結腸癌組織中的miR-25與匹配的非腫瘤黏膜組織相比,處于低調節。有研究表明,miR-25可抑制腫瘤細胞增殖和遷移,而且是通過調節Smad7起作用[18]。miR-25在喉癌中的作用目前仍未明確。我們前期研究發現,在高轉移性喉癌細胞中miR-25的表達顯著降低,且在喉癌患者腫瘤標本中得到驗證[6]。
本研究中,通過轉染miR-25 mimic和miR-25 inhibitor分別過表達和抑制喉鱗癌Hep-2細胞中的miR-25,發現miR-25表達量的下降顯著增加了Hep-2細胞的體外侵襲遷移能力,并且Hep-2細胞的體外增殖能力也顯著增加。而miR-25的表達上調后,喉癌細胞的惡性能力顯著下降。提示miR-25在喉鱗癌中起到抑癌作用,與我們前期研究發現在轉移性喉癌組織中miR-25表達量下降的結果一致。研究結果高度提示miR-25作為抑癌因子在喉鱗癌的惡性進展中起到至關重要的作用,進一步研究其作用機制具有較大的臨床價值,可幫助我們尋找喉癌治療的靶點基因。

