孕早期血清25羥維生素D水平對子癇前期的預測價值
李雪芹,黎婷婷,許 鵬
(重慶大學附屬三峽醫院婦產科,重慶 萬州 404000)
子癇前期(pre-eclampsia,PE)是妊娠20周后孕婦出現高血壓病并伴有蛋白尿,或不伴有蛋白尿但有心、肺、肝、腎等重要臟器或血液系統、消化系統、神經系統的異常,進而導致胎盤-胎兒受累等表現的疾病,是妊娠高血壓疾病的常見類型[1-2]。有報道顯示:在全世界范圍內該病的發病率為2%~8%,國內發病率為1.92%,全世界每年約有6萬孕產婦因PE而死亡[3]。目前對于該病的發病機制尚未完全明確,普遍認為可能與遺傳、免疫耐受失衡、炎癥反應、血管內皮損傷有關。維生素D狀態的最佳生物標志物是血清25-羥基維生素D[25-hydroxy-vitamin D,25(OH)D],其代表鈣和骨的代謝狀態,并與體脂肪、血糖控制、脂質代謝和血壓呈負相關。有調查顯示國內80%的孕婦存在維生素D不足的情況,北方地區尤為嚴重[4-5]。越來越多的證據顯示維生素D缺乏與妊娠期糖尿病、流產、早產、妊娠期高血壓疾病等不良妊娠結局的發生相關[6]。雖然有研究證實孕早期及孕中晚期25(OH)D水平均與PE發生相關[7],但關于孕早期25(OH)D水平能否作為PE的預測指標目前尚無定論,因此本研究旨在通過分析孕早期25(OH)D水平對PE的預測價值,以期為該病的早期預測提供參考依據。
1資料與方法
1.1一般資料
選擇2018年2月至2020年1月在重慶大學附屬三峽醫院進行產前檢查的1 086例孕婦進行研究,孕婦均知情同意,本研究已通過醫院倫理審查。納入標準:①孕周在8~13+6周的單胎產婦;②在我院定期產檢;③行25(OH)D檢測;④在我市居住2年以上;⑤年齡在35歲以下,身體質量指數(BMI)<24kg/m2;⑥神志清醒,可配合進行相關檢查。排除標準:①經產婦;②妊娠期合并高血壓、風濕免疫系統疾病者;③妊娠期糖尿病患者;④在25(OH)D檢測前未補充維生素D。參照《妊娠期高血壓疾病診治指南(2015)》[8]中PE的相關診斷標準,共有75例孕婦被診斷為PE,作為觀察組,在剩余的1 011例健康孕婦中根據年齡(±1歲)、末次月經時間(±2周)按1∶2的原則進行匹配,選擇150例健康孕婦作為對照組。
1.2方法
①25(OH)D水平檢測方法:在孕8~13+6周抽取調查對象空腹外周靜脈血2mL,以3 000r/min離心15min后分離血清,采用電化學發光免疫法對孕婦25(OH)D水平進行檢測,試劑盒購于德國羅氏診斷試劑有限公司,操作均由專業人員嚴格按試劑盒說明進行。②根據孕20周后孕婦的血壓及實驗室檢查結果將觀察組分為輕度PE組和重度PE組。其中血壓≥140/90mmHg、尿蛋白≥0.3g/24h或隨機尿蛋白(+)者為輕度PE;血壓≥160/110mmHg、尿蛋白≥2.0g/24h或隨機尿蛋白(++),血清肌酐>106μmol/L,血小板<100×109L為重度PE[8]。
1.3統計學方法

2結果
2.1觀察組和對照組孕婦一般情況及25(OH)D水平比較
觀察組和對照組孕婦的年齡、入組時孕周及BMI差異均無統計學意義(P>0.05)。觀察組孕婦的收縮壓、舒張壓、24h尿蛋白定量均高于對照組,25(OH)D水平低于對照組(P<0.05),見表1。
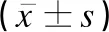
表1 觀察組和對照組孕婦一般情況及25(OH)D水平比較
2.2輕度PE組和重度PE組患者一般情況及25(OH)D水平比較
輕度PE組、重度PE組患者的年齡、入組時孕周及BMI差異均無統計學意義(P>0.05)。重度PE組患者的收縮壓、舒張壓、24h尿蛋白定量均高于輕度PE組,25(OH)D水平低于輕度PE組(P<0.05),見表2。
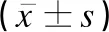
表2 輕度PE組和重度PE組患者一般情況及25(OH)D水平比較
2.3 PE患者25(OH)D水平與血壓、24h尿蛋白定量的相關性分析
PE患者的25(OH)D水平與血壓、24h尿蛋白定量的相關性分析結果顯示:25(OH)D水平與血壓、24h尿蛋白定量均呈顯著負相關關系(r值分別為-0.618、-0.753、-0.624,P<0.05),見表3。

表3 PE患者的25(OH)D水平與血壓、24h尿蛋白定量
2.4 25(OH)D水平對PE預測價值的ROC分析
ROC曲線顯示,25(OH)D水平預測PE的截斷值為24.03μg/L,敏感度為88.0%,特異性為82.0%,曲線下面積(area under the cure,AUC)為0.864,95%CI為0.811~0.916,P<0.05,見圖1。
3討論
3.1孕早期預測PE的價值
PE是臨床上常見的妊娠期并發癥,目前關于PE的發病機制有多種假說,其中兩階段假說較完整地解釋了PE的發生、發展過程,該假說將PE分為臨床前期與臨床期,臨床前期主要是由于遺傳、環境等因素導致胎盤淺著床,但此時孕婦尚無任何臨床表現;臨床期則是因為胎盤血流灌注量下降導致胎盤的缺血缺氧,引起大量胎盤因子釋放進入母體血液循環中,導致孕婦出現炎癥反應、內皮損傷而引起PE的各種臨床癥狀[9-10]。目前臨床上多根據孕婦在孕20周后的臨床表現對PE進行診斷,若能在孕早期進行預測并針對性地采取干預措施將有助于降低PE的發生率。
3.2孕早期25(OH)D水平下降對PE的影響
維生素D是脂溶性維生素的一種,主要以維生素D2、D3的形式存在,維生素D2主要存在于植物體內,維生素D3則主要存在于高級動物中,由皮膚中7-脫羥膽固醇經紫外線照射轉化而來或由食物中獲取[11]。維生素D3本身無活性,經二次羥基化后可產生25(OH)D,多項研究證實25(OH)D在調節鈣磷代謝、骨質礦化方面具有重要的作用,另外25(OH)D還參與免疫調控、細胞增殖等過程[12]。本研究結果顯示觀察組孕婦的25(OH)D水平低于對照組且25(OH)D水平隨著PE嚴重程度的加重而降低,與相關研究結果一致[13]。在妊娠過程中隨著胎兒的生長發育,其對鈣的需求量也明顯增加,可導致母體出現一系列的代償性生理活動以促進母體對食物中鈣離子的吸收并向胎盤轉運,此過程可引起母體中25(OH)D水平下降。正常狀況下,孕早期滋養層細胞胎盤中可通過局部作用及旁分泌作用而儲存25(OH)D,25(OH)D并與維生素D受體結合后作用于血管內皮生長因子(vascular endothelial growth factor,VEGF)啟動子,從而增加血管內皮細胞VEGF的表達。當25(OH)D水平下降時可導致VEGF合成量較少,影響了子宮螺旋動脈的重鑄而引起胎盤淺著床,最終引起PE[14]。
3.3 PE患者25(OH)D水平與血壓、24h尿蛋白定量的相關性
相關性分析結果顯示: PE患者的25(OH)D水平與血壓、24h尿蛋白定量均呈顯著負相關關系(P<0.05)。關于25(OH)D水平對PE患者血壓的影響可能與以下幾方面因素有關[15-16]:①25(OH)D可抑制腎上腺素基因的轉錄,對腎素-血管緊張素系統起負反饋調節作用,當25(OH)D水平下降可使腎素-血管緊張素分泌增加而引起病理性的血壓升高;②25(OH)D水平的大幅度下降還可引起繼發性甲狀腺功能亢進,導致甲狀旁腺激素水平的升高而增強血管平滑肌的緊張性,引起動脈粥樣硬化而升高血壓;③25(OH)D缺乏還與胰島素抵抗及代謝綜合征的發生密切相關,當25(OH)D水平明顯下降時可導致胰島素抵抗增強而引起血壓升高。24h尿蛋白定量是PE患者腎功能損害的檢測指標,關于25(OH)D水平對PE患者24h尿蛋白定量的影響機制可能與25(OH)D可修補Ca2+依賴性K+通道而調節腎素-血管緊張素系統,PE患者的腎損害與局部腎素-血管緊張素系統密切相關。25(OH)D缺乏還可引起腎小管局部血管緊張素Ⅱ水平升高而導致腎間質纖維增生等后續效應,使腎小管的重吸收作用受損[17]。另外,25(OH)D水平下降還可加速動脈粥樣硬化而累及腎臟組織,可引起腎小球前血管結構及功能出現異常而影響其濾過功能,使尿蛋白量升高[18]。
3.4 25(OH)D水平對PE的預測價值
25(OH)D水平預測PE的截斷值為24.03μg/L,敏感度為88.0%,特異性為82.0%,AUC為0.864,95%CI為0.811~0.916(P<0.05),提示孕早期25(OH)D水平預測PE具有較高的敏感性與特異性。25(OH)D對PE的影響除前文闡述的機制外,還可能與以下幾方面原因有關[19-20]:①25(OH)D缺乏一方面可引起氧化應激反應而使血管內皮細胞受累,另外還可通過減少維生素D受體及1-α羥化酶等分子機制,引起血管內皮功能受損,最終導致PE;②25(OH)D還直接或間接地參與細胞增殖、分化,當維生素D受體減少時,25(OH)D調控HOA 10等著床相關靶基因的表達減少,維生素D的免疫抑制作用受限導致細胞移植耐受作用減弱而增加PE發生的風險;③分子遺傳學研究發現維生素D受體基因rs 2228570多態性與PE的發生風險具有較高的相關性,該多態性位點是維生素D受體基因的起始密碼子,此位點發生改變則可引起維生素D受體基因翻譯起始點的改變從而影響其結構的改變,這將影響25(OH)D的正常生物學效應而增加PE的發生風險。
綜上所述,PE患者孕早期25(OH)D水平低于健康產婦,且25(OH)D水平隨著PE程度的增加而降低,PE患者的25(OH)D水平與其血壓、24h尿蛋白定量均呈負相關關系,孕早期25(OH)D預測PE的截斷值為24.03μg/L。

