核磁共振技術對析出型催化劑溶解過程的研究
梁迎迎,李秉毅,茍清強,馬永華
(中國石化 北京化工研究院,北京 100013)
聚烯烴已經成為世界上產量最大的合成材料,而支撐聚烯烴快速發展的核心技術之一是高效催化劑技術,隨著該行業的飛速發展,對催化劑的活性、粒型粒徑、氫調共聚等性能提出了越來越高的要求[1-2]。以往聚烯烴催化劑的研發主要依靠大量實驗積累的經驗來推動,但這種研發模式的效率已經越來越低,進步愈發困難。只有從理論和基礎研究上有所突破,才能更準確地指導改進方向。Ziegler-Natta鈦系催化劑一直是聚烯烴工業用量最大的催化劑[3-6],溶解析出法至今仍是該類催化劑最基礎、最重要的生產方式之一[7-11]。但目前對于原料溶解到催化劑析出過程的研究較少,對溶解析出過程的物理-化學變化也不清楚,這些基礎研究的欠缺制約了此類催化劑綜合性能的進一步提升。NMR技術廣泛應用于有機化合物的結構解析和定性定量分析,是研究化學變化的重要手段[12]。
本工作在前期研究的基礎上[13-15],采用液體NMR技術對環氧氯丙烷(ECP)、磷酸三丁酯(TBP)和乙醇(EtOH)單獨或者共同溶解MgCl2過程中的配位方式和溶解過程進行探索,為深入理解催化劑的溶解析出過程提供了思路和研究方法。
1 實驗部分
1.1 主要原料及儀器
高純液氮:99.999%(φ),液化空氣(北京)有限公司,經凈化裝置凈化處理;MgCl2:工業級,中國石化催化劑北京奧達分公司;TBP:分析純,北京化工廠,經分子篩干燥后使用;ECP:分析純,天津光復精細化工研究院,經分子篩干燥后使用;甲苯、EtOH:分析純,國藥集團化學試劑有限公司,經分子篩干燥后使用;氘代甲苯:美國劍橋公司。
采用Bruker公司AVANCE 300型和Agilent公司400-MR DD2型核磁共振波譜儀進行液體NMR表征。
1.2 實驗方法
按表1所示原料配比制備NMR試樣。直接將原料加入核磁管中混合均勻制備得到1~4號試樣;將原料在試樣瓶中加熱超聲溶解后取上層清液置于核磁管制備得到5~11號試樣;將ECP,TBP,EtOH溶液加入核磁管中記為12-1號試樣,再加入MgCl2反應5 min后取上層清液記為12-2號試樣,或加入MgCl2反應3 h以上取上層清液記為12-3號試樣。原料結構與H編號見圖1。
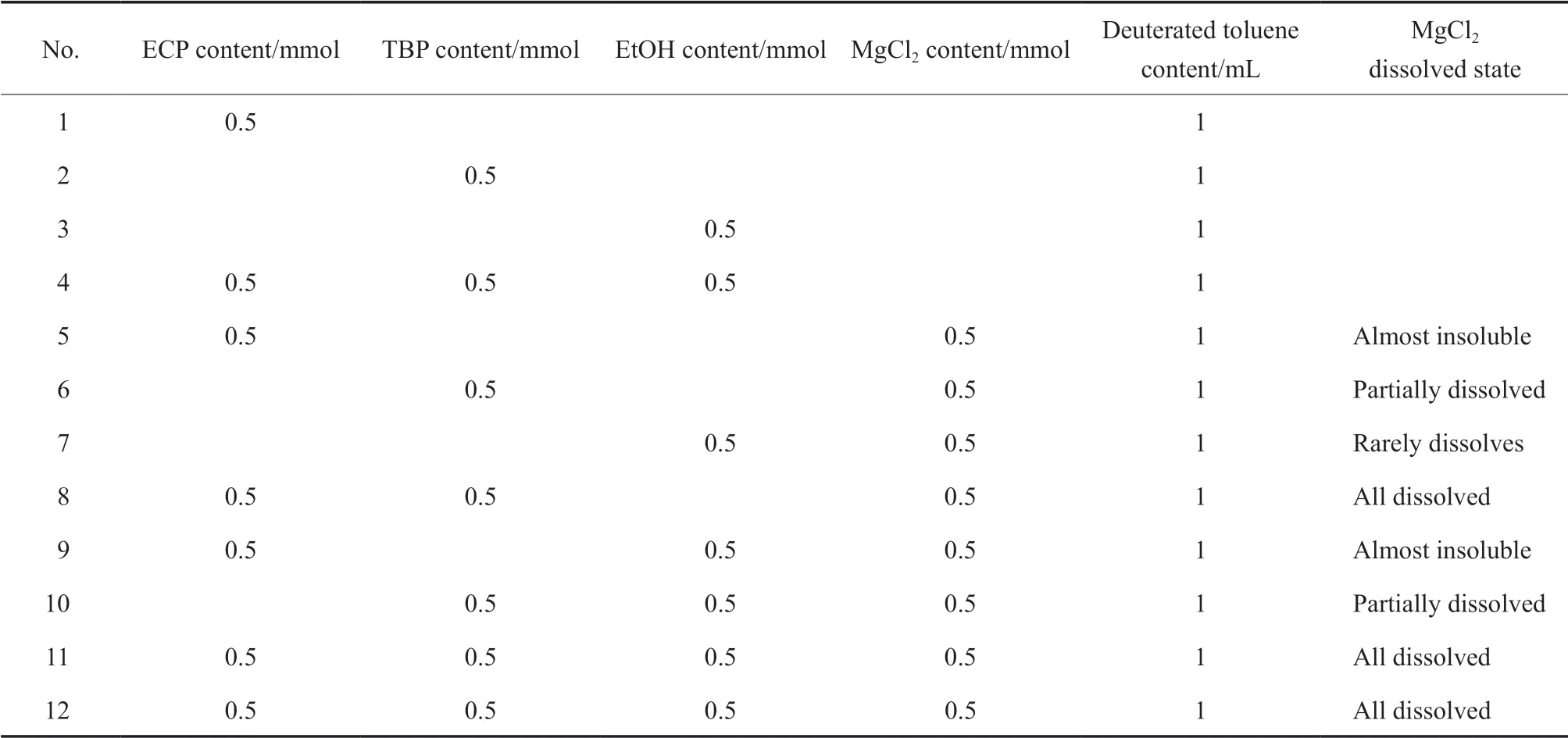
表1 試樣的原料配比Table 1 The ratio of raw materials of the samples
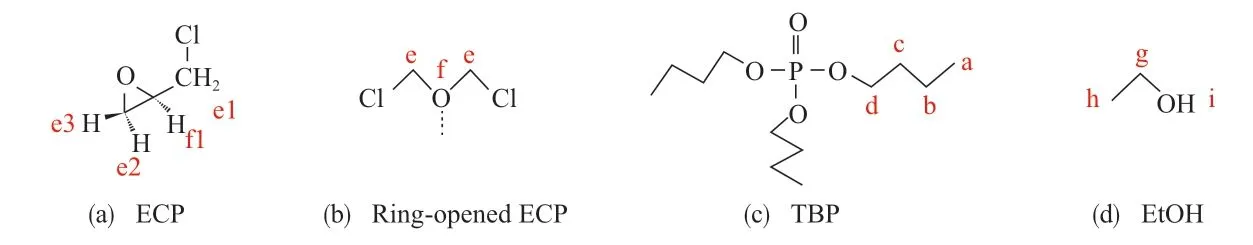
圖1 原料結構與H編號Fig.1 Structure of raw materials and their H atom numbers.
2 結果與討論
2.1 原料的1H NMR表征結果
圖2為幾種原料的1H NMR譜圖。由圖2可知,除了EtOH譜圖存在活潑氫i之外,混合物的特征峰相較于未混合的試樣沒有發生位移,證明這幾種原料之間無相互作用。
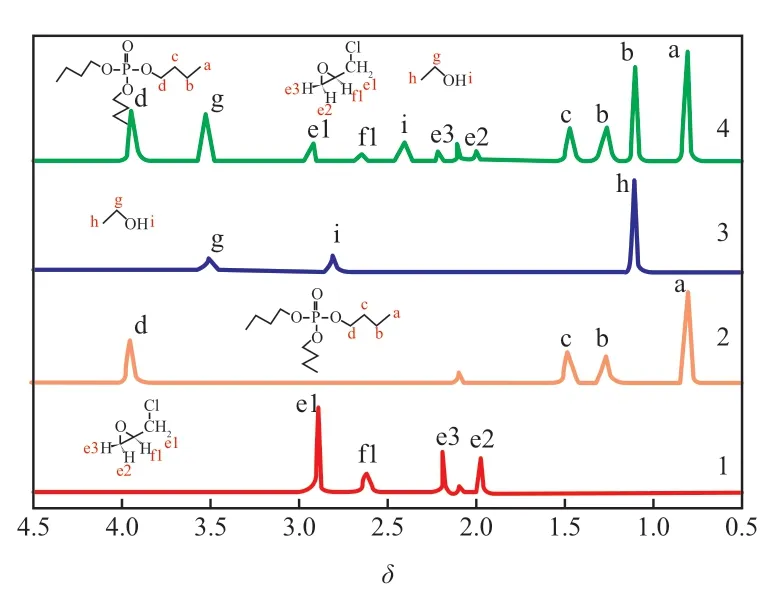
圖2 幾種原料的1H NMR譜圖Fig.2 1H NMR spectra of raw materials.
2.2 試樣的1H NMR表征結果
為了探索ECP,TBP,EtOH溶解MgCl2的過程,制備了5~11共7個試樣。圖3為5,8,9,11號試樣及6,8,10,11號試樣的1H NMR譜圖。圖3a對比了ECP單獨溶解MgCl2(5號試樣)、ECP和TBP共同溶解MgCl2(8號試樣)、ECP和EtOH共同溶解MgCl2(9號試樣)、ECP,TBP,EtOH共同溶解MgCl2(11號試樣)的NMR譜圖。由圖3a可知,5號試樣中觀察不到ECP開環的峰,且MgCl2幾乎不溶解,說明ECP單獨溶解MgCl2比較困難[15];9號試樣也難以觀察到ECP的開環峰,說明ECP與EtOH共同溶解MgCl2的效果也并不理想;8號試樣可完全溶解且能觀察到開環后的ECP峰,其中e峰化學位移是3.96,說明ECP在TBP存在時,可共同作用溶解MgCl2[15-16]。而ECP,TBP,EtOH共同溶解MgCl2時,可看到e峰化學位移向高場移動至3.88,這說明加入EtOH后,ECP的配位狀態發生變化,可能是三者共同與MgCl2配位的結果。圖3b對比了TBP單獨溶解MgCl2(6號試樣)、TBP和ECP共同溶解MgCl2(8號試樣)、TBP和EtOH共同溶解MgCl2(10號試樣)、ECP,TBP,EtOH共同溶解MgCl2(11號試樣)的1H NMR譜圖。由圖3b可知,在含有TBP的情況下,MgCl2均可發生部分甚至全部溶解,TBP的特征峰d在不同試樣中化學位移有明顯變化,未與MgCl2作用時化學位移為3.94,溶解MgCl2后化學位移向低場移動至4.22,說明與MgCl2發生配位作用后溶于甲苯;而10號試樣化學位移與6號試樣基本一致,說明EtOH和TBP共同溶解MgCl2時,可能沒有發生共同配位;而8號試樣中d的化學位移移至4.15,說明TBP+ECP和MgCl2共同作用時,與TBP單獨溶解MgCl2相比,產物結構發生變化;TBP,ECP,EtOH三者共同溶解MgCl2時化學位移是4.17,與8號試樣相比變化不大,但ECP開環后的特征峰在這兩個試樣中的化學位移發生較大變化,這也能進一步說明當ECP,EtOH,TBP共同溶解MgCl2時,可能形成MgCl2-ECP-TBP-EtOH絡合物。由于EtOH含有活潑氫,在不同試樣中化學位移變化較大,而其他特征峰在變化過程中與TBP或者ECP有重疊,不利于分析,所以未對EtOH的化學位移變化進行討論。
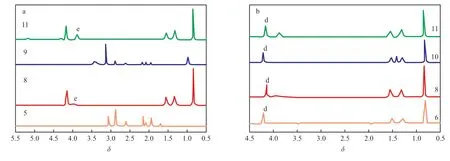
圖3 5,8,9,11號試樣(a)及6,8,10,11號試樣(b)的1H NMR譜圖Fig.3 1H NMR spectra of samples No. 5,8,9,11(a) and samples No. 6,8,10,11(b).
2.3 不同給電子體的配位狀態
圖4為MgCl2與不同給電子體的配位狀態(1~5種)。由圖4可知,在ECP,TBP,EtOH三種給電子體與MgCl2均為等摩爾比的條件下,ECP和EtOH無論是單獨還是共同溶解MgCl2,效果都不理想,這可能是因為兩者分別與MgCl2反應得到的配合物極性端極性太強,非極性端極性弱(圖4中的1,2),導致無法溶解于甲苯中。而TBP與MgCl2等摩爾比時,可部分溶解MgCl2,這是由于TBP具有三條非極性的丁基尾端,非極性特性更強,可將部分MgCl2溶于甲苯中(圖4中的3)。TBP與EtOH共同溶解MgCl2時也是發生部分溶解,而與ECP共同溶解時,MgCl2可完全溶解,這是由于后者可形成ECP,TBP和MgCl2的共同絡合物,使溶解能力增強(圖4中的4)。而與EtOH共同溶解MgCl2時,不會發生共同絡合,所以與TBP單獨和MgCl2作用時一樣,部分溶解。在ECP,TBP,EtOH三種給電子體共同溶解MgCl2時,完全溶解,且ECP和TBP的特征峰的化學位移相較于5,6,8,9,10號試樣的化學位移均不同,可能會形成三者共同與MgCl2配位的化合物從而溶解于甲苯中(圖4中的5)。
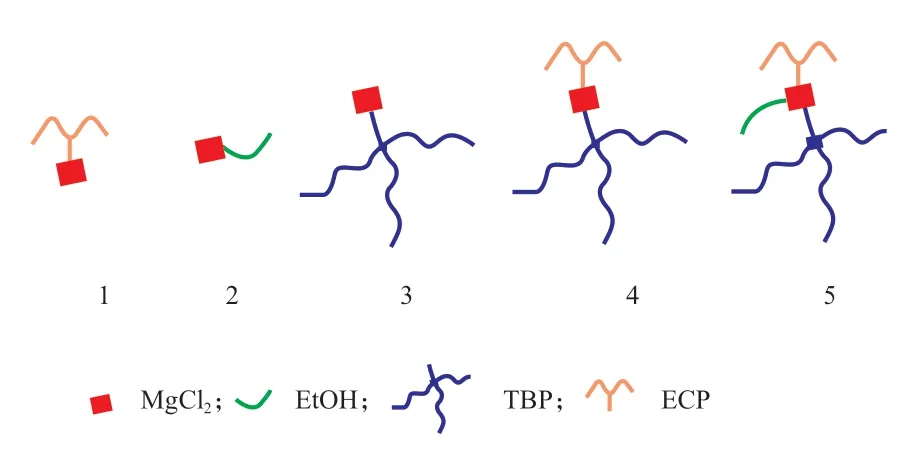
圖4 MgCl2與不同給電子體的配位狀態Fig.4 Coordination states of MgCl2 with different electron donors.
2.4 溶解過程1H NMR譜圖追蹤
圖5為溶解過程1H NMR譜圖追蹤。
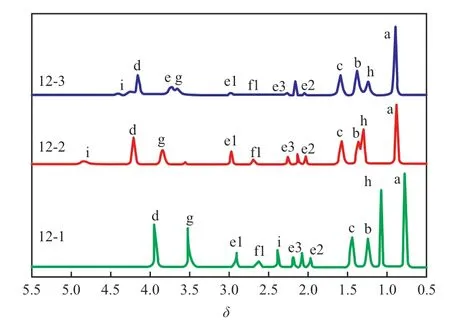
圖5 溶解過程1H NMR譜圖追蹤Fig.5 1H NMR tracking spectra of dissolution process.
由圖5可知,MgCl2剛加入體系(12-2號試樣),與加入前的12-1號試樣對比,EtOH的i峰和TBP的d峰同時移向低場,其中d峰化學位移變為4.22,說明與MgCl2發生強配位作用,這與TBP單獨與MgCl2配位時以及TBP與EtOH共同溶解MgCl2時的化學位移是相同的,而體系中ECP峰的峰強減弱,但未見新的峰出現。反應3 h以上(12-3號試樣),體系原有的ECP特征峰強度明顯減弱,生成了開環后的e和f峰,這時TBP和EtOH的特征峰重新移向高場,其中d峰化學位移變為4.17,這與前面的結果也是相一致的。綜上所述,推測溶解過程為最開始ECP還沒有發生開環或發生開環后由于極性較強還未進入溶液中,而TBP和EtOH可與MgCl2迅速配位,隨著反應進行,逐步形成了三者與MgCl2共同絡合物,完成溶解。
3 結論
1)ECP,TBP,EtOH三種給電子體中的兩種共同存在時,與一種給電子體單獨與MgCl2作用時的配位狀態和溶解情況不同。
2)ECP和EtOH由于非極性較弱難以將MgCl2溶解于甲苯中,而TBP由于較強的雙親性結構特征可與MgCl2配位并部分溶解,且與ECP共同溶解MgCl2時會形成共配位化合物MgCl2-ECP-TBP,從而使MgCl2完全溶解于甲苯中。
3)而三種給電子體共同溶解MgCl2時,通過對溶解過程的追蹤,發現TBP和EtOH會迅速與MgCl2形成配合物,部分溶于甲苯中,ECP只能隨著反應進行才能逐漸開環進入到溶液相中,推測最后形成MgCl2與三者共同配位的絡合物而溶解于溶劑中。

