腫瘤相關巨噬細胞中程序性死亡受體配體1的表達及其與乳腺癌不良預后的關系
楊 菊, 李小靜, 劉秀萍, 2, 楊 珂, 曹 麗, 舒維清
(1. 復旦大學附屬上海市第五人民醫院 病理科, 上海, 200240;2. 復旦大學基礎醫學院 病理學系, 上海, 200032)
乳腺癌是女性最常見的惡性腫瘤,是女性癌癥的第二大死亡原因[1]。腫瘤微環境(TME)是腫瘤研究的熱點,其主要由癌細胞及大量浸潤性巨噬細胞、淋巴細胞等免疫細胞組成[2]。乳腺癌細胞可招募腫瘤相關巨噬細胞(TAMs), 腫瘤組織中高密度的TAMs浸潤與乳腺癌患者的不良預后相關[3]。程序性死亡受體配體1(PD-L1)在乳腺癌中表達的研究較多,但其預后意義尚未完全清楚。原發性乳腺癌中癌細胞PD-L1的表達與高危臨床病理參數和不良預后相關[4]。癌細胞上高表達PD-L1的患者在進行新輔助化療后獲得病理完全緩解的可能性增加,而癌細胞低表達PD-L1的患者具有更好的總體生存率(OS)[5]。乳腺癌中關于PD-L1的研究主要集中于癌細胞或腫瘤浸潤淋巴細胞(TIL)中PD-L1的表達[6]。TAMs是TME中PD-L1表達的主要來源,且TAMs上PD-L1的表達比癌細胞上的更穩定[7]。目前,有關巨噬細胞中PD-L1表達的研究較少。本研究檢測PD-L1在TAMs中的表達及其與臨床病理的相關性,探討其可能的機制,為乳腺癌的治療提供新的理論依據。
1 材料與方法
1.1 生物信息學分析
使用腫瘤微環境單細胞轉錄組學數據庫(TISCH)獲取乳腺癌腫瘤組織單細胞水平轉錄組學信息。79個數據集中的4個數據集預測了TAMs中編碼PD-L1的RNA(命名為CD274)的表達(http://tisch.comp-genomics.org/search-gene/)。 所有參數均設置為默認值。
1.2 患者隊列
本研究由醫院研究倫理委員會批準,并根據方案2019MHZ032進行。收集2014年1月—2019年12月復旦大學附屬上海市第五人民醫院病理科165例浸潤性乳腺癌患者組織及相關臨床病理資料。165例患者中,82例有淋巴結轉移, 83例無淋巴結轉移; 年齡29~88歲,中位年齡59歲。福爾馬林固定的石蠟包埋組織切成4 μm的切片。根據世界衛生組織腫瘤分類標準,由病理醫生進行診斷。
1.3 多色免疫熒光組織染色及抗體
所有組織均用福爾馬林固定,常規技術包埋于石蠟中。組織切片(4 μm)經脫蠟、返水,并在0.1 mol/L檸檬酸鈉(pH 6.0)中進行微波抗原修復,染色前用5%的羊血清封閉20 min。將載玻片上滴加2種抗體[CD68(KP1, ab955, Abcam, 1∶25)]和PD-L1(SP142, CST, 1∶250)的混合物(2種抗體來自不同的種屬),在4 ℃冰箱中孵育過夜;然后在磷酸鹽緩沖液(PBS)中洗滌載玻片,于暗室中與2種二抗的混合物[異硫氰酸熒光素(FITC)或Tesas紅結合]37 ℃溫箱中孵育1 h; 然后將載玻片在PBS中洗滌,并用Hoechst(ab228551, Abcam, 1∶1 000)孵育30 s進行復染,使細胞核著色;然后在自來水中短暫沖洗載玻片,封片。立即使用熒光顯微鏡(蔡司)觀察并拍照。
1.4 免疫熒光染色的評估
熒光顯微鏡低倍鏡下觀察切片中CD68+PD-L1+細胞密集區域,從每個切片中選擇5個高倍視野(放大400倍)計數,取平均值即為該組織切片中PD-L1+TAMs浸潤數量。取PD-L1+TAMs計數的中位數,平均值大于中位數即為PD-L1高表達,否則為低表達。
1.5 患者的生存預后
通過門診或電話定期回訪患者。總生存期定義為患者確診至任何原因導致死亡的時間。隨訪時間截至2021年12月或死亡。OS測量了所有病例的死亡率,用于預后分析。
1.6 細胞培養和試劑
THP-1單核細胞在添加10% 胎牛血清(FBS)(Gibco)和0.05 mmol/L β-聚體(Invitrogen)的RPMI 1640(Invitrogen)中培養。MCF-7和MDA-MB-231細胞在完全RPMI 1640培養基中培養。所有細胞系每2周檢查1次支原體,使用前均為陰性。
佛波酯(PMA)購自Sigma Aldrich。白細胞介素(IL)-4和IL-13購自PeproTech。THP-1單核細胞經100 nmol/L PMA孵育72 h后,在RPMI培養基中孵育24 h分化為巨噬細胞。添加20 ng/mL IL-4和20 ng/mL IL-13孵育獲得M2型巨噬細胞。在共培養實驗中, THP-1單核細胞以100 000個細胞/孔的密度接種在24個Transwell板(康寧)中。巨噬細胞與MCF-7/MDA-MB-231細胞共培養24 h。
1.7 蛋白質印跡(Western blot)
使用Bio-Rad的標準Western blot方案。收集M2型巨噬細胞,提取蛋白,用二喹啉甲酸(BCA)法進行蛋白定量。取30 mg總蛋白/泳道裝入凝膠中。使用抗PD-L1和vinculin(Sigma)的抗體來檢測蛋白質,并用過氧化物酶結合的山羊抗兔二抗(Abcam)孵育。使用ImageJ軟件進行密度分析以量化條帶面積。
1.8 逆轉錄聚合酶鏈式反應(RT-PCR)
RNA提取和實時定量PCR, 使用Trizol試劑提取總RNA,使用SuperScriptTMⅢ First-Strand Synthesis for RT-PCR (Invitrogen, 18080-051)試劑盒合成cDNA,按照說明書使用PerfectStartTMGreen qPCR SuperMix (Tran,AQ601)試劑盒進行RT-PCR。熱循環條件如下: 95 ℃初始激活30 s, 95℃進行40次循環10 s, 60 ℃ 20 s, 72 ℃ 30 s。實驗分復孔進行。以β-actin為參照,使用2-△△Ct方法計算PD-L1基因組轉錄本的相對表達水平,正向和反向引物見表1。

表1 引物序列
1.9 統計學分析
所有分析均使用SPSS 18.0進行。PD-L1表達與患者臨床病理特征之間的相關性采用χ2檢驗或Fisher′s精確檢驗進行評估。Kaplan-Meier方法用于估計OS, 對數秩檢驗用于比較亞組。P<0.05為差異具有統計學意義。
2 結 果
2.1 原發性乳腺癌組織和轉移癌中PD-L1的表達
通過TISCH進行scRNA-seq分析,結果表明,轉移性乳腺癌組織中巨噬細胞PD-L1的表達高于原發性乳腺癌組織,差異有統計學意義(P<0.05), 見圖1。

A、B: 原發性乳腺癌; C、D: 轉移性乳腺癌; E: 原發性乳腺癌(BRCA_GSE114727、BRCA_GSE138536)、轉移性乳腺癌(BRCA_GSE110686、BRCA_GSE143423)圖1 原發性乳腺癌組織和轉移瘤中巨噬細胞PD-L1的表達
2.2 乳腺癌TAMs中PD-L1的表達
在乳腺癌組織樣本的間質和癌細胞中均可觀察到PD-L1和CD68的表達,其表達主要定位于細胞質中,呈顆粒狀(圖2)。為了檢測乳腺癌TAMs(CD68陽性細胞)中PD-L1的表達,從每個切片選取5個高密度區域計算PD-L1+CD68+(圖1中黃色部分所示)細胞的數量, 165例乳腺癌患者的中位數為(19.24±10.01)/高倍視野。為了研究TAM中PD-L1表達與臨床病理特征之間的關系,根據PD-L1+CD68+細胞的中位數將乳腺癌患者分為PD-L1高表達組和PD-L1低表達組(圖2)。
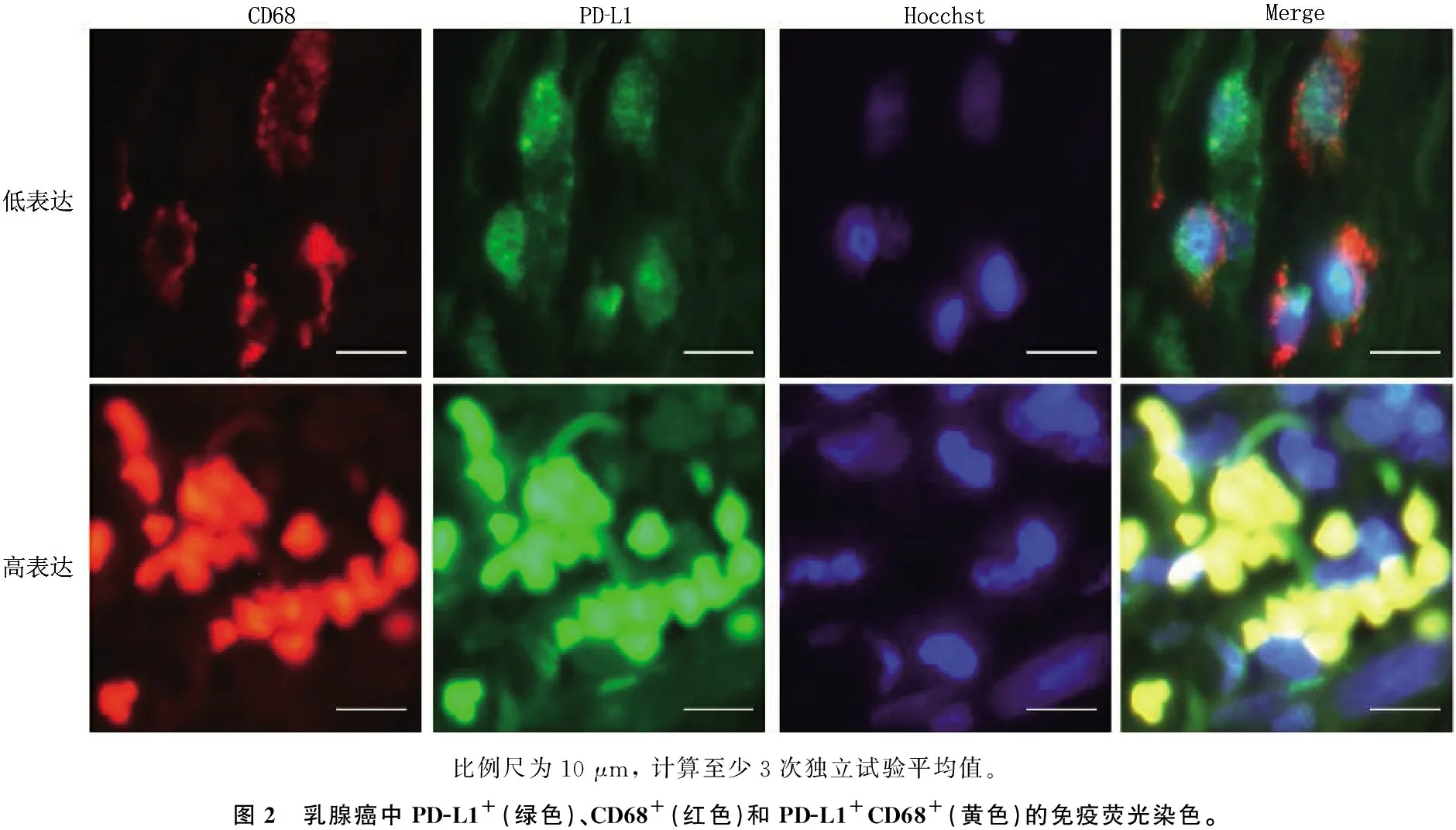
比例尺為10 μm, 計算至少3次獨立試驗平均值。圖2 乳腺癌中PD-L1+(綠色)、CD68+(紅色)和PD-L1+CD68+(黃色)的免疫熒光染色。
2.3 患者的臨床病理特征及其與TAMs中PD-L1表達的相關性
165例乳腺癌患者均為女性, 122例患者年齡≥50歲, 43例年齡<50歲; 72例患者腫瘤≤2 cm, 78例患者腫瘤>2 ~5 cm, 15例患者腫瘤>5 cm。其中83例患者無淋巴結轉移, 43例患者1~3個淋巴結轉移陽性, 20例患者4~9個淋巴結轉移陽性, 19例有≥10個淋巴結轉移陽性。診斷時,6例患者處于Ⅰ期, 62例患者處于Ⅱ期, 97例患者處于Ⅲ期或Ⅳ期。PD-L1+TAMs浸潤密度與組織學分級相關(P<0.05), PD-L1+TAMs浸潤與年齡、腫瘤直徑、淋巴結轉移、分子亞型和遠處轉移無相關性(P>0.05)。見表2。

表2 患者臨床病理特征及其與TAMs中PD-L1表達的關系
2.4 乳腺癌患者PD-L1+TAMs浸潤密度與生存時間呈負相關
隨訪期間12例患者死于乳腺癌,最短生存時間為1個月。采用Kaplan-Meier生存分析, PD-L1+TAMs高表達和低表達患者的平均生存時間分別為88.70和78.58個月。PD-L1+TAMs高表達和低表達患者的生存曲線不同。PD-L1+TAMs的高表達與較差的OS相關(P=0.014)。見圖3。

圖3 TAMs 中PD-L1的表達對乳腺癌預后的影響
2.5 巨噬細胞中PD-L1的表達
通過與PMA、IL-4和IL-13孵育將THP-1單核細胞誘導為M2型巨噬細胞,并檢測其中PD-L1的表達。Western blot結果顯示與MCF-7或MDA-MB-231細胞共培養24 h后, M2型巨噬細胞中PD-L1蛋白表達水平增加(P<0.05或P<0.001)。見圖4。在與MCF-7或MDA-MB-231細胞共同培養的M2型巨噬細胞中,PD-L1mRNA豐度更高(P<0.05或P<0.001), 見圖5。

A: M2型巨噬細胞與MCF-7細胞系共培養24 h; B: M2型巨噬細胞與MDA-MB-231細胞系共培養24 h。與M2型巨噬細胞中PD-L1表達比較, *P<0.05, ***P<0.001。圖4 M2型巨噬細胞中PD-L1的表達。

A: M2型巨噬細胞與MCF-7細胞系共培養24 h; B: M2型巨噬細胞與MDA-MB-231細胞系共培養24 h。與M2型巨噬細胞中PD-L1 mRNA表達比較, *P<0.05, ***P<0.001。圖5 M2型巨噬細胞PD-L1 mRNA表達水平。
3 討 論
乳腺癌是一種嚴重影響女性身心健康的惡性腫瘤,目前主要治療方法為手術切除、局部放療和化療[1]。M2型TAMs與多種癌癥的生長、遷移和侵襲有關。同時, M2型TAMs也可能通過表達免疫檢查點蛋白PD-L1/程序性死亡受體配體2(PD-L2)和CD80/CD86促進免疫監視腫瘤逃逸,使TAMs成為免疫檢查點抑制劑程序性死亡受體-1(PD-1)的直接靶點[8-9]。抑制M2型TAM中IL-10/STAT3/NF-κB信號通路,可阻斷免疫抑制性TME的發展[8]。目前,多種針對腫瘤相關巨噬細胞的治療策略已經被開發[9-13]。
本研究結果顯示,原發性乳腺癌TAMs中PD-L1的表達與組織學分級顯著正相關; 原發性乳腺癌中PD-L1+TAMs的浸潤密度與患者的生存時間呈負相關; 與腫瘤組織TAMs中PD-L1低表達患者相比, PD-L1高表達患者總體生存率更差。TME在腫瘤侵襲和轉移中的作用受到廣泛關注[14]。目前, TME被認為是診斷治療的靶點或預后的生物標志物。在免疫系統中, TAMs是癌癥免疫抑制的主要驅動因素[15]。研究[4]表明,在乳腺癌患者中, TAMs浸潤率高的患者OS較差。
乳腺癌中PD-L1的表達與高TIL水平和存在不良預后因素呈正相關[16]。腫瘤浸潤性免疫細胞中PD-L1陽性表達與較差的OS顯著相關。本研究中, PD-L1+TAMs浸潤數量越多, OS越差。TISCH的scRNA-seq數據顯示,與原發性乳腺癌相比,轉移時巨噬細胞中PD-L1的表達顯著上調。乳腺腫瘤組織PD-L1+TAMs浸潤密度與患者生存時間呈負相關,高密度組的總體生存率顯著降低。提示PD-L1+TAMs的高度浸潤性是乳腺癌免疫逃逸的一個重要因素,這與單細胞分析[17]的結果一致。 巨噬細胞具有顯著可塑性,使其能夠有效地適應環境變化,并改變表型和生理學特性[15]。巨噬細胞的異質性最初被描述為2大類: M1(經典激活)和M2(交替激活),大多數TAMs更傾向于M2型巨噬細胞[18-19]。本研究發現,極化后M2型巨噬細胞中PD-L1的表達顯著高于THP-1單核細胞。本研究將M2型巨噬細胞與乳腺癌細胞系MCF-7或MDA-MB-231共培養24 h, TAMs中PD-L1mRNA及PD-L1蛋白表達水平增高。相關研究[20-21]顯示, 4T1細胞共培養后,巨噬細胞PD-L1水平增加; 口腔鱗狀細胞癌患者的原代腫瘤細胞可通過IL-10刺激單核細胞上的PD-L1表達,與本研究結果一致。既往研究[6]表明, PD-L1表達主要通過I型和II型干擾素信號途徑調節。一項研究[22]表明,TNF-α是一種細胞因子,可導致單核細胞PD-L1表達上調。TAMs中PD-L1表達的調節方式可能與腫瘤細胞自身不同。故PD-L1的表達是TAMs的一個重要特征,其調控理論有待進一步探討。
綜上所述,乳腺癌組織TAMs中PD-L1的表達是相關不良臨床結果的獨立預后因素。TAMs中PD-L1陽性表達與組織學分級和不良預后顯著正相關,可能在腫瘤進展中起重要作用。靶向TAMs中的PD-L1可能為乳腺癌治療提供一種新的治療方法。但本研究存在一定局限性,本研究未明確調節TAMs中PD-L1表達的潛在信號通路,其次僅探討了M2型TAMs中PD-L1的表達,以及未證實TAMs中PD-L1的表達在抗PD1/PD-L1治療中的預測價值,仍需進一步研究闡明。

