青稞轉錄因子HvnANT1基因的克隆與表達分析
陳 林 姚曉華* 蘇樂平,4 姚有華 魏 嬋 吳昆侖
(1.青海大學 農林科學院,西寧 810016; 2.國家麥類改良中心青海青稞分中心,西寧 810016; 3.青海省青稞遺傳育種重點實驗室,西寧 810016; 4. 延安市農業科學研究所,陜西 延安 716000)
青稞(Hordeum
vulgare
L. var.nudum
Hook. f.)屬于禾本科大麥屬,也稱為裸大麥或米大麥(一些地區稱為元麥)。青稞因具有抗逆性強和適應性廣的特點,因此能適應高寒地區的環境。它還是青藏高原重要的糧食、經濟和飼料作物,距今已有約3 500年的種植歷史。青稞的生產直接影響著藏區的糧食安全和經濟發展。大麥籽粒顏色分為黑、紫和藍色等,大麥顏色的差異主要是由花青素的積累引起的。花青素在植物中廣泛存在,是一類水溶性色素,屬于黃酮類次生代謝產物。有研究表明,花青素在籽粒的糊粉層積累,形成藍粒大麥;在籽粒的穎和穎片中積累會形成黑、紅和紫粒大麥。大麥籽粒中含有纖維、酚酸、黃酮類和植物甾醇等30多種功能成分,能輔助糖尿病、癌癥、降低膽固醇治療和預防心血管疾病的等功效,可防治20多種慢性病,大麥籽粒中的15種功能成分可預防11種慢性病。β-葡聚糖是具有降膽固醇、降血脂、抗腫瘤和預防心血管疾病的多糖,西藏青稞品種‘藏青25’中β-葡聚糖的含量高達8.62%。青稞中的維生素E具有抗氧化和抗癌等生理功能,黑青稞中B族維生素豐富,有助于維持人體的正常代謝活動。因此,大麥作為功能性食品而受到學者們地廣泛關注。
已有研究表明,ANT1
基因是屬于花青素合成通路中R2R3-MYB家族的轉錄因子,是MBW調控復合體中的一部分。ANT1
在植物生長發育和花器官發生中發揮著重要作用,Liu等研究認為玉米ANT1
能通過靶基因調控細胞增殖和葉片生長、維管和葉脈發育、葉綠體發育和光合作用。Shoeva等研究認為大麥ANT1
的啟動子區域含有與光、生物、非生物逆境脅迫因子、植物激素相關的順式調控元件和控制植物生長、發育及組織分化的一系列信號識別的元件。目前,關于大麥(青稞)粒色方面的研究主要集中在含量測定和基因定位等方面,尚未見花青素合成調控機制的研究報道。目前,青稞紫粒基因定位的7H候選區段內獲得1個MYB類轉錄因子ANT1
,但并未進行該基因的克隆及表達研究。本研究以紫粒青稞品種‘涅如姆扎’和白粒青稞品種‘昆侖10號’為試驗材料,從中克隆了該基因,并對其序列進行相關的生物信息學分析、亞細胞定位分析及HvnANT1
基因與花青素合成相關結構基因HvnCHI
、HvnANS
、HvnDFR
在不同生育階段的表達模式分析,旨在探究HvnANT1
基因在青稞粒色形成過程中的基因表達模式,以期為揭示青稞紫粒形成的機制奠定基礎。1 材料與方法
1.1 材料
供試青稞品種為‘涅如姆扎’和‘昆侖10號’由青海大學農林科學院作物栽培與育種研究所青稞研究室提供。2020年4月栽植于青海大學農林科學院試驗田,根據Zadoks等對谷物生長階段的分類,在籽粒著色不同時期:乳熟早期(播種后11周)、乳熟晚期(播種后13周)和軟面團期(播種后15周)取籽粒種皮,每樣品3次生物學重復。在液氮中進行速凍后于-80 ℃保存。
1.2 青稞HvnANT1基因的克隆
利用簡化基因組GBS(Genotyping-by-Sequencing)對青稞紫粒進行基因定位,在7H染色體上84.30—86.00 cM候選區段內獲得1個MYB類轉錄因子HvnANT1
(Gene ID: MLOC_6171)。利用Primer 5.0設計該基因引物(表1)。取‘涅如姆扎’和‘昆侖10號’的籽粒種皮,按照植物提取RNA試劑盒(TaKaRa MiniBEST Plant RNA Extraction Kit)提取青稞籽粒種皮的總RNA,用超微量核酸蛋白測量儀(Nano Photometer)測定RNA的濃度和純度,用1.0%瓊脂糖凝膠電泳檢測其質量。參照cDNA合成試劑盒(PrimeScript 1 st Strand cDNA Synthesis Kit)反轉錄成cDNA,-80 ℃保存。以青稞種皮的cDNA為模板進行PCR擴增。PCR擴增體系及瓊脂糖凝膠電泳檢測結果參考姚曉華等的方法。目的條帶用柱式DNA膠回收試劑盒(DNA Gel Extraction Kit)回收,用超微量核酸蛋白測量儀(NanoPhotometer)測定回收產物的濃度和純度,與全式金生物公司的亞克隆載體連接,轉化至大腸桿菌,送至上海生物工程股份有限公司測序。
1.3 青稞HvtANT1基因生物信息學分析
HvnANT1蛋白的蛋白質理化性質用Expasy Protparma(http:∥www.expasy.org/tools/protparam.html)和Protscale(https:∥web.expasy.org/protscale/)進行預測。HvnANT1蛋白的信號肽和跨膜結構分別用SignalP4.1(http:∥www.Detaibio.com/tools/signal-peptide.html)和TMHMM-2.0(http:∥www.cbs.dtu. dk/services/TMHMM-2.0/)進行預測。用SMART(http:∥smart.embl-heidelberg.de/)預測結構域。HvnANT1蛋白的二級結構和三級結構運用SPOMA(https:∥npsaprabi.ibcp.fr/cgibin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和SWISS-MODEL(https:∥swissmodel.expasy.org/)分別預測。在NCBI的Blastp功能中,查詢與HvnANT1蛋白同源植株的ANT1蛋白序列,DNAMAN 6.0軟件進行多序列比對,用Mega 7.0軟件的Maximum Likelihood法構建系統進化樹。
1.4 亞細胞定位
采用pBI221-GFP載體用于亞細胞定位研究,設計帶有Xba
Ⅰ和Kpn
Ⅰ酶切位點的正向引物與反向引物,采用高保真酶KOD-FX擴增HvnANT1
基因,構建C端與GFP融合的表達載體。PCR擴增體系與HvnANT1
基因克隆時體系相同。PCR產物和PBI221-GFP載體質粒經Kpn
I 和Xba
I雙酶切后,T連接酶連接混合后的產物并將其轉入大腸桿菌DH5α
感受態中,篩選陽性克隆及測序驗證。將青稞種子在30 ℃黑暗萌發15 d取葉片切成碎段(<0.5 mm),總量5~10 g,用于原生質體制備,具體操作步驟參考李彥華等方法。1.5 青稞HvnANT1基因表達模式分析
根據擴增獲得的HvnANT1
基因序列和大麥參考基因組(ftp: ∥ ftp.gramene.org/pub/gramene/release-63/fasta/hordeum_vulgare/dna/)的HvnCHI
、HvnANS
、HvnDFR
基因序列(https: ∥ www.gramene.org/),用Primer 5.0軟件設計HvnANT1
、HvnCHI
、HvnANS
和HvnDFR
的qRT-PCR引物(表1)。以‘涅如姆扎’和‘昆侖10號’的乳熟早期、乳熟晚期和軟面團期的籽粒種皮cDNA為模板,18SrRNA
作為內參基因(表1),采用TB Greenpremix ExTaq Ⅱ (TaKaRa公司)熒光染料利用Light Cycler 480 System進行qRT-PCR。反應體系參考蘇樂平的方法。用2法計算各基因的相對表達量,應用SPSS 25.0軟件進行顯著性檢測。表1 本試驗用到的引物序列
Table 1 Primers used in this study
引物名稱Primer name引物序列(5'→3')Primer sequence (5'→3')用途PurposeHvnANT1-1F: ATGGGGAGGAGGGCR: CGCAACGTACGGG基因克隆GenecloneHvnANT1-2F: AACAGCACGCTCGGCAGGAAR: AAGAAGAGGCCGCCAGTGCAqRT-PCR引物qRT-PCR primerHvnCHI F: GAACCACGATAAAACGCCCGR: AACGGAATGCCCTCCACTTCqRT-PCR引物qRT-PCR primerHvnANSF: GTATCTGCGAGCCAGACGATR: GTGCGCTATCCAGAAGACGGqRT-PCR引物qRT-PCR primerHvnDFRF: CCGTTCATCGAGCCATTGTCR: AGACGTAGTCGCCGTAAACCqRT-PCR引物qRT-PCR primerHvnANT1-GFPF: CGGCTACCACATCCAAGGAAR: CGGGTACCCACCGGCCATGTGCAGGGAC亞細胞定位載體Subcellular localization vector18SrRNAF: CGGCTACCACATCCAAGGAAR: GCTGGAATTACCGCGGCT內參引物Control primer
2 結果與分析
2.1 青稞HvnANT1基因的克隆及序列分析
以‘涅如姆扎’和‘昆侖10號’種皮反轉錄cDNA為模板,用表1中HvnANT1-1
(Geneclone)為引物,擴增得到1條1 033 bp的目的條帶(圖1(a))。經測序后用DNAMAN 6.0分析表明,該基因完整開放閱讀框(ORF)為762 bp,編碼253個氨基酸。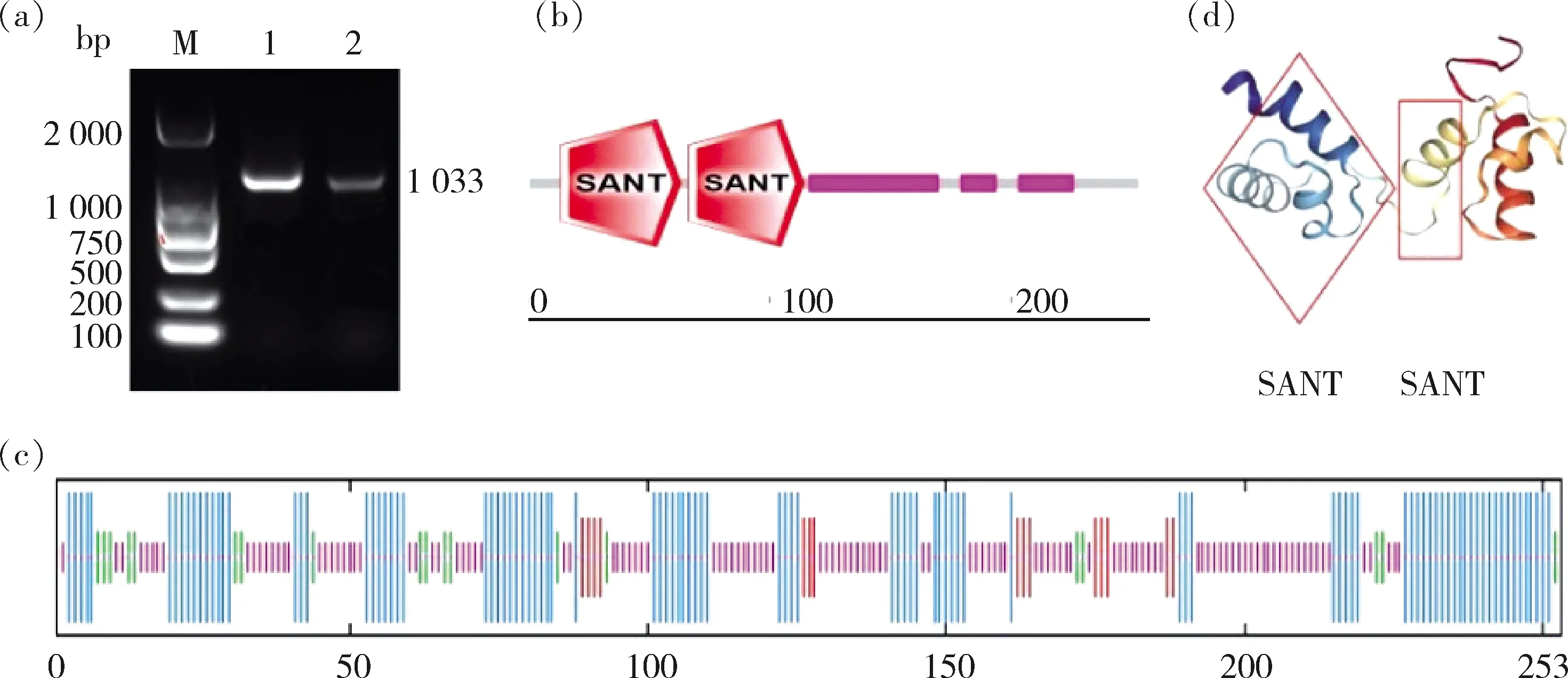
(a)HvnANT1基因擴增產物;(b)HvnANT蛋白結構域預測;(c)HvnANT蛋白二級結構預測圖;(d)HvnANT蛋白三級結構的預測M,ML2000;1,青稞品種涅如姆扎PCR產物;2,青稞品種昆侖10號PCR產物;藍色表示α-螺旋;紅色表示延伸鏈;綠色表示β-轉角;橙色表示無規則卷曲。(a) PCR amplified product of HvnANT1; (b) Domain prediction of HvnANT1 protein; (c) Secondary structure prediction of HvnANT1; (d) Teritary structure prediction of HvnANT1M, DL2 000; 1, PCR product of Nierumuzha; 2, PCR product of Kunlun10; Blue color, α-helix; Red color, extended chain; Green color, β- turn; Orange color, randon coil.圖1 HvnANT1基因的PCR擴增產物及序列預測Fig.1 PCR amplification products and sequence prediction of HvnANT1 gene
測序后比對,‘涅如姆扎’和‘昆侖10號’的ORF區堿基序列和氨基酸序列一致性為100%,啟動子序列比對結果為82.77%。利用SMART對其氨基酸序列進行保守結構域預測,發現該基因具有2個典型的SANT結構域,分別位于第13—第63個和第66—第114個氨基酸(圖1(b))。
HvnANT1蛋白分子式為CHNOS,分子量為27.14 kU,不穩定指數為71.53,脂溶系數是69.21,pI 9.32,其中負電荷殘基(Asp+Glu)為27個,正電荷殘基(Asp+Glu)為35個。平均疏水性為-0.464。預測結果表明,HvnANT1蛋白是一個親水性的不穩定堿性蛋白。HvnANT1蛋白跨膜結構與信號肽預測結果表明,該蛋白不存在跨膜結構,且無信號肽。
通過對HvnANT1蛋白的二級結構與三級結構進行預測,結果表明,HvnANT1蛋白的二級結構是由無規卷曲、α-螺旋、延伸鏈、β-轉角組成,其中無規卷曲占47.04%,α-螺旋39.13%,延伸鏈5.93%,β-轉角7.91%,可見該蛋白是以無規則卷曲和α-螺旋為主,這兩個結構在蛋白行使功能時可能發揮重要作用(圖1(c))。HvnANT1蛋白的三維結構預測結果表明,HvnANT1蛋白的功能結構域為‘V’形(圖1(d))。Uniprot基因注釋結果表明該蛋白為HvnANT1。
2.2 HvnANT1蛋白的同源比較及進化樹分析
由圖2可知,青稞HvnANT1蛋白與大麥(Hordeum
vulgare
)、烏拉爾圖小麥(Triticum
turgidum
)、高粱(Sorghum
bicolor
)、玉米(Zea
mays
L
)、二型花(Dichanthelium
oligosanthes
)、小米(Setaria
italica
)、水稻(Oryza
rufipogon
)、土瓶草(Cephalotus
follicularis
)、車軸草(Trifolium
affine
)和楊梅(Morella
rubra
)10種植物的ANT1蛋白序列相似性分別為100.00%、88.85%、54.64%、60.95%、60.82%、58.46%、57.61%、37.76%、36.05% 和36.33%,這些序列都具有2個高度保守的SANT結構域。由圖3可知,在7種禾本科植物中,青稞HvnANT1蛋白與大麥的親緣關系最近,與水稻的親緣關系較遠。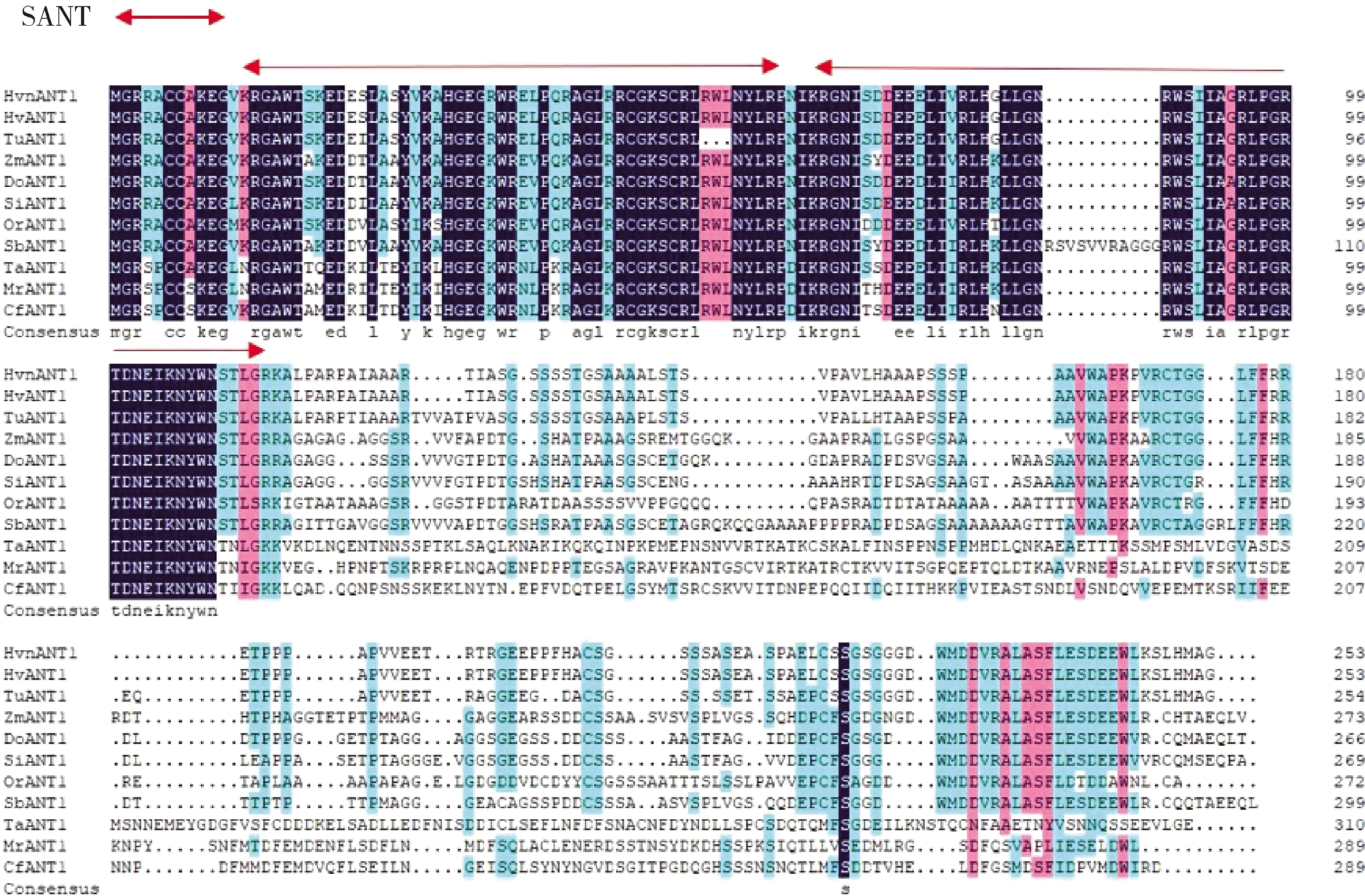
Hvn,青稞;Hv,大麥;Tu,烏拉爾小麥;Zm,玉米;Do,二型花;Si,小米;Or,水稻;Sb,高粱;Ta,車軸草;Mr,楊梅;Cf,土瓶草。紅色箭頭之間代表HvnANT1蛋白的SANT保守功能域。Hvn, Hordeum vulgare; Hv, Hordeum vulgare; Tu, Triticum urart; Zm, Zea mays; Do, Dichanthelium oligosanthes; Si, Setaria italica; Or, Oryza rufipogon; Sb, Sorghum bicolor; Ta, Trifolium affine; Mr, Morella rubra; Cf, Cephalotus follicularis. The red arrows represent the SANT conserved functional domain of HvnANT1 protein.圖2 HvnANT1與其他植物ANT1蛋白氨基酸序列的多重比對Fig.2 Multiple alignment of amino acids sequences of HvnANT1 and ANT1 proteins from other plants
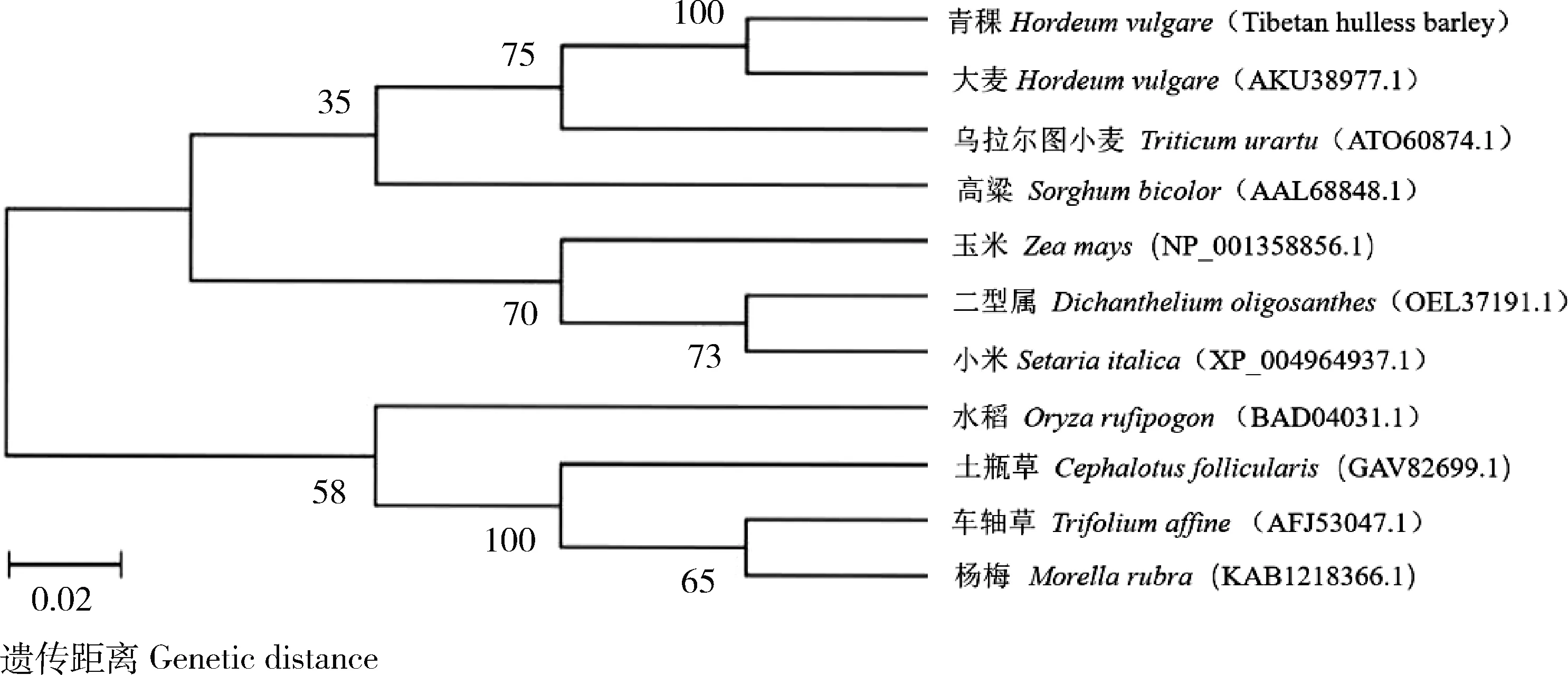
圖3 HvnANT1蛋白與其他植物系統進化樹Fig.3 Phylogenetic tree analysis of the HvnANT1 protein and other plants
2.3 HvnANT1亞細胞定位
由圖4可知,HvnANT1-GFP融合蛋白在細胞核中有較強的綠色熒光信號,說明青稞HvnANT1蛋白定位于細胞核中。
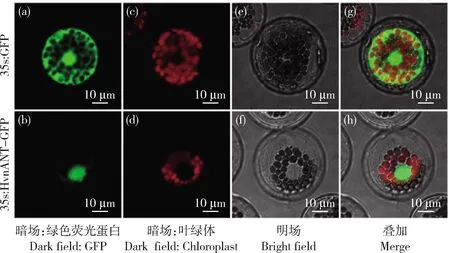
激光共聚焦顯微鏡的激發波長的設置為:GFP 448 nm(綠色);葉綠體400 nm(紅色)。The excitation wavelength of the confocal laser microscope: Chloroplaste ia set as GFP 448 nm (green), chloroplasts 400 nm (red).圖4 HvnANT1亞細胞定位Fig.4 Subcellular location of HvnANT1
2.4 HvnANT1基因表達分析
由圖5可知,在青稞籽粒顏色形成的乳熟早期、乳熟晚期和軟面團期,‘涅如姆扎’的HvnANT1
基因的表達量逐漸升高,乳熟晚期表達量為乳熟早期的5.76倍,軟面團期表達量為乳熟晚期的6.96倍;而‘昆侖10號’3個時期HvnANT1
表達量差異均不顯著;且軟面團期‘涅如姆扎’籽粒HvnANT1
基因的表達量極顯著高于‘昆侖10號’(P
<0.01)。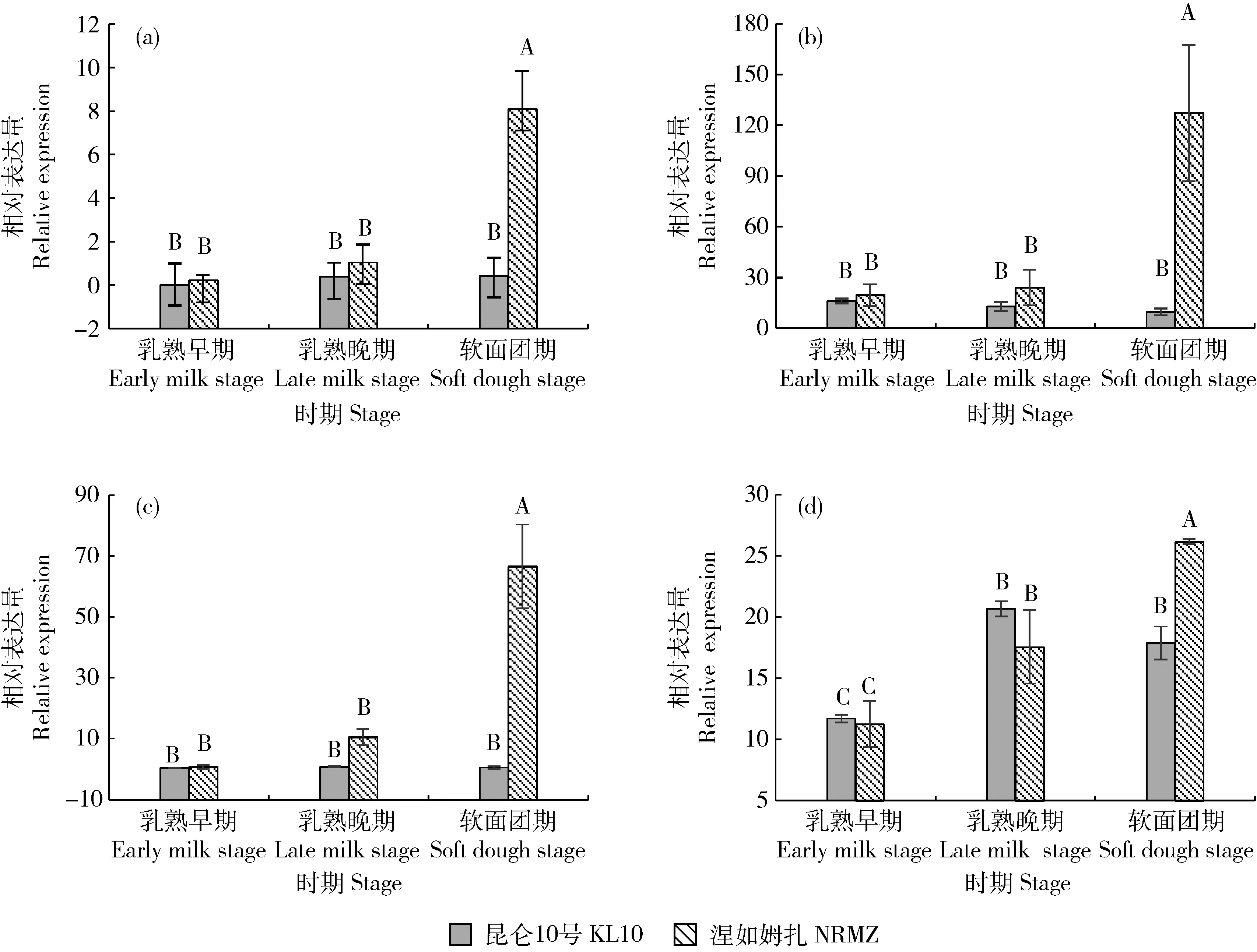
不同大寫字母表示差異極顯著(P<0.01)。Different capital letters are extremely significantly different at P<0.01.圖5 HvnANT1(a)、HvnCHI(b)、HvnANS(c)和HvnDFR(d)在不同青稞品種乳熟早期、乳熟晚期和軟面團期的表達量Fig.5 Expression of HvnANT1 (a), HvnCHI (b), HvnANS (c) and HvnDFR (d) in the early milk, late milk and soft dough of different hulless barley varieties
HvnCHI
和HvnANS
與HvnANT1
表達量趨勢一致(圖5(b)和(c));HvnDFR
基因在‘涅如姆扎’的乳熟早期、乳熟晚期的表達量均低于‘昆侖10號’但差異不顯著;但在軟面團期,高于‘昆侖10號’且具有極顯著差異(P
<0.01),與乳熟早期和乳熟晚期相反。3 討 論
花青素廣泛的存在于植物中,是一種黃酮類化合物,通過普遍存在的次生代謝途徑合成。常見的花青素有天竺葵素(pelargonidin)、矢車菊素(cyanidin)、飛燕草素(delphinidin)、芍藥素(peonidin)、矮牽牛素(petunidin)和錦葵素(malvidin)。花青素作為天然色素而具有很強的藥用價值,例如抗氧化性、抑制氧化應激和神經炎癥、預防心血管疾病、抗腫瘤、抗糖尿病和抗癌等作用。MBW(MYB-bHLH-WD40)復合物在花青素生物合成途徑中發揮重要的作用,MYB、bHLH和WD40三類轉錄因子常通過形成三元復合體來發揮功能。其中MYB基因在植物界中是最大的轉錄因子家族之一,也是植物花青素合成途徑中最廣泛的調節因子。本研究中的HvnANT1
基因即屬于MYB家族,因此,探究該基因對青稞花青素的合成有著重要的意義。擬南芥ANT
基因家族相關研究較多,與生長發育有著密不可分的關系,ANT
是AP2/EREBP轉錄因子家族的成員,含有2個高度保守的AP2結構域,在調節胚珠、胚珠發育和花器官生長中起著關鍵作用。在擬南芥中,ANT蛋白屬于AP2相關基因家族,對胚珠發育至關重要。大麥ANT1
是玉米C1
基因的同源物,C1
基因是編碼R2R3-MYB轉錄因子家族的一個成員,在大麥中ANT1
基因(或稱為Rs
)被定位在7H染色體短臂的著絲粒區域內。本研究中,青稞HvnANT1和大麥ANT1蛋白相似性為100%(圖2)。系統進化樹也表明,兩者遺傳距離最近。Zakhrabekova等研究表明,大麥ANT1
是一個MYB家族的轉錄因子,與高粱Sb10g006700相似,可能具有編碼花青素C1/MYB轉錄因子的功能。因此推測青稞HvnANT1
也具有類似的功能。HvnANT1蛋白結構域預測結果顯示該蛋白含有2個高度保守的SANT結構域。Aasland等研究表明,SANT結構域與MYB相關蛋白的DNA結合結構域相似性很高。通過亞細胞定位分析,HvnANT1
基因定位在細胞核中,這與暴志茹在二球懸鈴木(Platanus
acerifolia
)中的研究結果一致,符合轉錄因子的特性。因此推測在花青素合成過程中,轉錄因子HvnANT1在細胞核內發揮重要作用。已有研究表明,ANT1
基因在花青素合成的途徑中起關鍵作用,Jende等與Franckowiak等研究認為ANT1
突變后在大麥的莖、葉耳、芒、外稃或基生葉鞘中花青素均不再累積,ANT1
基因可決定大麥葉鞘的花青素色素沉著;ANT
1是玉米C1
基因的同源物,是花青素合成調控網絡的重要組成部分,Zakhrabekova等研究表明,對無花色素苷1(ert-m ant1)雙突變體表型觀察可知,ANT
1基因產物參與花青素的生物合成;等研究表明,番茄中過量表達ANT1
基因,會使花青素大量積累導致植株變為紫色。本研究認為紫粒青稞品種‘涅如姆扎’隨種皮顏色的加深,HvnANT1
基因表達量顯著升高;且在青稞籽粒顏色形成的過程中,尤其是軟面團期紫粒種皮的HvnANT
1表達量極顯著高于白粒品種種皮中的表達量;與花青素合成相關的3個結構基因HvnANS
、HvnDFR
和HvnCHS
的表達量也具有類似的結果(圖5)。已有研究表明,CHI
、F3
′H
、DFR
和ANS
這4個基因的轉錄依賴于ANT1
的等位基因狀態。本研究發現HvnCHI
和HvnANS
表達量與HvnANT1
趨勢一致。推測,HvnANT1
基因在紫粒青稞‘涅如姆扎’粒色形成過程中對花青素合成關鍵基因HvnANS
、HvnDFR
和HvnCHI
存在調控的作用。Nakatsuka等研究結果表明,DFR
基因的表達量在被片、花藥、花絲、雌蕊和紅色的鱗片中隨著花的生長發育而增加,因此認為該基因僅在花色素苷著色的器官中表達,并且此種基因的表達量與花色素苷的含量呈正相關。本研究中,乳熟早期和乳熟晚期HvnDFR
基因在‘昆侖10號’和‘涅如姆扎’中均有顯著表達,但差異不顯著,這可能是由于DFR
基因不僅是催化生成不穩定花色素苷的限速酶,而且還是單寧和蘆丁等次生代謝途徑中的關鍵酶。由此推測DFR
基因參與了單寧和蘆丁等次生代謝物的合成,但具體調控過程尚需進一步驗證。4 結 論
綜上所述,本研究從簡化基因組GBS中對青稞紫粒花青素合成相關基因定位,在7H染色體的84.30—86.00 cM中定位到HvnANT1
基因,分別在‘昆侖10號’和‘涅如姆扎’中克隆到該基因。生物信息學分析發現,青稞HvnANT1
完整開放閱讀框為762 bp,編碼253個氨基酸,屬于MYB家族,定位于細胞核。熒光定量PCR檢測結果顯示,在乳熟晚期青稞HvnANT1
、HvnANS
、HvnDFR
和HvnCHI
基因在‘涅如姆扎’中的表達量均顯著高于‘昆侖10號’。
