基底節區擴大血管周圍間隙患者血清炎癥因子的變化及臨床意義
郝光 史永興 常 青 王 剛 薛 茜 鄒玉安
1.河北北方學院附屬第一醫院神經內科,河北張家口 075000;2.河北北方學院附屬第一醫院病案管理科,河北張家口 075000
血管周圍間隙(perivascular space,PVS)是指包繞血管并沿血管走行的間隙,其存在于腦組織和血管間,一般小于1~2 mm。以往PVS 僅限于解剖學領域研究,但隨著磁共振成像(magnetic resonance imaging,MRI)發展,現今常規MRI 可清晰顯示PVS[1-2],尤其是擴大PVS(enlarged perivascular space,EPVS)。EPVS常見于基底節區,有研究表明,基底節區EPVS 與腦小血管疾病關系密切,而腦血管疾病與炎癥密切相關[3-5]。基底節區恰好是腔隙性腦梗死、軟化灶等病變的好發部位,這從側面提示基底節區大量EPVS 可能與炎癥存在聯系。白細胞介素(interleukin,IL)-1、IL-6、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)及C 反應蛋白(C-reactive protein,CRP)是常用血清炎癥因子,可反映機體炎癥情況。了解基底節區大量EPVS 患者的血清炎癥因子變化,可能對闡明其免疫機制具指導作用。本研究通過分析基底節區EPVS 患者血清炎癥因子的變化情況及其臨床價值,以為EPVS 的臨床研究提供參考。
1 資料與方法
1.1 一般資料
選取2018 年3 月至2019 年3 月在河北北方學院附屬第一醫院(以下簡稱“我院”)神經科就診并經頭顱MRI 檢查發現有EPVS 的60 例患者作為EPVS組。納入標準:①年齡>18 歲;②完善頭顱MRI 檢查。排除標準:①合并糖尿病、高血壓、腦腫瘤;②嚴重腦積水、蛛網膜下腔出血、顱內感染、多發性硬化;③存在頸動脈和顱內動脈狹窄介入史、顱內手術史;④顱外創傷史。EPVS 組中男41 例,女19 例;年齡18~69 歲,平均(59.68±7.15)歲。另選擇我院同期體檢健康者30 名作為對照組,其中男22 名,女8 名;年齡18~68 歲,平均(57.12±6.97)歲。兩組性別、年齡比較,差異無統計學意義(P >0.05),具有可比性。本研究已獲得我院醫學倫理委員會批準同意。
1.2 研究方法
1.2.1 炎癥因子 抽取兩組檢查當日的外周靜脈血5 ml,將收集到的標本進行離心處理(3000 r/min 離心10 min,離心半徑13.5 cm),分離得到清液后,采用酶聯免疫吸附試驗檢測血清中的IL-1、IL-6、TNF-α、CRP 水平。具體操作:首先吸去酶標板內的液體,清洗液洗滌3 次,加入樣品或100 μl,1 孔只加稀釋液作為對照;37℃反應90 min,用棄去酶標板內的液體,清洗液清洗2 次,加入生物素化人ANG 抗體工作液各100 μl,37℃反應60 min;清洗液清洗3 次,加入100 μl ABC 工作液,37℃反應30 min;洗滌5 次,加入顯色液,震蕩混勻,避光孵育20 min,加入終止液,終止反應,在30 min 內使用酶標儀在450 nm 波長下測量各孔的吸光度值,根據吸光度值計算血清IL-1、IL-6、TNF-α、CRP 表達水平,每個標本均重復3 次,取平均值。
1.2.2 頭顱MRI 使用GE1.5T MRI 儀,掃描序列包括軸 位T1WI、T2WI 序列、T2Flair、DWI 序列,矢狀位T1WI。層厚5 mm,間隔1.5 mm,矩陣192×256 為空間分辨率,20~24 cm 為視野,激勵次數為2 次。
1.2.3 EPVS 分級 基底節區大量擴大血管周圍間隙定義:基底節區EPVS 數目過多無法統計或超過40 個以上,在頭顱MRI 顯示基底節區形成“篩孔”樣改變,即表示為大量EPVS。參照文獻[3]進行EPVS 分級,即1 級為EPVS 直徑<2 mm;2 級為EPVS 直徑2~3 mm;3 級為EPVS 直徑>3 mm。
1.3 觀察指標
觀察EPVS 組和對照組的血清IL-1、IL-6、TNF-α、CRP 水平差異。觀察基底節區不同EPVS 分級的血清IL-1、IL-6、TNF-α、CRP 表達差異。分析血清IL-1、IL-6、TNF-α、CRP 指標診斷基底節區EPVS 的診斷價值。
1.4 統計學方法
采用SPSS 17.0 對所得數據進行統計學分析,計量資料采用均數±標準差()表示,比較采用t 檢驗,多組計量資料比較采用單因素方差分析,組間兩兩比較采用LSD-t 檢驗。計數資料采用例數表示,比較采用χ2檢驗。采用受試者操作特征曲線及曲線下面積(area under the curve,AUC)分析診斷價值。以P <0.05為差異有統計學意義。
2 結果
2.1 兩組血清炎癥因子比較
EPVS 組血清IL-1、IL-6、TNF-α、CRP 水平均高于對照組,差異有統計學意義(P <0.05)。見表1。
表1 兩組的血清炎癥因子比較()

表1 兩組的血清炎癥因子比較()
注 EPVS:擴大血管周圍間隙;IL:白細胞介素;TNF-α:腫瘤壞死因子α;CRP:C 反應蛋白
2.2 基底節區不同EPVS 分級患者血清炎癥因子比較
2、3 級基底節區EPVS 患者血清IL-1、IL-6、TNF-α、CRP 水平均高于1 級基底節區EPVS 患者,3 級基底節區EPVS 患者血清IL-1、IL-6、TNF-α、CRP 水平均高于2 級基底節區EPVS 患者,差異均有統計學意義(P <0.05)。見表2。
表2 基底節區不同EPVS 分級患者血清炎癥因子比較()

表2 基底節區不同EPVS 分級患者血清炎癥因子比較()
注 與1 級基底節區EPVS 患者比較,aP <0.05;與2 級基底節區EPVS 患者比較,bP <0.05。EPVS:擴大血管周圍間隙;IL:白細胞介素;TNF-α:腫瘤壞死因子α;CRP:C 反應蛋白
2.3 血清炎癥因子診斷基底節區EPVS 的診斷價值
血清IL-1、IL-6、TNF-α、CRP 單獨及聯合對基底節區EPVS 均具有診斷價值(AUC >0.05,P <0.05)。見表3、圖1。

表3 血清炎癥因子診斷基底節區EPVS 的診斷價值
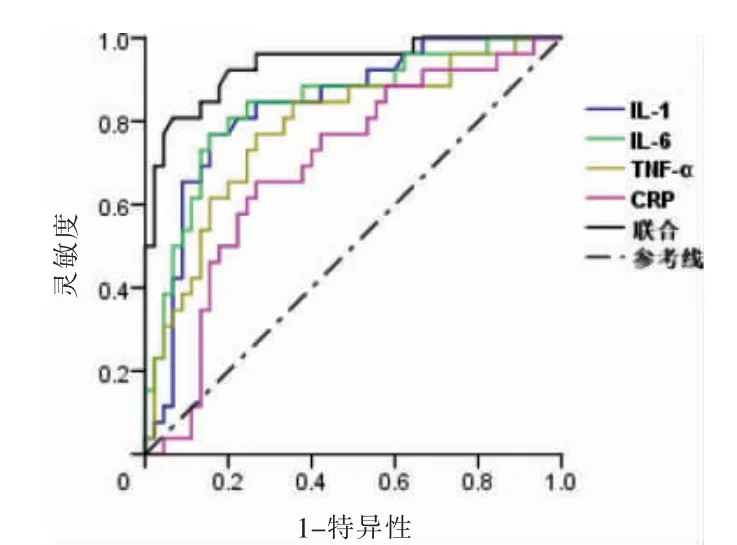
圖1 血清炎癥因子單獨及聯合診斷基底節區EPVS 的受試者操作特征曲線
3 討論
目前EPVS 機制尚未明確,以往研究普遍認為EPVS 僅是一種MIR 技術發現的影像學表現[6-8]。但隨著科研學者不斷的探索和認知,EPVS 逐漸被認為是疾病的標志物。國外學者認為,腦淀粉樣血管病所致腦出血與EPVS 存在密切關系[9-10]。國內學者發現,基底節區EPVS 對患者的認知功能有較大影響[11-14]。這均提示了EPVS 與疾病存在聯系。本研究發現,伴有EPVS 患者的血清IL-1、IL-6、TNF-α、CRP 表達水平均高于健康人群,提示EPVS 可能與炎癥存在聯系。可能因為炎癥導致部分PVS 纖維化和閉塞,導致組織液引流障礙,促使組織液于未纖維化和閉塞的PVS聚集,導致PVS 逆行擴大。
正常生理狀態的人群顱內PVS 直徑通常不超過2 mm,只有在PVS 擴大才會清晰地在MIR 中顯示出來,直徑可達2~4 mm,常位于腦干、基底節區、半卵圓中心區。PVS 參與淋巴回流,可為中樞神經系統的腦內代謝、物質交換、有害物質清除提供了場所[15-17],可能對免疫系統、炎癥反應具有調節重要作用。本研究結果顯示,3 級基底節區EPVS 患者的血清IL-1、IL-6、TNF-α、CRP 水平分別高于2 級和1 級,而2 級基底節區EPVS 患者的血清IL-1、IL-6、TNF-α、CRP 表達水平高于1 級,提示基底節區EPVS 患者炎癥因子異常升高。可能是由于血管間隙擴大,導致血管間通透性增加,致使炎癥細胞堆積于PVS,進而導致其擴大,而正常組織間液進入血管間隙則也加重這種趨勢。炎癥參與神經系統炎癥病變,因為神經系統中的炎癥細胞可通過動靜脈管壁基底膜而進入血管間隙,之后穿插外層神經界膜而進入腦實質內,而炎癥反應越嚴重,提示積聚在PVS 的炎癥細胞因子及代謝產物越多,堵塞程度也越重,隨著時間推移,促使PVS 擴大[18-19]。IL-1 是重要的炎癥因子之一,其可誘導黏附分子表達,募集白細胞到組織損傷部位,介導炎癥介質產生,促進炎癥反應[20-21]。IL-6 是由纖維母細胞、上皮細胞、單核或巨噬細胞及T、B 細胞等產生[22-24],可誘導細胞毒性T 細胞的增殖分化,刺激肝細胞合成急性期蛋白,參與炎癥反應。TNF-α 是免疫炎癥反應的最初啟動者,在炎癥早期便釋放,可誘導IL-1、IL-6 等多種促炎性細胞因子釋放,增加機體炎癥反應。CRP 在肝臟內合成,炎癥會刺激CRP 表達水平上調,是炎癥反應的重要指標之一[25-26]。本研究結果顯示,血清IL-1、IL-6、TNF-α、CRP 單獨及聯合對基底節區EPVS 均具有診斷價值。這可能是炎癥反應破壞了血管通透性,導致T 細胞、樹突細胞等免疫細胞和黏附細胞聚集于PVS 中,達到共同完成免疫防御的作用[27]。但具體機制仍有待進一步證實。本研究發現,血清IL-1、IL-6、TNF-α、CRP 聯合診斷基底節區EPVS 的靈敏度為85.90%,特異度為90.10%,能較好地預測基底節區EPVS。但本研究樣本量有限,結果可能存在一定偏倚,仍需更大的樣本量來進一步佐證。
綜上所述,基底節區EPVS 患者的血清IL-1、IL-6、TNF-α、CRP 高于健康人群,且不同EPVS 分級的血清IL-1、IL-6、TNF-α、CRP 水平也有所不同,提示基底節區EPVS 有免疫炎癥機制參與,但具體機制仍有待進一步查實,這亦是本課題今后的研究方向之一。

