草地貪夜蛾核型多角體病毒對我國草地貪夜蛾不同地理種群毒力的比較分析
程露強,靳雯怡,郭 琳,方分分,陳新中,秦啟聯,徐建祥,張 寰*
(1. 揚州大學園藝與植物保護學院,江蘇揚州 225009;2. 中國科學院動物研究所農業蟲害鼠害綜合治理研究國家重點實驗室,北京 100101;3. 河南濟源白云實業有限公司,河南濟源 454652;4. 河北大學生命科學學院,河北保定 071002)
草地貪夜蛾Spodopterafrugiperda(J.E. Smith)原產美洲熱帶和亞熱帶地區,在巴西造成玉米ZeamaysL.減產34%,年損失40億美元(Jingetal., 2020)。自2018年底至2020年8月31日,在全國27個省1 338個縣(全國農技推廣網, 2020)發現草地貪夜蛾,對我國玉米等農作物構成嚴重威脅。由于對寄主植物的偏好不同,草地貪夜蛾在原發地分化為玉米型和水稻型。目前,分子標記是鑒定草地貪夜蛾不同亞型的主要手段,其中來自于線粒體的細胞色素C氧化酶亞基Ⅰ基因(cytochrome c oxidase subunit Ⅰ,COI)以及位于Z染色體上的磷酸丙糖異構酶基因(triose-phosphate isomerase,Tpi)是最常用且最成熟的標記基因(張磊等, 2019)。
草地貪夜蛾核多角體病毒Spodopterafrugiperdamultiplenucleopolyhedrovirus(SfMNPV)專一性侵染草地貪夜蛾,制成病毒殺蟲劑后,具有無污染、環境友好、持效性長等優點,是化學防治的良好補充。迄今為止,國內外已從不同地區的草地貪夜蛾中分離到多個SfMNPV毒株,雖然這些毒株核苷酸序列相似性高達99.35%(Arive, 2014),但這些分離株對草地貪夜蛾的毒力和感染宿主后的表型往往存在較大差異。例如,SfMNPV-6nd毒株不會引起宿主表皮液化,與高毒力毒株SfMNPV-19相比,兩毒株的LC50差異不顯著,但SfMNPV-6nd殺死2齡幼蟲所需的時間長于SfMNPV-19(Vieiraetal., 2012)。此外,不同種群草地貪夜蛾對同一SfMNPV毒株的敏感性也不同。例如,生物測定法評價SfMNPV對玉米型和水稻型草地貪夜蛾幼蟲毒力的結果表明,玉米型和水稻型草地貪夜蛾對SfMNPV表現出不同的敏感性水平(Pophametal., 2021)。這一現象在家蠶Bombyxmori與家蠶核型多角體病毒Bombyxmorinucleopolyhedrovirus(BmNPV)(張遠能等, 1982; 陳克平等, 1991)、甜菜夜蛾Spotopteraexigua與甜菜夜蛾核型多角體病毒Spotopteraexiguamultiplenucleopolyhedrovirus(SeMNPV)(李廣宏等, 2006)、茶尺蠖Ectropisobliqua與茶尺蠖核型多角體病毒Ectropisobliquanucleopolyhedrovirus(EoNPV)(席羽等, 2011)等其它鱗翅目昆蟲在與桿狀病毒的互作中也有發現和報道。
昆蟲消化道是一個復雜的微環境,包括食物、腸液以及腸道微生物菌群。核型多角體病毒(nucleopolyhedrovirus,NPV)只有在鱗翅目昆蟲中腸的堿性環境和蛋白酶的作用下,才能解離和釋放包涵體來源型病毒粒子(occlusion-derived virion,ODV)(Slacketal., 2006; Rohrmann, 2019)。因此,腸道微環境對宿主感染NPV有一定影響。殷燦(2014)發現,隨著溶劑pH升高,美國白蛾核型多角體病毒Hyphantriacuneanucleopolyhedrovirus(HcNPV)包涵體(occlusion bodies,OBs)殺死宿主的時間(LT50)逐漸縮短,提示HcNPV包涵體的解離對宿主美國白蛾Hyphantriacunea感染速度和致病力均有影響。另有研究發現,沃爾巴克氏菌Wolbachia可以提高甜菜夜蛾對SeMNPV的敏感性(Grahametal., 2012)。SeMNPV感染增加了甜菜夜蛾幼蟲的腸道菌群負荷,增強了病毒的毒力和致病性(Jakubowskaetal., 2013),提示宿主的中腸微生物種類可影響宿主對NPV感染的敏感性。本文首先測定了我國4個地理種群草地貪夜蛾的基因型,隨后探討了不同地理種群草地貪夜蛾腸道微環境對其對SfMNPV的敏感性的影響。
1 材料與方法
1.1 實驗材料
1.1.1供試昆蟲
云南德宏、廣東廣州種群由中國科學院動物研究所昆蟲病毒組提供,廣西欽州、西藏林芝種群由中國農業大學昆蟲生理生化與毒理實驗室高希武教授提供,上述4個種群在河南濟源白云實業有限公司建立草地貪夜蛾種群,使用人工飼料在25℃飼養。
1.1.2供試病毒
供試病毒毒株于2019年從云南德宏州玉米田采集的草地貪夜蛾幼蟲病死蟲尸中分離,經純化、測序,鑒定為SfMNPV,命名為SfMNPV-KYc01,現保藏于中國科學院動物研究所昆蟲病毒組,在濟源白云實業有限公司保種并用于生物測定。
1.2 實驗方法
1.2.1草地貪夜蛾種群遺傳多樣性鑒定
分別收集建立室內種群4個種群的草地貪夜蛾6齡幼蟲各3頭的血細胞,分別提取DNA用于PCR反應,使用PrimeSTAR?Max DNA Polymerase(Takara,貨號:R45Q)進行PCR擴增,使用COI引物(5′-TTCGAGCTGAATTAGGGACTC-3′;5′-GATGTAAAATATGCTCGTGT-3′)和Tpi引物(5′-GGTGAAATCTCCCCTGCTATG-3′;5′-AATTTTATTA CCTGCTGTGG-3′)(張磊等, 2019),每個PCR使用50 μL反應體系,含PrimeSTAR Max (2×) 25 μL,20 pmol引物和70 ng細胞DNA模板。PCR擴增反應條件為在94℃初始變性2 min后,98℃ 10 s,55℃ 5 s,72℃ 5 s進行35個循環,最后一個循環進行68℃延伸5 min。所得產物用1%瓊脂糖凝膠電泳檢測,將電泳呈陽性的PCR產物送至華大基因公司測序。
1.2.2生物測定
SfMNPV多角體使用血球計數板計數后,使用濃度梯度稀釋為以下5個濃度:1.28×107、2.56×107、5.12×107、1.024×108、2.048×108OBs/mL。
15孔板養蟲盒提前倒入融化的飼料,制作飼料平板,加入100 μL稀釋好的病毒液,空白對照加等量無菌去離子水,涂布均勻,再用已消毒的鑷子將草地貪夜蛾4齡幼蟲轉移至已加入病毒的飼料平板內。每個濃度60頭,共360頭。然后轉移至溫度26℃±1℃,相對濕度65%±5%的條件下繼續培養。6 d開始檢查試蟲死亡情況,直至第10天。
1.2.3添加熒光增白劑FB28或鏈霉素進行生物測定
熒光增白劑處理:實驗分為3組進行,CK0:在人工飼料中添加100 μL 2% FB28;CK1:人工飼料中添加100 μL 3.6×107PIB/mL SfMNPV;實驗組:人工飼料中添加100 μL含2% FB28和3.6×107PIB/mL的SfMNPV。取長勢一致的廣西和西藏種群草地貪夜蛾4齡初期幼蟲,分別接入上述3組人工飼料中,3個重復,每個重復10頭蟲。第6天開始每天檢查試蟲死亡情況,直至第10天。
鏈霉素處理:在人工飼料中添加100 μL含200 mg/L鏈霉素和5×107PIB/mL SfMNPV,對照不含鏈霉素,接入長勢一致的廣西和西藏種群草地貪夜蛾4齡初期幼蟲,第6天開始每天檢查試蟲死亡情況,直至第10天。
1.2.4幼蟲體內注射草地貪夜蛾出芽型病毒
SfMNPV的BV由Sf9細胞擴增,使用空斑計數法計數BV濃度。
取大小一致的廣西和西藏草地貪夜蛾4齡幼蟲在雙蒸水中浸泡麻醉,在幼蟲腹足位置用微量采血吸管注射5 μL SfMNPV BVs(2 700 PFU,plaque forming unit),陰性對照組注射等量的細胞培養液,置于15孔養蟲盒內飼養,3個重復,每重復30頭。10 d后檢查試蟲死亡率。
1.2.5中腸腸液pH測定
參考Haas-Stapletonetal.(2003)中腸pH測定方法并稍作改進,取廣西和西藏種群草地貪夜蛾5齡幼蟲,用剪刀、解剖針和尖嘴鑷剖開蟲體,剝去中腸組織,將圍食膜包裹的腸道內容物轉移至1 mL無菌雙蒸水中,吹打震蕩使腸道內容物全部溶解在水里,挑去圍食膜碎片,2 000 g離心10 min,用pH計測量上清液pH,每個種群測量30次,每次1頭草地貪夜蛾幼蟲。
1.2.6腸道菌群16S rDNA測序
草地貪夜蛾廣西和西藏種群各選擇健康的草地貪夜蛾6齡幼蟲12頭,浸泡于75%乙醇中消毒,蒸餾水漂洗3次。在超凈工作臺上解剖其腸道內容物。每個種群設置3個樣本,每個樣本2頭蟲,共6個樣本。于在-80℃冰箱中保存備用。根據E.Z.N.A.?soil DNA kit (Omega Bio-tek, Norcross, GA, U.S.)說明書進行微生物群落總DNA抽提,PCR擴增和Illumina HiSeq測序。以16S rDNA的V3-V4區域作為擴增和測序的目的片段,引物序列為:515F:5′-ACTCCTACGGGAG GCAGCA-3′,806R:5′-GGACTACHVGGGTWTCTA AT-3′(徐天梅等, 2020),擴增程序如下:95℃預變性3 min,27個循環(95℃變性30 s,55℃退火30 s,72℃ 延伸30 s),然后72℃穩定延伸10 min,最后在4℃進行保存(PCR儀:ABI GeneAmp?9700 型)。PCR反應體系為:5×TransStart FastPfu緩沖液4 μL,2.5 mM dNTPs 2 μL,上游引物(5 μM)0.8 μL,下游引物(5 μM)0.8 μL,TransStartFastPfuDNA聚合酶0.4 μL,模板DNA 10 ng,無菌去離子水補足至20 μL。每個樣本3個重復。文庫構建及數據處理基于llumina HiSeq測序平臺,利用雙末端測序(paired-end)的方法,構建小片段文庫并進行測序。對原始數據進行拼接,將拼接得到的序列進行質量過濾,并去除嵌合體,得到高質量的tags序列(上海美吉生物醫藥科技有限公司)。
1.3 數據處理
PCR測序結果用DNAMAN 9.0和NCBI數據庫下載草地貪夜蛾玉米型和水稻型COI和Tpi序列進行比對。
校正死亡率(%)=(病毒處理組死亡率-對照組死亡率)/(100%-對照組死亡率)×100,用SPSS 22.0對生物測定結果死亡率與濃度基于Probit回歸模型計算LC50,同樣方法Probit回歸分析接種最高病毒濃度下草地貪夜蛾幼蟲死亡率與時間并計算LT50。對注射SfMNPV的BVs后死亡率、草地貪夜蛾腸道pH值采用單因素方差分析差異顯著性。
腸道微生物鑒定和多樣性分析使用Flash(v1.2.11)進行pair-end雙端序列拼接,Qiime(v1.9.1)生成各分類豐度表,Uparse(v7.0)對序列在97%的相似度水平下進行聚類、獲得運算的分類單元(Operational Taxonomic Units,OTUs),Usearch(v7.0)進行OTU統計,通過PICRUSt對OTU豐度表進行標準化并基于Silva(細菌)和UNITE(真菌)分類學數據庫對OTU進行分類學注釋,RDP Classifier(v2.11)進行序列分類注釋。
2 結果與分析
2.1 草地貪夜蛾不同地理種群遺傳多樣性分析
COI基因序列長度約780 bp,Tpi基因序列長度約380 bp,凝膠電泳檢測如圖1所示,條帶大小正確無雜帶,可用于后續測序驗證。
COI部分序列比對結果表明,草地貪夜蛾云南、廣東和西藏種群與NCBI上Rice strain(Sequence ID: HM136598.1)序列完全一致,屬于水稻型;而廣西種群存在16個位點的差異(圖2),并與NCBI上Corn strain(Sequence ID: HM136592.1)序列一致,屬于玉米型。

圖2 我國草地貪夜蛾4個地理種群COI部分序列比對Fig.2 Sequence alignment of COI partial sequence of four geographical populations of Spodoptera frugiperda
Tpi部分序列比對結果表明,云南、廣東、廣西和西藏4個種群序列完全相同,且與NCBI上Corn Strain(Sequence ID: KT336238.1)序列一致,都屬于玉米型。
2.2 草地貪夜蛾不同地理種群對草地貪夜蛾核型多角體病毒的敏感性
4個不同種群4齡幼蟲對SfMNPV存在敏感性差異。從LC50值分析(表1),廣西種群顯著高于西藏、云南和廣東種群,廣西種群LC50是西藏種群的37倍;LT50趨勢與LC50大致呈正相關(表2),廣西種群LT50為9.5 d,西藏種群LT50為 7.3 d,表明廣西種群敏感性最低,西藏種群敏感性最高。
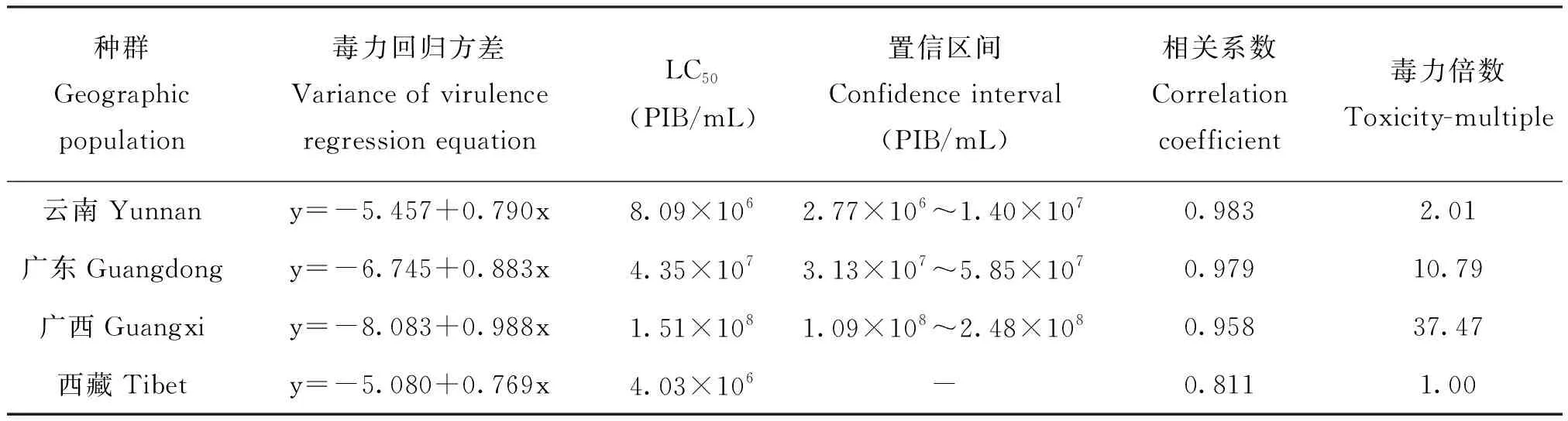
表1 SfMNPV對不同地理種群草地貪夜蛾4齡幼蟲的半致死濃度Table 1 Toxicity of SfMNPV to 4th instar larvae of Spodoptera frugiperda in different geographic populations

表2 SfMNPV對不同地理種群草地貪夜蛾4齡幼蟲的半致死時間Table 2 Toxic effects of SfMNPV on 4th instar larvae of Spodoptera frugiperda in different geographic populations
2.3 熒光增白劑對草地貪夜蛾口服感染SfMNPV的影響
飼料中單獨添加2%熒光增白劑FB28不會造成草地貪夜蛾4齡幼蟲的死亡,但添加FB28對草地貪夜蛾感染SfMNPV有一定影響。其中,FB28對廣西草地貪夜蛾感染SfMNPV有增效作用:7 d以后,添加了FB28的實驗組死亡率顯著高于對照組(圖3-A)。而西藏種群實驗組的死亡率稍高于對照組,但不具備統計學意義,可能是由于病毒的接種濃度顯著高于西藏種群的LC50,導致FB28處理對病毒感染增效作用不明顯(圖3-B)。比較FB28對草地貪夜蛾不同種群感染SfMNPV的影響,發現添加FB28并接種相同病毒濃度下,廣西種群因病毒感染的死亡率稍低于西藏種群,但不存在統計學意義的顯著性差異(圖3-C),說明添加了FB28抵消了草地貪夜蛾不同地理種群對SfMNPV的敏感性差異,提示不同地理種群對SfMNPV的敏感性不同可能是宿主圍食膜的差異導致的。

圖3 FB28處理對草地貪夜蛾廣西種群和西藏種群感染SfMNPV的影響Fig.3 Effect of FB28 treatment on SfMNPV infection of Spodoptera frugiperda in Guangxi and Tibet注:A,添加FB28對草地貪夜蛾廣西種群感染SfMNPV具有增效作用;B,添加FB28對草地貪夜蛾西藏種群SfMNPV感染增效作用不顯著;C,FB28和SfMNPV共處理對草地貪夜蛾不同種群的影響不顯著。Note: A, Addition of FB28 had a synergistic effect on the infection of SfMNPV by S. frugiperda Guangxi strain; B, Addition of FB28 to Tibetan population of S. frugiperda had no significant synergistic effect on SfMNPV infection; C, Effect of co-treatment of FB28 and SfMNPV on different populations of S. frugiperda.
2.4 添加鏈霉素對草地貪夜蛾口服感染SfMNPV的影響
在食物中添加鏈霉素能殺死甜菜夜蛾腸道中大部分細菌(Jakubowskaetal., 2013)。因此,本文中添加鏈霉素以消除宿主腸道細菌,對比死亡率差異,以描述腸道細菌對宿主感染SfMNPV的影響。其中,廣西種群草地貪夜蛾在添加鏈霉素后6 d死亡率顯著低于對照組,7~10 d死亡率與對照組無顯著性差異(圖4-A);西藏種群實驗組與對照組死亡率無顯著性差異(圖4-B)。這說明腸道細菌可能并非直接參與草地貪夜蛾宿主拮抗SfMNPV作用。
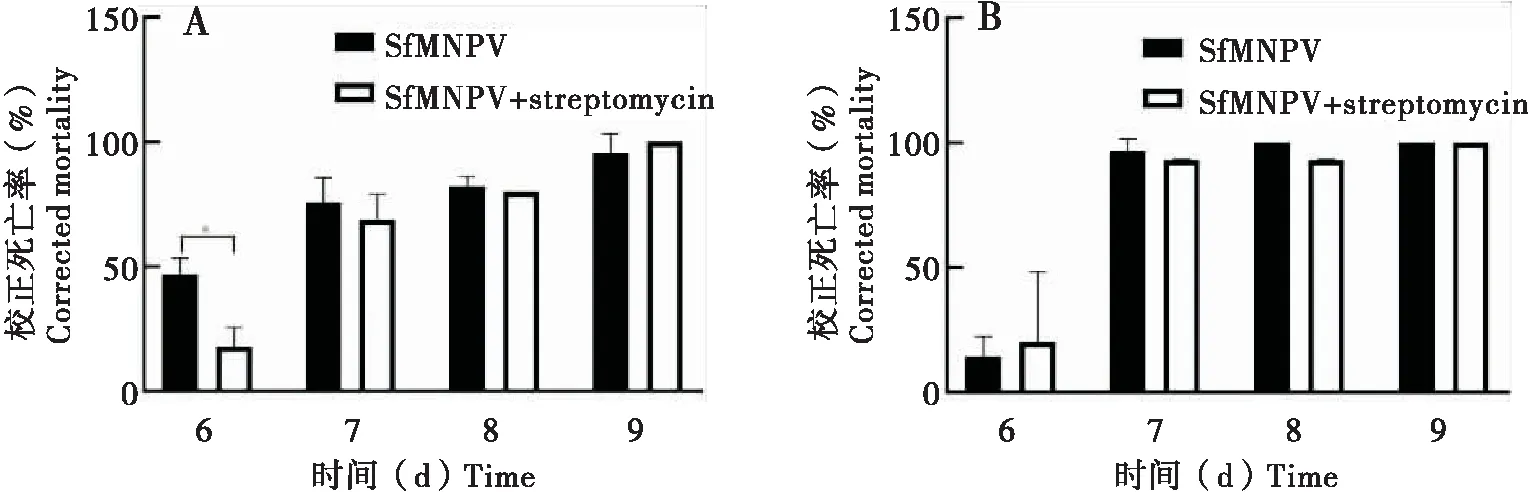
圖4 鏈霉素處理對草地貪夜蛾廣西種群和西藏種群感染SfMNPV的影響Fig.4 Effect of streptomycin treatment on SfMNPV infection of Spodoptera frugiperda in Guangxi and Tibet注:A,廣西種群;B,西藏種群。Note:A,Guangxi strain;B,Tibet strain.
2.5 出芽型病毒對草地貪夜蛾高敏感種群和低敏感種群的致死率
注射SfMNPV BVs后,草地貪夜蛾廣西種群和西藏種群4齡幼蟲死亡率無顯著性差異(圖5),說明跳過原發感染階段,兩種群對BVs的免疫能力相當,表明兩者對SfMNPV敏感性差異不在次級感染階段,而是可能發生在多角體進入草地貪夜蛾消化道引起的原發感染階段。
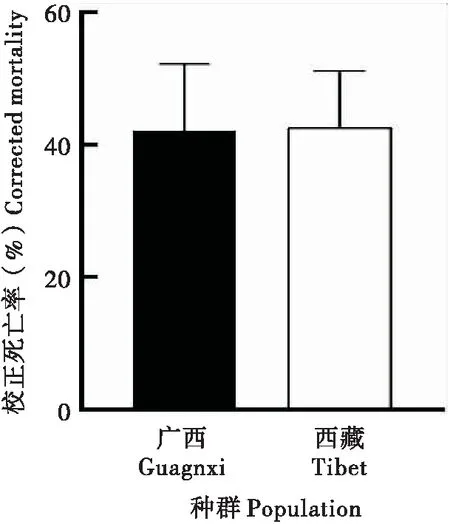
圖5 草地貪夜蛾高敏感種群和低敏感種群4齡幼蟲注射SfMNPV BVs死亡率Fig.5 Mortality rate of Spodoptera frugiperda after injection of SfMNPV BVs in different geographic populations
2.6 草地貪夜蛾不同地理種群腸道pH及菌群種類分析
廣西種群和西藏種群中腸腸液pH存在顯著性差異(圖6-A),廣西種群pH均值8.999,西藏種群pH均值9.160。廣西種群pH值低,提示會抑制ODV的釋放效率,進而導致廣西種群對病毒的敏感性低。
廣西和西藏種群在97%的相似度水平下聚類共獲得639個OTUs(Operational Taxonomic Units)。其中廣西種群聚類共獲得488個OTUs;西藏種群聚類共獲得151個OTUs,廣西種群與西藏種群之間共有的OTUs數目為132個(圖6-B)。廣西種群腸道菌種類多于西藏種群。

圖6 草地貪夜蛾廣西種群和西藏種群腸液pH及腸道細菌物種和菌落Fig.6 pH value, species and community of intestinal bacterial of Spodoptera frugiperda in Guangxi and Tibetan population
在科屬水平上,廣西種群腸道菌主要為乳桿菌屬Lactobacillus(59.46%)、Muribaculaceae科(15.77%)、毛螺旋菌科Lachnospiraceae(2.35%)、顫螺旋菌科Oscillospiraceae(2.14%)、另枝菌屬Alistipes(2.07%)、Lachnospiraceae NK4A136 group(2.04%)、螺桿菌屬Helicobacter(1.93%)、擬桿菌屬Bacteroides(1.76%)、Odoribacter(1.57%)和其它(10.92%),優勢菌主要為乳酸菌Streptococcuslactis,而西藏種群腸道菌主要為腸球菌Enterococcus(99.71%)(圖6-C)。提示廣西種群相較于西藏種群腸道乳酸菌豐度高,導致腸液pH值低(圖6-A),從而影響草地貪夜蛾廣西種群對SfMNPV的敏感性。鑒于兩組群腸道菌群存在明顯差異,可能存在其它微生物影響宿主對病毒的敏感性,有待進一步驗證。
3 結論與討論
據報道,不同宿主基因型導致對病毒敏感性存在差異,例如,席羽等(2011)發現,在浙江、湖南、湖北和江蘇7個不同地理種群茶尺蠖對EoNPV敏感性存在顯著差異,并基于線粒體COI和COII基因序列分析,茶尺蠖地理種群存在遺傳分化(席羽, 2011)。最近的研究通過生物測定評價了幾種SfMNPV毒株對玉米型和水稻型草地貪夜蛾幼蟲的毒力,結果表明,玉米型和水稻型草地貪夜蛾對SfMNPV的敏感性不同。玉米型草地貪夜蛾幼蟲對SfMNPV不同毒株敏感性差異較大;而水稻型草地貪夜蛾幼蟲對不同SfMNPV毒株的敏感性相對穩定(Pophametal., 2021)。本研究發現廣西種群COI和Tpi鑒定結果都為玉米型,另外的云南、廣東、西藏種群COI為水稻型,Tpi為玉米型,屬于雜合玉米型(圖2),與目前國內各地對草地貪夜蛾基因型的鑒定結果一致(徐麗娜等, 2019; 張磊等, 2019; 王亞如等, 2020)。生物測定結果表明,玉米型的廣西種群的草地貪夜蛾對SfMNPV口服感染敏感性最低,而雜合玉米型的西藏種群的敏感性最高(表1和表2)。
雖然不同地理種群草地貪夜蛾對SfMNPV的敏感性存在差異,但是幼蟲直接注射SfMNPV BVs后,廣西種群(低敏感性)和西藏種群(高敏感性)感染SfMNPV的死亡率無顯著差異(圖3),表明敏感性差異并不發生在系統感染階段,而是發生在SfMNPV經口進入中腸的原發感染階段。
國內不同地區草地貪夜蛾腸道菌群差異已有相關報道,重慶種群分離的可培養腸道細菌為克雷伯氏菌屬KlebsiellaTrevisan、不動桿菌屬Acinetobacter、假單胞菌屬Pseudomonasadaceae、腸桿菌屬EnterobacterHormaecheandEdwards和氣單胞菌屬Aeromonas5屬(唐運林等, 2019),云南省蒙自地區的草地貪夜蛾幼蟲腸道分離到的細菌為克雷伯氏菌屬、腸球菌屬、沙雷氏菌屬Serratia和摩根菌屬Morganella4屬(李青晏等, 2020)。云南省寶藏鎮的草地貪夜蛾腸道優勢屬菌為艾克曼菌屬Akkermansia,豐度為12.80%;而云南省嵩明縣的草地貪夜蛾腸道優勢屬菌為腸球菌屬,豐度為46.99%(徐天梅等, 2020)。本研究中對腸道微環境研究發現,對SfMNPV低敏感的廣西種群腸液pH顯著低于高敏感的西藏種群(圖6-A)。兩者腸道菌群也存在顯著差異,廣西種群腸道菌種類和豐度顯著高于西藏種群(圖6-B),前者優勢菌為乳酸菌,從而導致其腸液pH值低;后者主要為腸球菌(圖6-C)。本試驗的結果與上述報道產生差異的原因,可能是草地貪夜蛾材料來源不同,有野外采集、室內采用寄主植物飼養或人工飼料飼養,腸道菌群差異可能是不同地域環境條件及寄主植物和食料條件的不同造成,而本研究所用草地貪夜蛾全部使用人工飼料進行飼養,齡期和外部環境條件也完全相同,造成腸道菌群差異可能是由于不同草地貪夜蛾腸道環境差異造成細菌對其適應性不同。另外,在飼料中添加鏈霉素去除腸道菌群,對草地貪夜蛾感染SfMNPV的作用不明顯(圖4-C),說明腸道菌群可能并非直接參與宿主拮抗SfMNPV。但是添加熒光增白劑后,消除了廣西種群和西藏種群口服SfMNPV的敏感性(圖4-A, B),結合熒光增白劑對圍食膜具有一定破壞作用,一定程度上表明造成草地貪夜蛾不同地理種群對SfMNPV的敏感性可能是由于宿主圍食膜的差異導致的。
綜上所述,根據草地貪夜蛾不同地理種群的基因型、腸道微環境和對病毒的敏感性規律來看,草地貪夜蛾廣西種群屬于純合玉米型,其腸道菌群種類和豐度高,優勢菌為乳酸菌,中腸腸液pH值較低,對SfMNPV的敏感性低;而云南、廣東和西藏種群屬于雜合玉米型,其中西藏種群對SfMNPV的敏感性最高,其腸道菌群種類和豐度低且主要為腸球菌,腸液pH較高。這是否是普遍規律以及這些條件是如何相互影響尚不清楚,有待進一步探索。

