赤鐵礦反浮選體系中CaCl2與石英吸附作用機理研究
金 丹 馬藝聞 侯 英 張倫旭
(遼寧科技大學礦業工程學院,遼寧 鞍山 114051)
礦產資源是人類社會發展必不可少的物質基礎,對國民經濟發展具有重要的戰略意義,而我國作為鐵礦石資源大國,鐵礦石資源具有貧、細、雜的特點,不利于鐵礦石的加工與利用[1-2]。鞍山式鐵礦是典型的貧赤鐵礦,占全國鐵礦資源的50%左右,具有鐵品位低、結構構造復雜的特點,主要以赤鐵礦和假象赤鐵礦為主,脈石礦物主要為石英[3-6]。
在鞍山式赤鐵礦陰離子反浮選過程中,淀粉抑制劑對石英和赤鐵礦均存在一定的抑制作用,因此活化劑對礦物的活化效用成為影響赤鐵礦反浮選的關鍵因素。目前使用的活化劑主要為含鈣活化劑,其與石英之間的作用機理從藥劑在礦物表面溶解特性的角度進行分析,主要有2種結論:一是認為活化劑在礦物表面溶解后形成的Ca(OH)+是起活化作用的主要成分[7-11];二是認為活化劑在礦物表面溶解后形成的Ca2+是起活化作用的主要成分[12-13],且有科研學者基于密度泛函理論,通過模擬計算得出Ca 3d-O 2p軌道發生雜化,使Ca2+與石英中的O原子形成共價鍵,進一步證明Ca2+是起活化作用的主要成分[14]。
本試驗從活化劑與礦物表面吸附作用角度入手,通過進行純礦物吸附特性試驗,并結合AFM、Zeta電位、FTIR檢測等分析手段,研究了活化劑CaCl2在石英表面和赤鐵礦表面吸附特性的差異,進一步闡明活化劑在石英和赤鐵礦表面的作用機理,可為赤鐵礦反浮選體系中浮選藥劑制度的合理優化提供理論依據。
1 試驗原料與試驗方法
1.1 試驗原料與試劑
試驗所用石英和赤鐵礦取自遼寧鞍山地區,選取其中純度較高的塊礦經人工破碎后采用陶瓷球磨機磨至-0.074 mm占90%,經篩分后干燥。石英采用酸浸法去除礦物中的鐵雜質,即將干燥后的石英礦樣用稀釋后的鹽酸溶液(鹽酸與去離子水的體積比為2∶1)浸泡24 h,沖洗,反復3次,再烘干備用。赤鐵礦磨礦后采用磁選管進行磁選預處理,再烘干,裝袋備用。將處理后的赤鐵礦和石英礦樣進行X射線衍射(XRD)分析。結果見圖1。赤鐵礦和石英與其標準卡片的特征峰位置一致,因此經上述處理后制得的石英和赤鐵礦礦樣可作為純礦物用于試驗。

圖1 純礦物XRD譜圖Fig.1 XRD spectrum of pure minerals
試驗試劑選用氫氧化鈉、鹽酸和氯化鈣,均為分析純。試驗用水為去離子水。
1.2 試驗方法
1.2.1 純礦物吸附試驗
稱取2.0 g礦樣放入50 mL燒杯中,加入25 mL去離子水,經磁力攪拌器攪拌1 min,用0.05 mol/L的HCl或NaOH標準溶液調節礦漿pH值,然后加入一定量的CaCl2,繼續攪拌3 min,取一定量攪拌后的礦漿溶液置于 TCL-16G高速離心機中,在 8 000 r/min轉速下離心分離5min,用配制好的EDTA標準溶液對離心后的上層清液進行滴定,從而計算CaCl2在礦物表面的吸附量。
1.2.2 Zeta電位分析
采用Zetasizer Nano Puls型電位測定儀進行Zeta電位檢測。分別制得赤鐵礦、石英純礦物及在不同吸附條件作用后的礦物樣品,取20 mg樣品置于裝有20mL去離子水的燒杯中,調節礦漿pH值,經磁力攪拌器攪拌后靜置,用注射器抽取適量上層清液注入樣品池,進行Zeta電位測試。
1.2.3 原子力顯微鏡分析
采用Bruker Dimension Icon原子力顯微鏡對吸附前后的石英和赤鐵礦進行檢測,觀察吸附前后礦物形貌和吸附程度的變化。具體操作為:取少量礦樣加入20 mL無水乙醇,攪拌后進行超聲處理10 min,使礦樣在無水乙醇中充分分散,滴一滴混濁液在石墨片上,烘干,再將石墨片置于原子力顯微鏡下進行掃描檢測與分析。
1.2.4 紅外光譜分析
采用Vertex 70v傅里葉變換紅外光譜儀對吸附前后的礦物樣品進行測定,分析活化劑與礦物表面間的作用形式。取少量礦樣與光譜純的KBr混合均勻,礦樣與KBr的質量比為1∶100,用瑪瑙研缽研磨,壓片,樣品腔放氣后置入樣品,抽真空,檢測得到對應的紅外光譜譜圖。
2 試驗結果及討論
2.1 吸附試驗
2.1.1 pH值的影響
在礦漿溫度35℃、CaCl2用量1 g/L、淀粉濃度為1 g/L、吸附時間5 min條件下,考察了pH值對CaCl2和淀粉在礦物表面吸附特性的影響(參考鞍山式鐵礦實際浮選礦漿pH條件,僅在堿性條件下進行試驗),試驗結果見圖2。
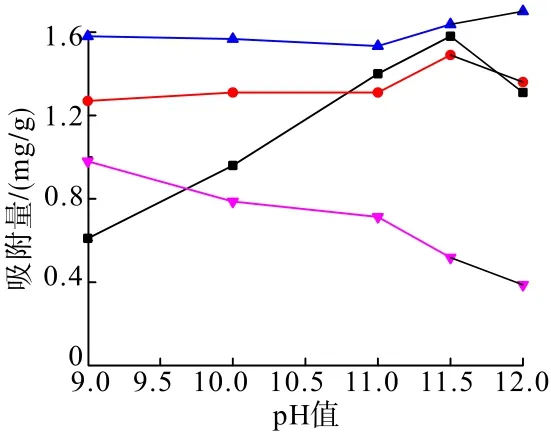
圖2 pH值對CaCl2、淀粉抑制劑與礦物吸附量的影響Fig.2 Effect of pH value on adsorption capacity of CaCl2,starch depressant and minerals

從圖2可以看出:隨著pH值的增加,CaCl2在石英表面的吸附量變化不大,在pH值為11.5時吸附量達到最大值,此時的吸附量為1.5 mg/g;CaCl2同樣在赤鐵礦表面發生吸附,隨著pH值的增加,CaCl2在赤鐵礦表面的吸附量先提高后降低,并在pH值為11.5左右時,吸附量達到最大,此后,吸附量出現降低的趨勢。當pH值在9.0~10.8的范圍內,CaCl2在石英表面的吸附量要大于其在赤鐵礦表面的吸附量;當pH值在11.0~12.0時,CaCl2在赤鐵礦表面的吸附量接近其在淀粉表面的吸附量,從而得出在pH值為11.0~12.0時,即在實際礦物浮選pH值條件下,CaCl2與淀粉在赤鐵礦表面發生了較強烈的競爭吸附,且CaCl2的活化吸附作用小于淀粉的抑制吸附作用,因此CaCl2無法活化被淀粉抑制的赤鐵礦。
在礦漿溫度35℃、CaCl2用量1 g/L、淀粉濃度1 g/L、吸附時間5 min時,不同pH值條件下CaCl2、淀粉在礦物表面的吸附量見表1、表2(將CaCl2的吸附量記作正吸附,淀粉的吸附量記作負吸附)。

表1 淀粉和CaCl2在石英表面吸附量對比Table 1 Comparison of adsorption amount of starch and CaCl2 on quartz

表2 淀粉和CaCl2在赤鐵礦表面吸附量對比Table 2 Comparison of adsorption amount of hematite starch and CaCl2 on
從表1、表2可以看出:石英表面的Δ吸附量為正值,即發生的活化吸附作用強于抑制吸附作用;赤鐵礦表面的Δ吸附量為負值,即發生的抑制吸附作用強于活化吸附作用。淀粉對赤鐵礦的抑制吸附作用強于CaCl2對赤鐵礦的活化吸附作用,淀粉可以有效抑制赤鐵礦,石英反之,因而CaCl2可有效活化石英,并實現赤鐵礦和石英的浮選分離。由此,可從吸附原理角度進一步闡釋鞍山式赤鐵礦實際浮選時采用加入淀粉抑制赤鐵礦、加入含鈣活化劑活化石英的反浮選工藝的理論依據。
2.1.2 吸附時間試驗
在礦漿溫度35℃、CaCl2用量1 g/L、pH=11.5的條件下,分別考察了吸附時間對CaCl2與石英和赤鐵礦吸附特性的影響,試驗結果見圖3。
從圖3可以看出:在吸附時間2~15 min的范圍內,隨著吸附時間的增加,CaCl2在石英和赤鐵礦表面的吸附量均不斷增加;在吸附時間10 min時,CaCl2在石英表面的吸附量達到最大,為1.58 mg/g,吸附時間15 min時,CaCl2在赤鐵礦表面的吸附量達到最大,為1.93 mg/g;此后隨著吸附時間的增加,吸附量逐漸下降。綜合考慮,選擇吸附時間10 min進行試驗。
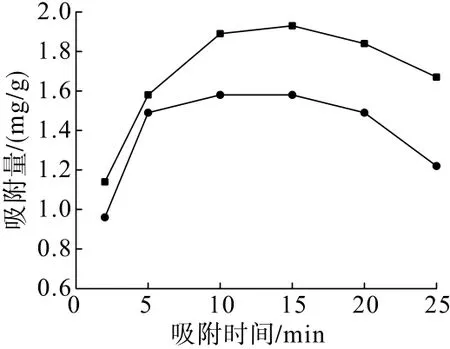
圖3 吸附時間對CaCl2與礦物吸附量的影響Fig.3 Effect of adsorption time on the adsorption of CaC l2 with minerals

2.1.3 CaCl2用量試驗
在礦漿溫度35℃、吸附時間10 min、礦漿 pH=11.5的條件下,分別考察了CaCl2用量對CaCl2與石英及赤鐵礦吸附特性的影響,試驗結果見圖4。
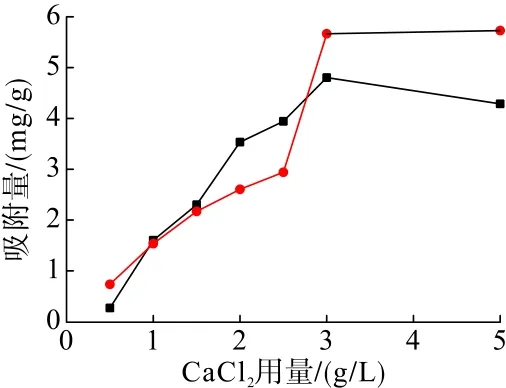
圖4 CaCl2用量對CaCl2與礦物吸附量的影響Fig.4 Effect of CaCl2 dosage on the adsorption of CaCl2 with minerals
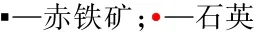
從圖4可以看出,CaCl2濃度小于3.0 g/L時,CaCl2在石英和赤鐵礦表面的吸附量隨著CaCl2用量的增加均不斷增加;當 CaCl2濃度為3.0 g/L時,CaCl2在赤鐵礦表面的吸附量達到最大值;當CaCl2濃度由2.5 g/L增加到3.0 g/L時,CaCl2在石英表面的吸附量迅速增加;當CaCl2濃度超過3.0 g/L后,CaCl2在石英表面的吸附量變化趨于平緩,而在赤鐵礦表面的吸附量出現下降趨勢,其吸附作用差異逐漸增大。因此,當CaCl2的濃度大于3.0 g/L時,更有利于CaCl2活化石英,進而實現赤鐵礦和石英的有效分離。
2.2 Zeta電位分析
在浮選過程中藥劑在礦漿中由于水解或電離作用產生的離子會吸附在礦物表面,使得礦物表面的電性發生變化,從而改變礦物的可浮性。基于吸附試驗研究結果,在礦漿溫度35℃、吸附時間10 min、CaCl2濃度3.0 g/L的條件下,對吸附藥劑前后的石英和赤鐵礦進行Zeta電位檢測,結果見圖5。

圖5 吸附前后礦物表面Zeta電位變化Fig.5 Zeta potential changes of minerals both before and after adsorption
從圖5(a)可以看出,石英與CaCl2吸附后其零電點變化不大,而隨著pH值的繼續增加,添加CaCl2后石英表面Zeta電位較石英原礦顯著正移,說明石英和CaCl2之間存在正負電荷的轉移,CaCl2與石英發生了靜電吸附。
從圖5(b)可以看出,赤鐵礦與CaCl2吸附后其零電點小幅減小,由5.81減小到4.26,且隨著pH值的增加,添加CaCl2后赤鐵礦表面Zeta電位較赤鐵礦原礦小幅負移,說明赤鐵礦和CaCl2之間沒有發生正負電荷轉移,即兩者之間不存在靜電吸附。
在浮選礦漿pH=11.5時,礦物與CaCl2吸附后,石英表面Zeta電位由-43 mV變為-9 mV,赤鐵礦表面Zeta電位由-23mV變為-29mV,石英表面的電位變化明顯大于赤鐵礦表面的電位變化,說明石英與CaCl2的吸附作用要比赤鐵礦與CaCl2的吸附作用更加強烈。
2.3 原子力顯微鏡結果與討論
采用AFM檢測分析吸附作用前后礦物表面形貌變化。對石英、赤鐵礦純礦物在溫度為35℃、吸附時間為10 min、CaCl2濃度為 3.0 g/L條件下制得的吸附作用前后礦物樣品分別進行原子力顯微鏡掃描,結果見圖6、圖7。
由圖6、圖7可以看出,石英與CaCl2吸附前后顆粒的形貌沒有發生明顯變化,但與CaCl2吸附后的石英顆粒分散度比較好,說明在一定程度上CaCl2改變了石英表面的電荷分布情況,提高了顆粒間的分散性,與Zeta電位測試分析結論一致。赤鐵礦在吸附CaCl2后,顆粒形態也沒有明顯變化,只是發生了部分聚積現象,說明CaCl2也可以在赤鐵礦表面發生吸附作用,但與礦物的作用程度較弱。
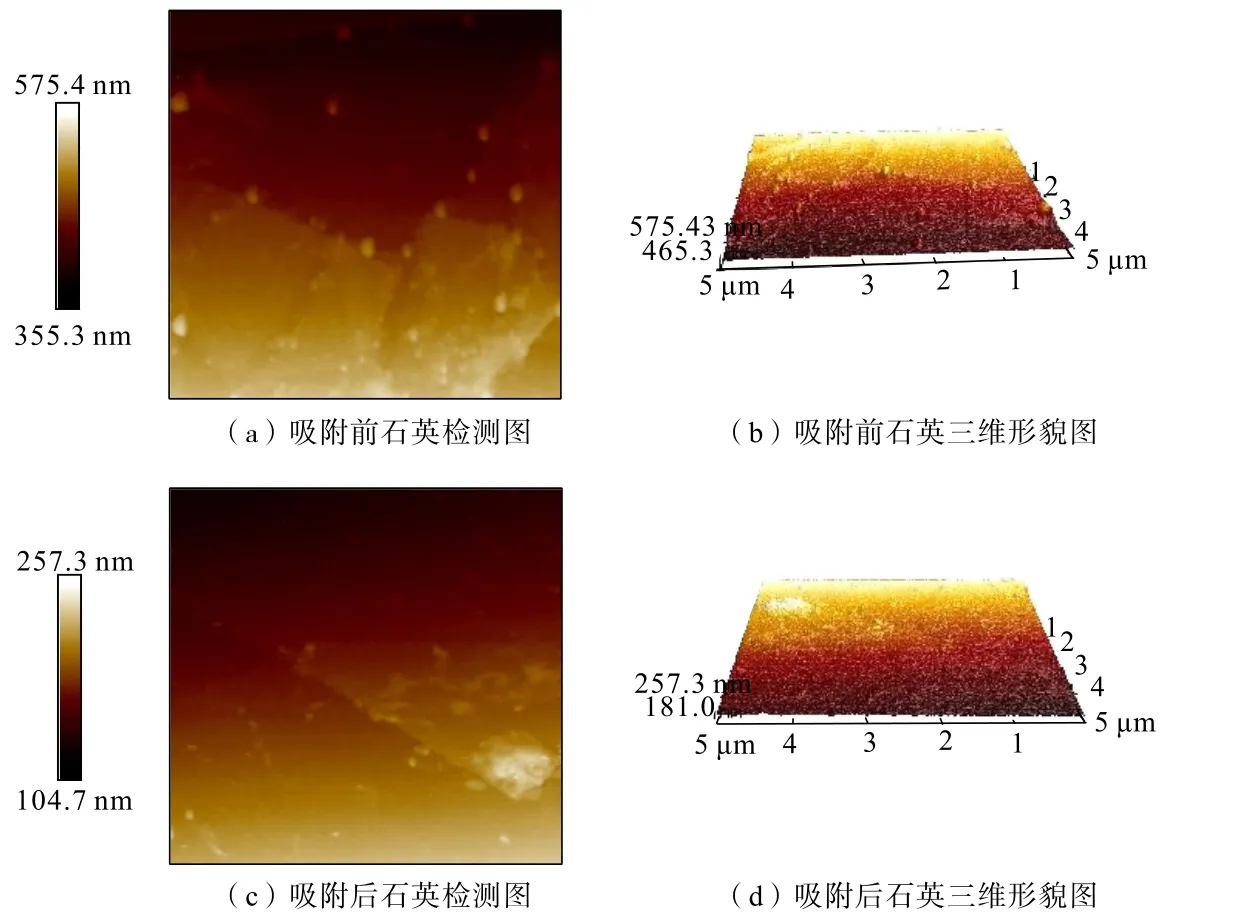
圖6 石英與CaCl2吸附前后的AFM圖Fig.6 AFM diagram of quartz and CaCl2 both before and after adsorption

圖7 赤鐵礦與CaCl2吸附前后的AFM檢測結果Fig.7 AFM diagram of hematite and CaCl2 both before and after adsorption
2.4 紅外光譜結果分析
利用紅外光譜測試結果分析CaCl2在石英和赤鐵礦表面是否發生化學吸附或氫鍵吸附。試驗中,對石英、赤鐵礦純礦物和在溫度為35℃、吸附時間為10 min、CaCl2濃度為 3.0 g/L的條件下制得的吸附作用后礦物樣品分別進行紅外光譜測試,結果見圖8、圖 9。
如圖8所示,3 469.72 cm-1處為石英與水發生吸附作用的羥基伸縮振動峰,1 616.24 cm-1處為石英與水發生吸附作用的羥基彎曲振動峰,1 082.00 cm-1處為石英Si—O非對稱伸縮振動吸收峰,此處為石英的第一特征吸收峰帶;796.55 cm-1和694.33 cm-1處為石英 Si—O—Si對稱伸縮振動吸收峰[12,15]。與CaCl2吸附后的石英的譜圖中,3 469.72 cm-1處吸收峰偏移至3 429.21 cm-1,1 616.24 cm-1處吸收峰偏移至1 612.39 cm-1,1 082.00 cm-1處石英Si—O非對稱伸縮振動吸收峰的峰強增加,796.55 cm-1處吸收峰偏移至779.19 cm-1。吸收峰發生了較大變化,可歸屬為CaCl2和石英之間發生了電子轉移,使得CaCl2在石英表面吸附,且表現為較弱的化學吸附作用。
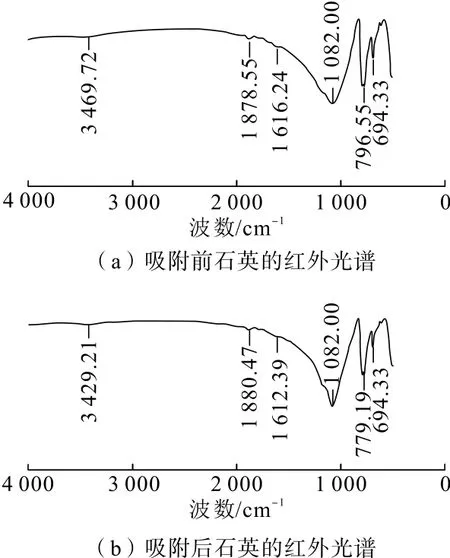
圖8 石英與CaCl2吸附前后的紅外光譜圖Fig.8 FTIR spectrum of quartz both before and after adsorption with CaCl2
如圖9所示,1 656.75 cm-1和1 452.30 cm-1處為H—O—H的變形振動吸收峰[7],987.49 cm-1和459.03 cm-1處為Fe—O的彎曲振動吸收峰,534.25 cm-1處為Fe—O的伸縮振動吸收峰[16];459.03 cm-1處振動峰偏移至460.96 cm-1,534.25 cm-1處振動峰偏移至536.18 cm-1,吸收峰變化不大,說明CaCl2和赤鐵礦之間不存在明顯的化學吸附作用。
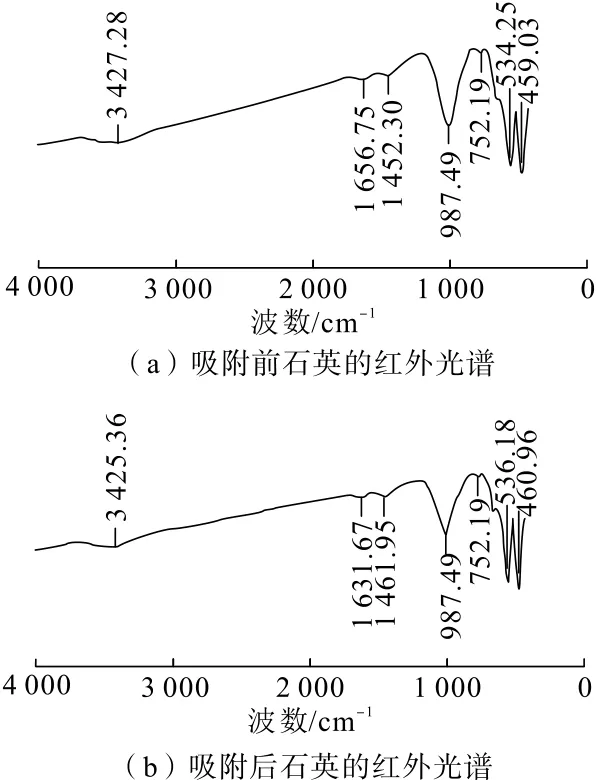
圖9 赤鐵礦與CaCl2吸附前后的紅外光譜圖Fig.9 FTIR spectrum of hematite both before and after adsorption with CaCl2
2.5 石英與CaCl2吸附等溫模型擬合
為了探討石英與活化劑CaCl2的吸附機理,進行了Langumir、Freundlich以及 Dubinin-Radushkevich 3種吸附等溫模型的擬合。
(1)通過Dubinin-Radushkevich吸附等溫模型可判斷石英與CaCl2的吸附類型,其吸附等溫式如下:

式中,qe為吸附平衡時CaCl2的吸附量,mg/g;qm為最大吸附量,mg/g;b為吸附平均自由能相關常數,mol2/kJ2;ε為Polanyi吸附勢,ε=RTln(1+Ce-1)。其中Ce為吸附平衡時礦漿中CaCl2的殘余濃度,mg/L;R為理想氣體常數,R=8.314·mol/K;T為吸附溫度,K。
吸附類型可通過平均吸附自由能E進行判斷,E=1/(2b)0.5,當E小于8 kJ/mol時,則該吸附屬于物理吸附;當E介于8~16 kJ/mol之間,則該吸附屬于離子交換吸附;當E大于16 kJ/mol時,則該吸附屬于化學吸附。
(2)Langumir吸附等溫模型的前提是假設吸附為單分子層吸附,其吸附等溫方程式如下:
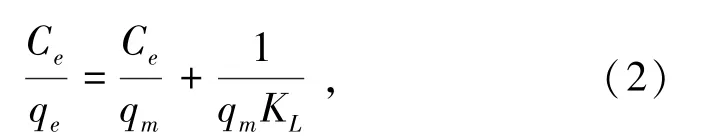
式中,Ce為吸附平衡時礦漿中CaCl2的殘余濃度,mg/L;qe為吸附平衡時的吸附量,mg/g;qm為最大吸附量,mg/g;KL為Langumir吸附常數,L/mg。可通過RL來確定吸附的難易程度,RL=(1+KLC0)-1,C0為溶液溶質的初始濃度,當RL=0時為可逆吸附作用;當0<RL<1時為有利吸附;當RL=1時為不利吸附。
(3)Freundlich吸附等溫模型表現的是多層吸附行為,其吸附等溫方程式如下:

式中,qe為吸附平衡時的吸附量,mol/g;Ce為吸附平衡時礦漿中CaCl2的殘余濃度,mol/L;KF為Freundlich平衡吸附常數,反映了吸附能力的強弱;為組分因數,表示吸附量隨濃度增長的強度,當大于2時為難吸附,當0.1<<0.5時為容易吸附[17-19]。
根據表3吸附試驗結果進行3種吸附等溫模型的擬合,吸附等溫曲線見圖10、圖11。擬合參數見表4。
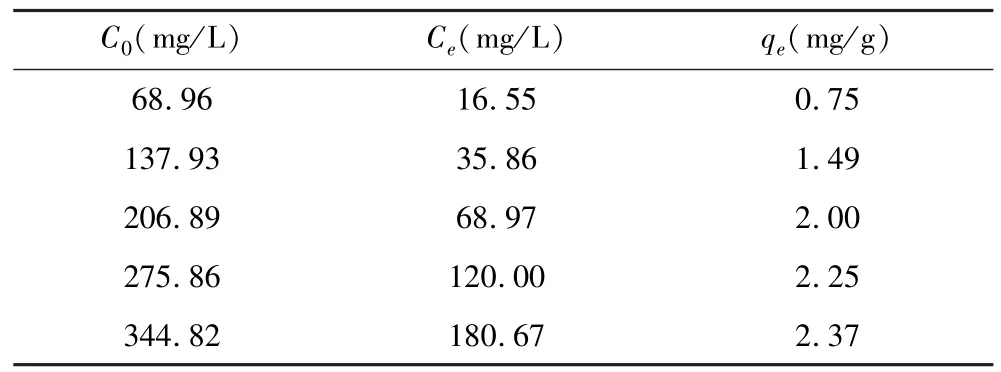
表3 吸附試驗結果Table 3 Adsorption test results

表4 吸附等溫模型擬合結果Table 4 Results of isothermal adsorption model fitting

圖10 石英Langumir吸附等溫模型擬合曲線Fig.10 Fitting curve of quartz Langumir adsorption isotherm model

圖11 石英Dubinin-Radushkevich吸附等溫模型擬合曲線Fig.11 Fitting curve of quartz Dubinin-Radushkevich adsorption isotherm model
結果顯示,Langumir吸附等溫模型的擬合相關系數R2為0.990 4,Freundlich吸附等溫模型的擬合相關系數R2為0.897 1,石英與CaCl2的吸附更符合Langumir吸附等溫模型。Dubinin-Radushkevich吸附等溫模型的擬合相關系數R2為0.995 7。通過Langumir吸附等溫模型的計算可以看出RL為0.101 7,在0~1之間,說明石英與CaCl2的吸附為單分子層吸附;通過Dubinin-Radushkevich吸附等溫模型計算可得:平均吸附自由能E為7.001 4,小于8 kJ/mol,說明石英與CaCl2的吸附主要為物理吸附。結合Zeta電位分析結果可以說明,CaCl2與石英間主要發生了單分子層的靜電吸附作用。
3 結 論
(1)純礦物吸附試驗結果表明:CaCl2在石英和赤鐵礦表面均發生了吸附作用,隨著CaCl2濃度的增加,CaCl2在石英和赤鐵礦表面的吸附量不斷增加,當CaCl2濃度超過3.0 g/L時,CaCl2在2種礦物表面的吸附量差值逐漸增大,即其在石英表面的吸附效果強于在赤鐵礦表面。此外,淀粉和CaCl2在赤鐵礦表面共同作用時會發生競爭吸附,且活化吸附作用小于抑制吸附作用;因此,在赤鐵礦反浮選的過程中CaCl2能活化石英,而無法活化赤鐵礦,從而達到浮選分離的目的。
(2)Zeta電位分析結果表明,CaCl2在石英表面發生了靜電吸附,且吸附作用較強;而CaCl2在赤鐵礦表面不發生靜電吸附。AFM分析結果表明,CaCl2的加入能夠改變石英表面電荷分布情況,提高其分散性,進而促進其浮選富集。
(3)結合吸附等溫模型的擬合結果得出:石英與CaCl2的吸附作用符合Langumir和Dubinin-Radushkevich吸附等溫模型;綜合檢測分析結果表明,在赤鐵礦反浮選體系下,石英與CaCl2的吸附主要為物理吸附,且為單分子層靜電吸附。

