信迪利單抗注射液治療晚期惡性腫瘤的療效和安全性分析
張雙燕,王童非,葉骉飛,魏娜
1西北大學附屬醫院·西安市第三醫院腫瘤科,西安 710018
2西安國際醫學中心醫院腫瘤科,西安 710100
近年隨著人民生活水平及生活質量的提高,惡性腫瘤的發病率越來越高,腫瘤免疫治療是繼手術、放化療及分子靶向治療后的一種新的腫瘤治療手段。目前,細胞毒性T淋巴細胞相關蛋白4(cytotoxic T-lymphocyte associated protein 4,CTLA4)抗體和程序性死亡受體1(programmed cell death 1,PDCD1,也稱PD-1)抗體是免疫檢查點抑制劑的代表性藥物,能增強免疫細胞活性以殺傷腫瘤細胞,在腫瘤免疫治療領域廣泛應用[1-2]。目前,國內上市的PD-1抑制劑有進口的納武利尤單抗、帕博利珠單抗、阿替利珠單抗以及國產的特瑞普利單抗、信迪利單抗和卡瑞利珠單抗。大部分腫瘤患者因經濟因素不能承受進口免疫抑制劑費用,部分患者自愿選擇國產免疫抑制劑信迪利單抗注射液進行治療。故本研究觀察分析信迪利單抗注射液治療晚期惡性腫瘤的療效及安全性,現報道如下。
1 資料與方法
1.1 一般資料
收集2019年8月至2021年1月西安國際醫學中心醫院及西安市第三醫院收治的接受信迪利單抗注射液治療的晚期惡性腫瘤患者的病歷資料。納入標準:已行基礎一線、二線化療失敗診斷明確的患者或多線治療后無標準治療的晚期惡性腫瘤患者;卡氏功能狀態(Karnofsky performance status,KPS)評分≥80分;有明確的病理診斷結果,有可評估病灶,影像學資料完整。排除標準:合并其他基礎疾病。根據納入、排除標準,共納入68例晚期惡性腫瘤患者作為觀察組,其中男性40例,女性28例;中位年齡58歲;美國東部腫瘤協作組(Eastern Cooperative Oncology Group,ECOG)體力狀況評分:0分22例,1分33例,2分13例;腫瘤類型:肺腺癌20例,肺鱗狀細胞癌16例,腎透明細胞癌/尿路上皮癌8例,肝癌6例,結直腸癌9例,食管癌9例。另選取同期30例選擇化療或靶向治療患者作為對照組,其中男性19例,女性11例;中位年齡56歲;ECOG體力狀況評分:0分11例,1分12例,2分7例;腫瘤類型:肺腺癌9例,肺鱗狀細胞癌6例,腎透明細胞癌/尿路上皮癌7例,肝癌2例,結直腸癌3例,食管癌3例。兩組患者性別、年齡、ECOG體力狀況評分及腫瘤類型比較,差異均無統計學意義(P﹥0.05),具有可比性。本研究經醫院倫理委員會審批通過,所有患者均知情同意并簽署知情同意書。
1.2 治療方法
對照組患者選擇化療或靶向治療。觀察組患者化療或靶向治療方案同對照組,并加用信迪利單抗聯合治療。68例患者中有43例患者采用信迪利單抗注射液聯合化療,25例患者采用信迪利單抗注射液聯合靶向治療,其中11例肺癌患者采用信迪利單抗注射液聯合鹽酸安羅替尼治療,2例肝癌患者采用信迪利單抗注射液聯合索拉非尼治療,2例肝癌患者采用信迪利單抗注射液聯合侖伐替尼治療,4例食管癌患者采用信迪利單抗注射液聯合鹽酸安羅替尼治療,4例直腸癌患者采用信迪利單抗注射液聯合瑞戈非尼治療,2例腎透明細胞癌患者采用信迪利單抗注射液聯合阿昔替尼治療。
具體用法:信迪利單抗注射液每次200 mg,每3周1次,與化療或靶向藥物同步。每2個月行影像學檢查評估病情,記錄治療期間的不良反應。
1.3 觀察指標
①臨床療效:采用實體瘤療效評價標準(response evaluation criteria in solid tumor,RECIST)[3]評估療效。完全緩解(complete response,CR):所有靶病灶消失;部分緩解(partial response,PR):靶病灶體積縮小≥30%;疾病進展(progressive disease,PD):靶病灶體積增加≥20%,最小5 mm,或非靶病灶進展或出現新病灶;穩定(stable disease,SD):靶病灶體積縮小沒有達到PR,增加沒有達到PD;客觀緩解率(objective response rate,ORR)=(CR+PR)例數/總例數×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)例數/總例數×100%。②不良反應發生情況:根據中國臨床腫瘤學會(Chinese Society of Clinical Oncology,CSCO)頒布的《免疫檢查點抑制藥相關的毒性管理指南(2019)》[4]中不良反應分級評價標準,分為5個級別:G1,輕度不良反應;G2,中度不良反應;G3,重度不良反應;G4,危及生命的不良反應;G5,與不良反應相關的死亡。
1.4 統計學方法
采用SPSS 22.0軟件進行統計學分析,計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;計數資料以例數及率(%)表示,組間比較采用χ2檢驗;以P﹤0.05為差異有統計學意義。
2 結果
2.1 治療前后腫瘤靶病灶最大徑縮小值的比較
治療前后觀察組患者靶病灶最大徑縮小值為(33.45±11.16)mm,大于對照組的(27.54±9.15)mm,差異有統計學意義(t=2.055,P=0.043)。
2.2 臨床療效的比較
觀察組患者ORR和DCR分別為36.8%(25/68)、76.5%(52/68),分別高于對照組的16.7%(5/30)、53.3%(16/30),差異均有統計學意義(χ2=3.958、5.246,P﹤0.05)。(表1)

表1 兩組患者的臨床療效
2.3 不良反應發生情況的比較
觀察組患者發生G1~G2級不良反應41例(60.3%),G3級不良反應8例(11.8%)。治療中患者對不良反應均能耐受,不影響后續治療。(表2)
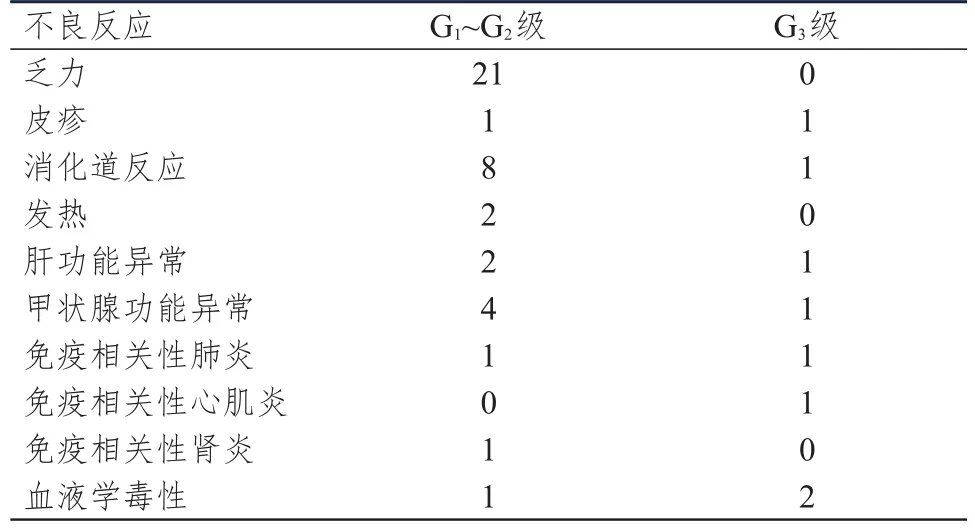
表2 68例觀察組患者不良反應發生情況
3 討論
腫瘤免疫治療的機制是通過激發或調動機體的免疫系統,恢復機體正常的抗腫瘤免疫反應,從而控制和殺傷腫瘤細胞。近年腫瘤免疫治療在黑色素瘤、霍奇金淋巴瘤、非小細胞肺癌、結直腸癌及泌尿生殖系統腫瘤等的治療中展現出良好的抗腫瘤活性,在臨床取得了重大突破,且大多數不良反應較輕,耐受性良好,有效的患者可以獲得長期生存[5]。但對患者來說,價格過于昂貴。信迪利單抗注射液是第二款國產PD-1抑制劑,于2018年12月24日上市,是一種全人源化免疫球蛋白G4(immunoglobulin G4,IgG4)單克隆抗體[6]。目前信迪利單抗注射液臨床多用于食管癌、非小細胞肺癌等多種實體腫瘤的治療。
肺癌是目前病死率最高的腫瘤之一,多項研究顯示,在肺癌治療中,免疫治療已經成為一線治療方案,CheckMate 057是針對ⅢB和Ⅳ期既往經含鉑雙藥化療進展的非鱗狀細胞非小細胞肺癌患者的主要研究。該研究入組582例患者,隨機接受Nivolumab和多西他賽治療,兩組患者總生存期分別為12.2個月和9.4個月,ORR分別為19%和12%[7]。KEYNOTE-407研究證實,卡鉑+紫杉醇或白蛋白紫杉醇聯合Pembrolizumab一線治療晚期肺鱗狀細胞癌可帶來顯著的生存獲益,Pembrolizumab聯合治療組患者中位總生存期為15.9個月,安慰劑對照組患者中位總生存期為11.3個月,且療效與PD-L1表達水平無關[8]。一項6個隊列、開放標簽、多中心的Ⅰb期研究(NCT02937116),評價信迪利單抗聯合吉西他濱/鉑類治療初期、局部晚期(Ⅲb期)、復發性或轉移性(Ⅳ期)鱗狀細胞非小細胞肺癌的有效性,研究發現,17例患者的ORR為64.7%[9]。本研究中,觀察組36例肺癌患者中1例肺鱗狀細胞癌患者術后經白蛋白紫杉醇聯合信迪利單抗注射液治療6個周期后達到CR,且總生存期大于20個月,其余肺癌患者治療中PR 12例,SD 15例,PD 8例,臨床療效較對照組顯著。
既往一項關于晚期食管癌患者接受Pembrolizumab治療的臨床Ⅰ期試驗表明,ORR為30.4%,穩定率為13.0%,12個月無進展生存率為21.7%[10]。一項關于難治性食管癌采用Nivolumab治療的臨床Ⅱ期試驗表明,治療后ORR為17%,不良反應發生率為2%,無治療相關死亡發生[11]。一項24例肛管鱗狀細胞癌患者采用Pembrolizumab治療的研究發現,DCR為58%,有16例患者出現惡心、腹瀉等藥物相關不良反應,未發生藥物相關死亡[12]。一項關于晚期肝細胞肝癌患者采用Nivolumab治療的臨床Ⅰ/Ⅱ期試驗則表明,治療后CR率為5%,PR率為18%,SD率為46%[13]。Nivolumab于2017年8月被美國食品藥品管理局批準用于DNA錯配修復缺陷/微衛星高度不穩定轉移性結直腸癌患者的治療。本研究入組消化系統腫瘤患者共24例,觀察組中PR 8例,SD 9例,PD 6例,對于晚期消化系統腫瘤的治療,免疫治療聯合化療較單純化療或靶向治療有更好的臨床療效。
一項將PD-L1單抗Atezolizumb用于鉑類化療失敗后的局部進展或轉移性尿路上皮癌的臨床研究顯示,全組患者ORR為15%,其中CR率為5%[14]。本研究8例尿路上皮癌患者接受化療聯合信迪利單抗注射液治療,其中CR 0例,PR 3例,SD 3例,PD 2例,本研究觀察組患者ORR及DCR均高于對照組,總體療效較好。
PD-1抑制劑在取得顯著療效的同時也會引起免疫相關不良反應。一項關于Nivolumab一線治療后進展的腎癌隨機Ⅱ期臨床試驗中,最常見的治療相關不良事件是疲勞(35%),11%的患者出現3~4級不良反應[16]。ORIENT-1研究結果表明,信迪利單抗單藥的安全性與Pembrolizumab、Nivolumab相似,未見預期外的不良反應發生[17]。本研究中60.3%發生G1~G2級不良反應,G3級不良反應發生率為11.8%,其中21例出現乏力,均為G1~G2級;9例出現消化系統癥狀,主要表現為納差、惡心、腹瀉,其中1例出現G3級惡心癥狀;5例出現甲狀腺功能異常,其中1例為G3級甲狀腺功能減退;3例出現轉氨酶升高,1例為G3級轉氨酶升高;3例出現血液學毒性,其中2例為G3級血小板減少;不良反應經對癥治療均取得控制,總體不良反應可控。
綜上所述,信迪利單抗注射液聯合治療用于多線治療后無標準治療的晚期惡性腫瘤患者,療效尚可,不良反應可耐受,患者經濟壓力小。本研究樣本量小,信迪利單抗注射液免疫治療的療效與不良反應仍需大規模的臨床試驗進行驗證。

