替格瑞洛中7個異構體的毒理評價及含量測定研究
漆欣筑,祝晶,何劼毅,聶鵬
(貴州省食品藥品檢驗所,貴州 貴陽 550004)
替格瑞洛是一種新型環戊基三唑嘧啶類口服抗血小板藥物,可通過激活P2Y12受體,可逆性地阻滯ADP介導的血小板活化和聚集,有效抑制動脈粥樣硬化[1-3]。國際多中心PLATO 研究結果顯示,替格瑞洛彌補了氯吡格雷抗血小板作用起效慢、個體差異性大等不足[4]。替格瑞洛于2010年12月由阿斯利康公司率先研制而成,2011年獲美國食品藥品監督管理局(FDA)批準用于急性冠狀動脈綜合征的治療[5]。替格瑞洛結構式為(1S,2S,3R,5S)-3-(7-{[(1R,2S) -2-(3,4-二氟苯基)環丙基]氨基}-5-(硫丙基) -3H-(1,2,3)三唑( 4,5-d)嘧啶-3-基) -5-(2-羥基乙氧基)環戊烷-1,2-二醇[6],具有6個不對稱手性中心[7],理論上將可能產生64種對映異構體[8],但在實際合成過程中,只存在7種含量相對較大的異構體(見圖1)。
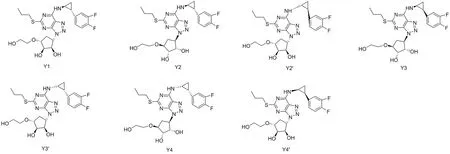
圖1 替格瑞洛各異構體
目前替格瑞洛已在全球超過85個國家獲批上市,于2012年在中國獲批上市。截至目前,該藥在產廠家共有22家,共計40個批文,國內共有8家生產企業自擬了相關檢驗標準。由于各企業的合成方法和生產環節不一致,其控制的檢驗項目和限定參數均存在較大差異,其中僅有兩個廠家對異構體的含量進行了控制。我們從臨床用藥安全的角度出發,認為有必要對該系列異構體的毒性進行全面評價,同時構建7個異構體的統一檢驗分析方法,并對其進行方法學試驗研究;最后,基于我們建立的分析方法,對目前中國市場上在售的8個廠家生產的共計179批次替格瑞洛片的異構體進行含量分析。
1 軟件、儀器與試藥
1.1 軟件版本 ADMET 性質預測軟件ADMET PredictorTM(Version 10.0,美國Simulations Plus公司);Gastroplus數據庫(Version 9.8.2000)。
1.2 儀器 高效液相色譜儀(型號:e2695,美國Waters公司);XS-205型電子分析天平(瑞士梅特勒公司);超聲儀(型號:KQ-500DE,昆山市超聲儀器有限公司);純水機(UPL-I-30EZ,四川優普超純科技有限公司)。
1.3 試藥試劑 乙腈(批號:20025138,美國TEDIA試劑公司);甲醇(批號:21015240,美國TEDIA試劑公司);正己烷(批號:160830,昌泰興業有限公司);無水乙醇(批號:210302,天津市科密歐化學試劑有限公司);三氟乙酸(批號:20210503,天津市科密歐化學試劑有限公司);替格瑞洛對照品(批號:430050-202101,中國食品藥品檢定研究院);替格瑞洛7個異構體對照品均來源于Sinco Pharmachem;自制超純水。
2 方法與結果
2.1 毒理預測結果 從總體情況看,替格瑞洛該系列異構體的毒性預測打分均低于2.0,即毒性較小。但各異構體生不良反應的可能性都較高,應注意控制劑量,最大推薦治療劑量MaxRTD(針對一般成年人體)需低于3.16 mg·(kg·d)-1。該系列異構體在環境毒性、內分泌毒性、心臟毒性、急性毒性、基因毒性方面均無相關毒性。過敏性預測方面,均無呼吸過敏性。致癌性預測方面(Rat TD50和Mouse TD50),均有產生小鼠致癌性的可能。生殖毒性預測方面(Repro Tox),異構體Y2有產生生殖毒性的可能性。肝臟不良反應預測方面,各雜質均有潛在的肝臟毒性(見表1)。
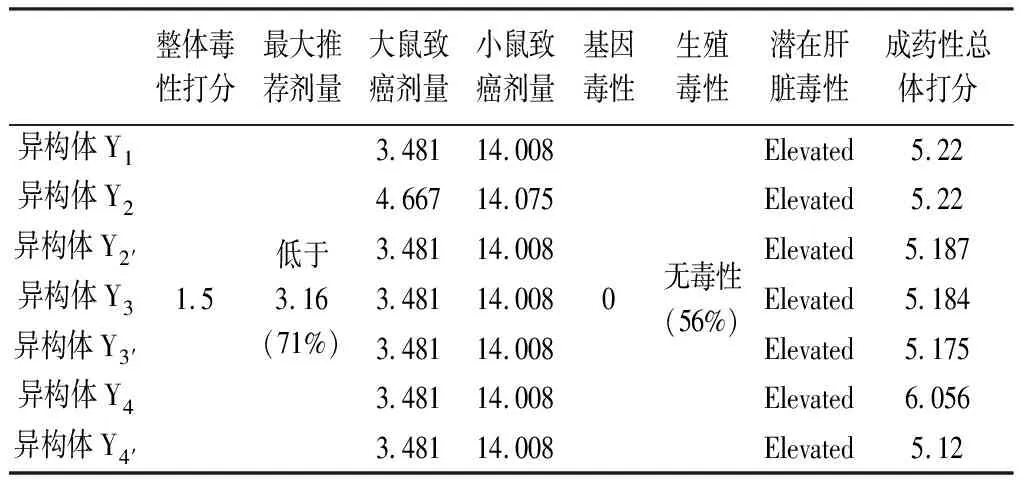
表1 異構體毒理評價預測結果
2.2 常規檢驗 本次涉及的8個廠家中,只有兩個廠家(廠家A與廠家B)的檢驗標準對制劑中的異構體含量進行了控制。其中廠家A控制了Y1和Y2(限度均為≤0.2%),廠家B控制Y1、Y2和Y2′(限度Y1≤0.2%,Y2+Y2′≤0.2%)。有5個廠家(廠家C、D、E、F、G)的原料藥為自己合成,其中兩家企業在原料藥標準中對異構體的含量進行了控制,各廠家原料藥標準中異構體的含量控制具體情況見表2。

表2 各廠家原料藥中異構體控制情況
2.3 方法學驗證試驗 在含量測定的檢驗項目中,用異構體對照品進行試驗,檢測異構體是否會在檢驗條件下,影響替格瑞洛主峰的含量。結果表示在各廠家相應標準的含量測定條件下,異構體Y1、Y2和Y2′和主峰的出峰時間一致,其含量會影響主藥的含量控制。異構體Y3、Y3′、Y4、Y4′和主峰可以分開。
2.3.1 色譜條件 儀器及色譜條件:儀器:高效液相色譜儀Waters e2695,色譜柱:Chiralpak AD-H,流動相:正己烷∶無水乙醇∶三氟乙酸(85∶15∶0.2),檢測波長:255 nm,柱溫:40 ℃,流速:1.0 mol·L-1,進樣量:10 μL。
2.3.2 溶液配制 系統適應性溶液的配制:分別取替格瑞洛對照品和7個異構體對照品適量,用無水乙醇溶解并制成每1 mL含各異構體均為10 μg,替格瑞洛為2.0 mg的混合溶液。作為系統適應性溶液。
供試品溶液的配制:取本品細粉適量(約含替格瑞洛50 mg),置100 mL容量瓶中,用無水乙醇溶解并稀釋至刻度,搖勻,過濾,取續濾液作為供試品溶液。
對照溶液的配制:取供試品續濾液1 mL至200 mL,用無水乙醇溶解并稀釋至刻度,搖勻,即得對照溶液。
2.3.3 專屬性試驗 系統適應性結果:各成分出峰順序依次為:Y4、Y3′、Y3、替格瑞洛、Y2′、Y2、Y4′、Y1。各峰之間且與主峰之間分離度符合要求,空白溶劑無干擾(見圖2)。
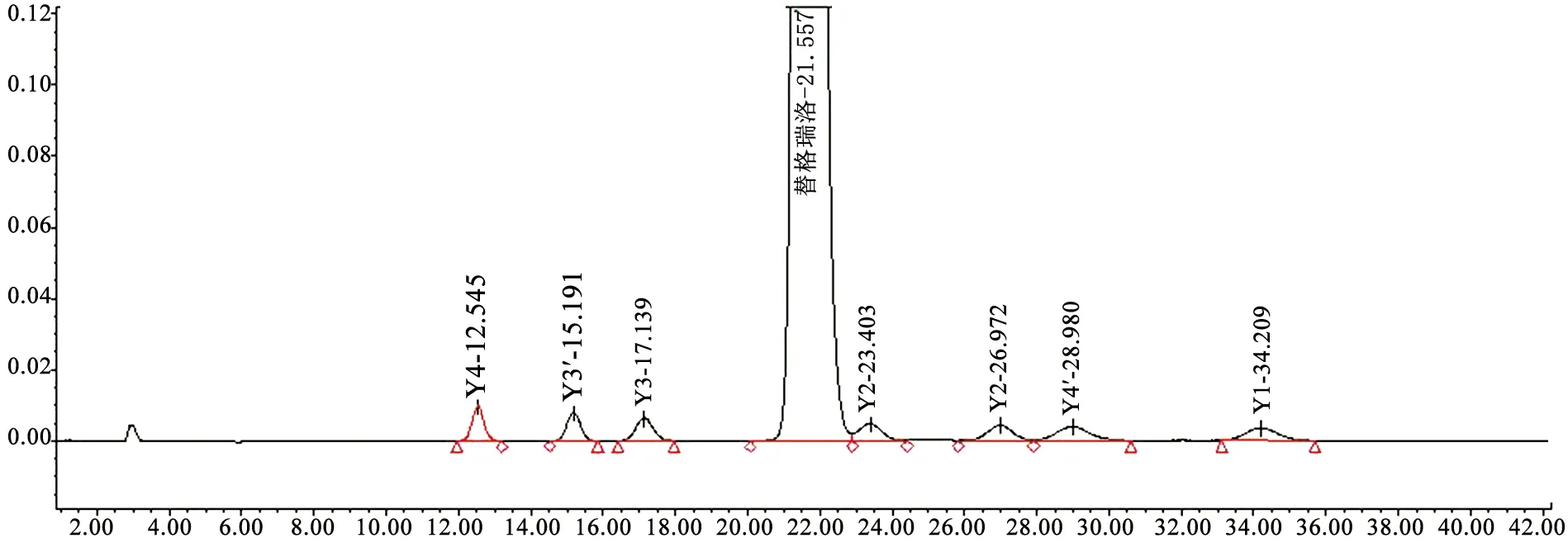
圖2 系統適用性圖譜
2.3.4 檢測限及定量限試驗 定量限:各取異構體對照品適量,用無水乙醇溶解并稀釋成每1 mL中約含各異構體均為2 μg的溶液,調整進樣量,得各異構體的定量限和檢出限。此檢驗方法能滿足含量0.001%的異構體檢驗(見表3)。
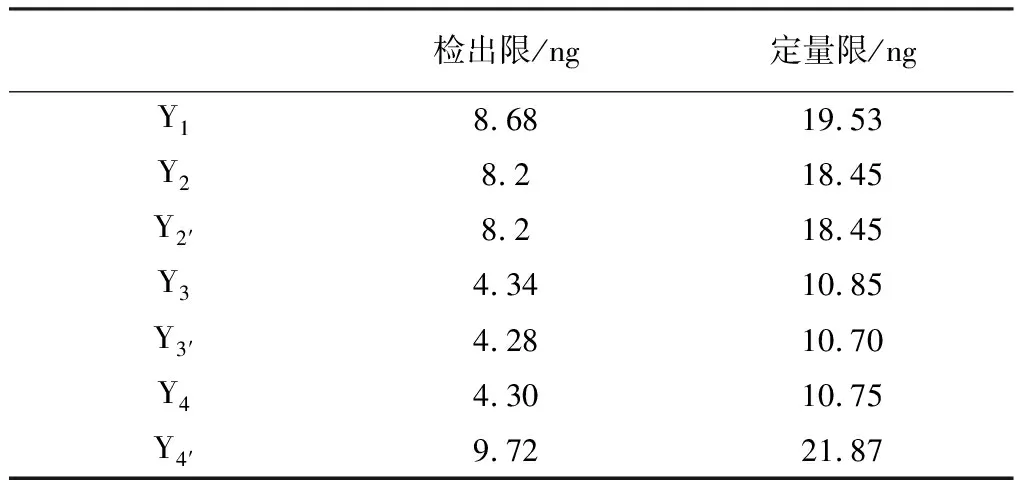
表3 各異構體檢出限及定量限
2.3.5 異構體含量分析 經本方法檢測,8個廠家179批樣品中,其中廠家C、D、E、F、G、H的樣品中均未檢出,廠家A樣品中檢出Y2,廠家B樣品中檢出Y1、Y2(見表4)。廠家A與廠家B的3批次樣品檢驗結果與常規檢驗結果基本一致(見表5~6)。
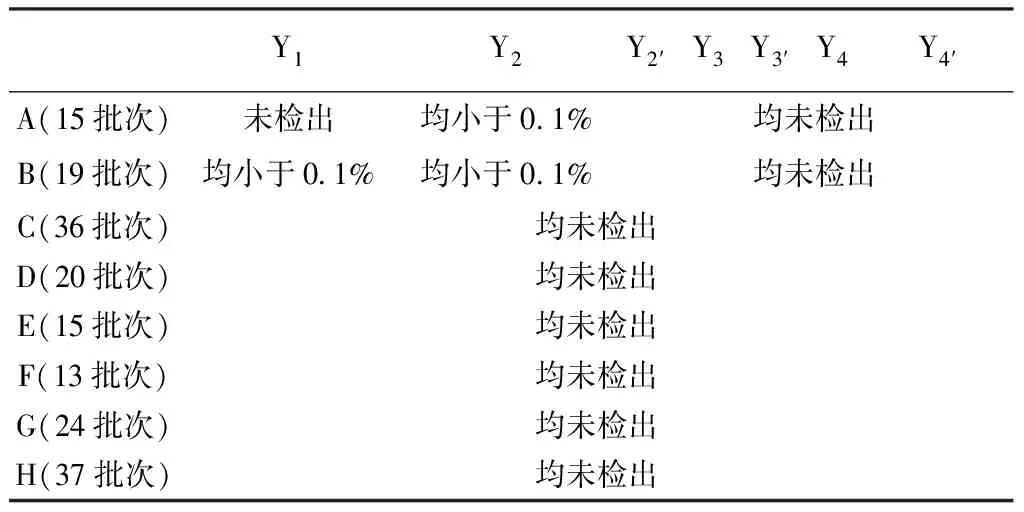
表4 各異構體含量

表5 廠家A 3批次樣品中的異構體含量
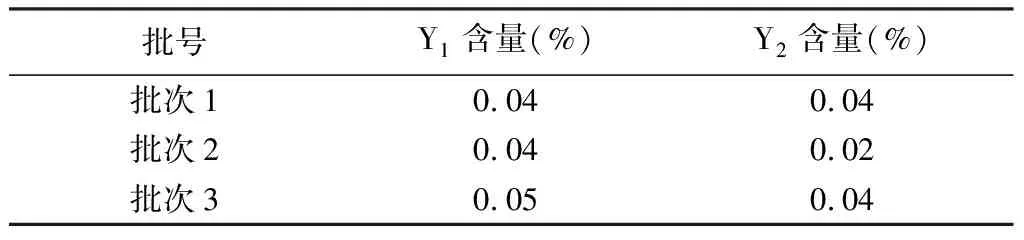
表6 廠家B 3批次樣品中的異構體含量
3 討論
根據ICH M7指導原則的要求,對于藥物中雜質的毒理學研究,除采用試驗數據外,同時也認可(定量)構效關系[(Q)SAR]評價結果。按照指導原則的要求,對于藥物的遺傳毒性雜質,我們主要關注其致突變性。ADMET predictor分析結果顯示,替格瑞洛的各異構體均存在不良反應的可能性和肝臟毒性,建議各藥品生產企業嚴格控制該藥品攝入量。同時,各異構體均存在引起心臟毒性和小鼠致癌的可能性,異構體Y2可能存在生殖毒性。基于ICH M7的要求,我們有必要對該系列異構體進行研究和控制。但ADMET predictor在對藥物毒性進行分析時,主要是基于該藥物化學結構中是否存在相關的毒性警示結構,因此使用該軟件在對同分異構體進行毒性分析時,并不能完全區分異構體間的不同的毒性。因此,建議藥品生產企業深入研究該系列異構體的毒理學研究,重點關注相關異構體和不良反應癥狀之間的關聯、動物實驗中動物給藥量與腫瘤生成的內在聯系,論證異構體控制的必要性和相關限度。
通過該高效液相方法,替格瑞洛相關異構體與主峰和其他雜質峰分離度良好,能在同一條件同一系統里區分該7個異構體與主成分,專屬性強。該系列異構體的檢測限為4~8 ng,定量限為10~16 ng,能有效辨別異構體的種類和分析藥品中各異構體的含量。該方法專屬性強、操作簡單、檢驗效率高。經本方法檢驗,企業B檢出異構體Y1,企業A、B檢出異構體Y2,各異構體的含量低于限度(0.1%),均在可控范圍內,其結果為符合規定,其他企業未檢出有關異構體。各企業的多批次樣品的結果偏差也較小,產品穩定性均較好,檢驗同一廠家的三批次藥品,其Y1、Y2含量的偏差均較小,說明該系列企業的合成路徑設置均較為合理,分離純化方法也較為徹底,能有效地去除原料藥中的相關異構體雜質。按此方法檢驗,可有效地辨別和測定該藥品的相關異構體,為高效檢驗和控制該藥品的質量提供了方法借鑒和數據支撐。

