23價肺炎球菌多糖疫苗與預灌封注射器的相容性研究
摘 要 目的:評估肺炎球菌疫苗產品與預灌封注射器的相容性。方法:根據肺炎球菌疫苗產品的性質,選擇3種提取溶劑(酸性緩沖液、堿性緩沖液、極性溶劑)對其包材(預灌封注射器)進行提取,對提取液中的元素、不揮發性物質、揮發性/半揮發性物質、揮發性物質的含量以及特殊化合物進行分析測試;并通過玻璃內表面實驗考查玻璃脫片情況。結果:提取液中檢測出Al、Si、W元素和有機物丙酮,但其含量均遠低于每日允許最大曝露量(PDE);特殊化合物未有檢出,玻璃內表面無脫片現象。結論:初步評估結果表明肺炎球菌疫苗產品與預灌封注射器可良好地相容。
關鍵詞 肺炎球菌疫苗 預灌封注射器 相容性 可提取物研究
中圖分類號:R945 文獻標志碼:A 文章編號:1006-1533(2022)11-0068-04
引用本文 蔣純. 23價肺炎球菌多糖疫苗與預灌封注射器的相容性研究[J]. 上海醫藥, 2022, 43(11): 68-71.
Compatibility study of 23-valent pneumococcal polysaccharide vaccine and prefilled syringe
JIANG Chun
(ICAS Testing Technology Service (Shanghai) Co., Ltd., Shanghai 201702, China)
ABSTRACT Objective: To evaluate the compatibility between pneumococcal vaccine product and its prefilled syringes. Methods: Three solvents (acid buffer, alkaline buffer, polar solvent) were selected to extract the packaging material (prefilled syringe) based on the property of 23-valent pneumococcal polysaccharide vaccine. The contents of elements, non-volatile substances, volatile/semi-volatile substances, volatile substances and the special compounds in the extracts were determined and the peeling of glass was examined by the experiment of the glass inner surface. Results: Element Al, Si and W and organic acetone were detected in the extracts, but all were far below the maximum daily permissible exposure (PDE). Special compounds were not detected and peeling phenomenon on the glass inner surface was not observed. Conclusion: The pneumococcal vaccine products have good compatibility with prefilled syringes.
KEY WORDS pneumococcal vaccine; prefilled syringe; compatibility; analysis of extractables
1983年,23價肺炎球菌多糖疫苗研制成功[1],用于免疫預防肺炎鏈球菌引起的肺炎疾病,其對肺炎球菌引起的肺炎具有非常好的預防功效,據研究表明其覆蓋率可達到85%~90%。免疫力低下的人群和老年人群是肺炎的多發人群,所以本品對于這類人群的應用占據了很大比例[2]。
預灌封注射器是一種新型的藥品包裝,它同時具有儲存和注射的功能,相對于傳統的一次性使用無菌塑料注射器,能極大地降低生產與使用的人力和成本,并降低藥品在使用過程中被污染的可能性,近幾年越來越多地被運用到臨床中,尤其更多地被運用到疫苗的包裝中[3]。
本產品為一種肺炎多糖疫苗,屬于無需配伍就可直接使用的注射藥品,這種預灌封藥品包裝材料為這類藥品的使用提供了便捷與安全。預灌封注射器由玻璃針筒、推桿、護帽以及活塞組成,包含了玻璃和彈性體等材質,這些材質為藥品的一級包裝,會直接接觸到藥品,材料中的各類添加劑、殘留物等可能會浸出到產品中,從而對人體產生危害[4-5]。所以,須對藥品和包裝材料的相容性進行研究[6]。相容性研究的第一步就是對預灌封注射器中可能會出現的物質有一個全面的了解,其中最重要的研究就是在對生產中的添加劑種類了解的基礎上進行有目的的可提取物研究,從而將預灌封注射器中可能遷移到藥液中的物質的范圍縮小到一個可定量、定性研究的范圍。
美國FDA、歐洲EMEA以及產品質量研究協會(PQRI)等各國各地區的權威機構頒布了各項條例和指南,用來指導、規范藥品與包裝材料相容性研究。隨著這些規范在國外發達國家的深入執行,我國藥品監督管理機構在近十年內也陸續頒布了藥物與塑料、玻璃、彈性體密封件、生產系統的相容性指導原則。我們根據這一系列的指南進行實驗的設計。
1 材料和方法
1.1 儀器
1290/6470的液相色譜-質譜(LC-MS)、7890B/ 7000D Triple Quad的氣相色譜-質譜(GC-MS)和GC 7890B/5977B MSD/7697A HS的頂空氣相色譜-質譜(HS-GCMS)(Agilent公司); NexIon1000的電感耦合等離子體-質譜(ICP-MS)(Perkin Elmer公司)。
1.2 提取液制備
選擇的三種提取溶劑分別為A:氯化鉀溶液(0.2 mol/L,pH 3.0±0.1);B:磷酸鹽溶液(0.2 mol/L,pH 10.0±0.1);C:乙醇水溶液(20%)。取30支預灌封注射器(寧波正力藥品包裝有限公司),每支加入提取液溶劑A 1 mL,用鋁箔紙密封后放入烘箱中,55 ℃的溫度下提取72 h,取出冷卻后待測記作提取液A;同法用提取溶劑B、C制備提取液B、C;另外取各提取溶劑30 mL于聚四氟乙烯瓶中與樣品同法操作后作為對照空白。
本疫苗產品含有氯化鈉溶液0.76%~1.00%,pH為6.0~7.5,提取溶劑的pH為3和10,嚴苛于藥品pH,提取液C為20%的乙醇水溶液,其有機相的比例高于本藥品,本產品于2~8 ℃避光儲存運輸,參考ISO10993-12,浸提條件溫度為55 ℃嚴格于臨床使用條件。
1.3 分析評價閾值
遺傳毒性致癌物的安全性閾值(SCT)為歐洲藥品局推薦的1.5 mg/d,即低于該值的化合物無論致癌與否,都可認為化合物不會對人體產生危害。根據用藥劑量等可以將SCT換算成特定包裝容器中可提取物的分析評價閾值(analytical evaluation threshold,AET),以便于直觀地對特定藥物進行分析。當某一化合物被檢出超過AET值時,會將其報告出來,并進行鑒定,評估;反之則不對此化合物進行報告。換言之,本研究只報告超出 AET值的化合物。
由于可提取物的檢測為單點加標的半定量方法,并且考慮到不同化合物之間結構的差異從而會導致響應因子的不同,因此在計算AET值的時候,設置50%的不確定度。
根據化學藥品與彈性體密封件相容性研究技術指導原則,本研究中藥品每日最大用藥量為1支,故有機物AET=SCT(1.5 mg/d)÷每日最大用藥量(1支/天)×不確定度(50%)=0.75 mg/支。
1.4 樣品制備
1.4.1 元素測試樣品制備
1)定量限(LOQ) B、Mg、Si、Ca為50 ng/mL;V、Co、Ni、As、Cd、Hg、Pb為1.0 ng/mL;其他元素為5.0 ng/mL,回收率滿足70%~150%。
2)樣品制備 移取提取液A、B各1.0 mL于不同容量瓶中,用4%硝酸定容至25 mL;同法制備空白對照[7]。
1.4.2 不揮發性有機物測試樣品制備
1)定量限 0.05 mg/mL的混標[三苯基氧化膦(TPPO)、抗氧劑XH-245(C34H50O8)、促進劑DT(C15H17N3)、雙酚M(C24H26O2)、促進劑DETU(C5H12N2S)和全氟辛酸]為代表性物質,滿足信噪比(S/N)≥10。
2)樣品溶液 取A、B、C各5 mL于分液漏斗中,用二氯甲烷(DCM)5 mL萃取,取下層有機相;再用DCM 5 mL重復萃取1次,合并有機相,用氮氣吹干,用50%甲醇溶液5 mL復溶成樣品溶液。同法制備平行樣品和空白對照[8]。
1.4.3 揮發性/半揮發性有機物測試樣品制備
1)定量限 0.1 mg/mL的混標(十甲基環五硅氧烷、2,6-二叔丁基-4-甲基苯酚(BHT)、四氯乙烯、鄰苯二甲酸二異丁酯(DIBP)、二苯胺、氘代萘、氘代苊和氘代屈)為代表性物質,滿足S/N≥10。
2)樣品溶液 取提取液A、B、C各5 mL于不同分液漏斗中,加入內標溶液(40 mg/mL)25 mL,加DCM 5 mL萃取后取有機相;再用DCM 5 mL重復萃取1次;合并有機相后加入適量無水硫酸鈉除水,氮氣吹至1 mL刻度以下,加DCM定容至1.0 mL作為樣品溶液。同法制備平行樣品和空白對照[9]。
1.4.4 揮發性有機物測試樣品制備
1)定量限 0.1 mg/mL,滿足S/N≥10。
2)樣品 取1套預灌封注射器中的組件活塞和護帽,放入同一頂空瓶中。以空頂空瓶為空白對照[10]。
1.4.5 玻璃內表面測試樣品制備
1)陰性對照樣品 未經提取液提取的預灌封注射器樣品。
2)陽性對照樣品 用氫氧化鈉溶液(0.5 mol/L)于105 ℃提取4 h的預灌封注射器樣品。
3)提取樣品 在55 ℃下經提取液A、B提取72 h的預灌封注射器樣品。
1.4.6 2-巰基苯并噻唑(2-MBT)測試樣品制備
1)定量限 即線性低點溶液(10 ng/mL),滿足S/N≥10。
2)樣品制備 將彈性體剪成小塊,取1.0 g于玻璃容器中,加入甲醇4.0 mL,加蓋密封后常溫下超聲30 min,搖勻,取上清作為樣品液。同法制備平行樣品液及空白對照。
1.4.7 N-亞硝胺類物質測試樣品制備
1)定量限 即線性低點溶液(10 ng/mL),滿足S/N≥10。
2)樣品制備 將彈性體剪成小塊,取2.0 g置于容器中,加入甲醇2.0 mL,加蓋密封后室溫下超聲30 min,取上清作為樣品液。同法制備平行樣品液及空白對照。
1.4.8 多環芳烴類物質測試樣品制備
1)定量限 線性低點溶液(50 ng/mL),滿足S/N≥10。
2)樣品制備 將彈性體剪成小塊,稱取2.0 g置于玻璃瓶中,加入甲醇2.5 mL(含0.1 mg/mL內標),加蓋密封后在60 ℃下超聲60 min作為樣品液。同法制備平行樣品液及空白對照。
1.5 分析方法
1)ICP-MS 掃描模式:跳峰(Peak Hopping);保壓時間:50.0 ms;模式:動能歧視模式(KED)。
2)HPLC-MS 色譜柱:Zorbax SB-aq 3.0 mm×100 mm,3.5 mm;進樣量:5 mL;柱溫:40 ℃;流速:0.45 mL/min;質譜掃描模式:單離子檢測掃描(SIM)。洗脫程序:時間(min):0→5.5→24→29→29.5→33,對應的流動相A(5 mmol/L乙酸銨)(%):90→27→0→0→90→90、流動相B(甲醇)(%):10→73→100→100→10→10。
3)GC-MS 色譜柱:HP-5MS UI (30 m×250 μm×0.25 mm);進樣量:1 mL;進樣口溫度:300 ℃;四級桿溫度:150 ℃;流速:1.5 mL/min;質譜掃描模式:全掃描模式[Scan(45~550)]。升溫程序:初始溫度40 ℃,保持5 min;20 ℃/min至240 ℃,保持5 min;10 ℃/min至310 ℃,保持10 min。
4)HSGC-MS色譜柱:DB-624,30 m×250 μm×1.4 mm;載氣:He;進樣時間:0.5 min;保溫箱溫度:90 ℃;四級桿溫度:150 ℃;GC循環時間:46 min;流速:1.2 mL/min;質譜掃描模式:Scan(35~250)。升溫程序:40℃保持2 min;2.5 ℃/min至100 ℃;10 ℃/min至240 ℃;
2 結果
2.1 元素掃描(ICP-MS)測試
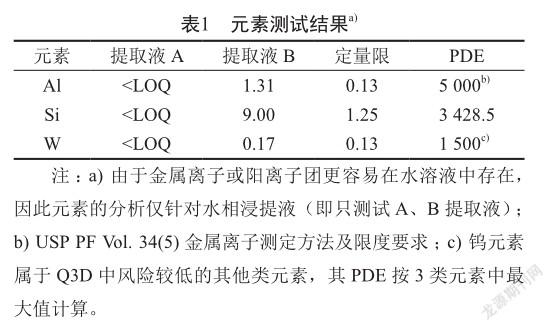
檢測結果表明,提取液B中僅Al、Si、W三種元素的含量超出了定量限,但均未超出其PDE值(見ICH Q3D:元素雜質指導原則);而在提取液A中他們的含量均小于定量限(表1)。
2.2 小分子揮發物HSGC-MS全掃測試
檢測結果表明,樣品中檢測到丙酮(檢出值8.00 mg/支)大于AET值(0.75 mg/支),但小于其PDE限值(50 000 mg/支)。
2.3 玻璃內表面測試
對陰性對照樣品和提取樣品進行掃描電子顯微鏡(SEM)觀察均未發現玻璃內表面侵蝕脫片現象,而陽性對照樣品發現侵蝕脫片現象,此陽性侵蝕脫片圖可為浸出實驗提供參考。
2-MBT測試結果表明,樣品中未檢測到超出定量限2-MBT;N-亞硝胺類物質和多環芳烴類物質測試結果表明,樣品中未檢測到超出定量限的目標化合物。
2.4 不揮發性有機物HPLC-MS和揮發性/半揮發性有機物GC-MS測試
檢測結果表明,提取液中均未檢測到大于AET值的物質。
3 討論
用3種提取溶劑(酸、堿、有機溶劑)對預灌封注射器組合件進行提取,對提取液進行元素和有機物的測試,共檢測出的元素有Al、Si、W,但含量均未超過PDE值;有機化合物雖然檢出丙酮含量大于AET值,但遠未超出其PDE限值。
藥用玻璃中通常包含三氧化二鋁、二氧化硅等成分,本研究中檢出的元素Al、Si可能來自于這些成分,由于預灌封注射器的針頭是用鎢針插入玻璃針筒中制成的,所以鎢(W)元素常殘留于預灌封注射器中,丙酮是橡膠中常見的殘留溶劑。
根據對提取物質及其PDE值的分析,從而對23價肺炎球菌多糖疫苗產品與包裝材料-預灌封注射器的相容性進行初步的安全風險評估,可以看出該包材的安全性較高,風險度較低,可進行下一步浸出物研究。另外可預測潛在的浸出物為元素Al、Si、W以及丙酮,再結合ICH Q3D、包材配方以及各指導原則來進一步確認所要考察的浸出物種類。
參考文獻
[1] Pneumococcal conjugate vaccine for childhood immunization WHO position paper[J]. Wkly Epidem Rec, 2007, 82(12): 93-104.
[2] 韓菲, 曹欣, 胡鵬, 等. 23價肺炎鏈球菌莢膜多糖疫苗的研制[J]. 國際生物制品學雜志, 2010, 33(3): 134-138.
[3] 蔡榮. 預灌封注射器簡介[J]. 上海包裝, 2006(2): 19-20.
[4] 何子騫. 藥品包裝材料對藥品質量的影響[J]. 生物化工, 2020, 6(2): 112-114.
[5] 張芳艷, 趙欣欣, 余萍. 藥品包裝材料存在的問題及其對用藥安全的影響[J]. 中國藥業, 2012, 21(16): 10-12.
[6] 方旻, 梁伊琳, 謝新藝, 等. 藥品包裝與藥品的相容性研究進展[J]. 中國包裝, 2018, 38(7): 78-81.
[7] 武靜文. 金屬元素檢測技術在藥包材常規檢測、相容性研究中的應用及探討[J]. 中國醫藥導刊, 2020, 22(5): 331-335.
[8] 李春煥, 薛維麗, 邢晟, 等. 高效液相色譜法檢測溴化丁基膠塞中11種抗氧劑及游離硫的浸出量及遷移量[J].分析實驗室, 2020, 39(1): 91-96.
[9] 索玲喆, 于祥勇, 徐健峰, 等. GC-MS法應用于膠塞與疫苗注射液的包材相容性[J]. 沈陽藥科大學學報, 2019, 36(9): 805-811.
[10] 趙霞, 胡昌勤, 金少鴻. 藥用丁基膠塞中易揮發性成分的成分分析[J]. 藥物分析雜志, 2006, 26(3): 315-318.

