基于主要活性成分的白子菜葉干燥方式及采收時間研究
武英茹 李媛媛 李寧 郭丁丁 郭福貴 蘭子君 趙琳儒 倪艷

關鍵詞白子菜葉;干燥方式;采收時間;水溶性浸出物;總黃酮;多糖;紫云英苷;含量測定
白子菜Gynura divaricata(L.)DC.為菊科菊三七屬多年生草本植物,又名雞菜、白東楓、大肥牛、白背三七、白子草,主要分布于我國浙江、廣東、廣西、四川、福建及云南等地。其葉味咸、微辛,性寒[1],于夏、秋兩季采收,曬干或晾干。《中藥大辭典(上冊)》記載,白子菜能清熱、舒筋、止血、祛瘀,可治百日咳、風濕痛、骨折、創傷出血、癰腫瘡癤等[1]。現代研究表明,白子菜中主要含有黃酮及黃酮苷類、多糖類、生物堿類、揮發油等化學成分[2],其中黃酮類和多糖類成分具有降血糖、降尿酸、降血脂、抗氧化等藥理作用,是其主要活性成分[3-4]。白子菜現被《福建省中藥材標準(2006 年版)》收錄,但其標準僅有白子菜水分、灰分及總黃酮含量測定項[5],未見白子菜產地加工的相關描述。產地加工是中藥材生產過程中不可缺少的重要環節,可以保障中藥材的品質[6],其相關標準的缺失可能會造成生產過程中有效成分的損失,從而影響藥材質量和療效。
新鮮白子菜葉中水分含量較高(80%~90%),采摘后若不及時干燥或干燥方法不當,則易發生變色或腐爛,從而影響其藥用價值和經濟價值;此外,對于人工栽培的白子菜,不同的采收時間也可能會影響其質量[7-8]。因此,科學規范的采收應充分考慮藥材中有效成分的積累及藥材的生長規律。目前,關于白子菜采收時間和干燥方式的研究較少,雖有學者以總黃酮含量為指標對白子菜的采收時間進行了探討[7],但除含有黃酮類成分外,多糖類成分也是白子菜的主要活性成分[9],加之本課題組前期從白子菜50%乙醇提取物中分離得到了紫云英苷,并證實了該成分具有調節血糖、增強免疫力、抗炎、抗氧化等作用[10-12],故僅以總黃酮為指標進行研究尚不夠全面。基于此,本研究采用2020 年版《中國藥典》(四部)通則“熱浸法”測定白子菜葉中的水溶性浸出物,采用紫外-可見分光光度法測定其中總黃酮及多糖的含量,采用高效液相色譜(high performance liquid chromatography,HPLC)法測定其中紫云英苷的含量,并以這些主要活性成分含量為指標,篩選白子菜葉的最優干燥方式及采收時間,旨在為規范其產地加工及控制其質量提供依據。
1 材料
1.1 主要儀器
本研究所用主要儀器有UltiMate 3000 型HPLC 儀(美國Thermo Fisher Scientific 公司),1100 型HPLC 儀(美國Agilent 公司),SE402F 型十萬分之一電子分析天平[奧豪斯儀器(上海)有限公司],FW-100 型高速萬能粉碎機、HH-1 型電熱恒溫水浴鍋(北京科偉永興儀器有限公司),DZF-6050 型真空干燥箱(南京沃環科技實業有限公司),U-1901 型雙光束紫外-可見分光光度計(北京普析通用儀器有限責任公司),LC-300B 型數控超聲波清洗儀( 山東濟寧魯超超聲設備有限公司),EG720KG4-NA 型微波爐(廣東美的微波電器制造有限公司),LGJ-S20 型冷凍干燥機(北京四環起航科技有限公司)等。
1.2 主要藥品與試劑
D-無水葡萄糖對照品(批號110833-201506,純度≥99.5%)購自國藥集團化學試劑有限公司;蘆丁對照品(批號100080-202012,純度≥91.6%)購自中國食品藥品檢定研究院;紫云英苷對照品(批號PS011379,純度≥98.0%)購自成都普思生物科技股份有限公司;硫酸、苯酚、硝酸鋁、氫氧化鈉、乙腈均為色譜純,無水乙醇、磷酸均為分析純,水為超純水。
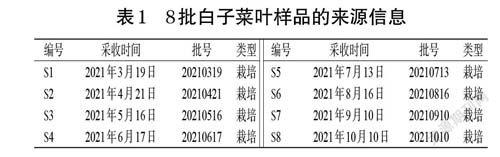
8 批白子菜葉(高15~20 cm的地上部分,取白子菜葉)分別于不同時間采自山西省運城市稷山縣清河鎮稷王農業示范園,經山西省中醫藥研究院倪艷教授鑒定均為菊科菊三七屬多年生草本植物白子菜G. divaricata(L.)DC.的葉。8批白子菜樣品的來源信息見表1。
2 方法與結果
2.1 不同干燥方式樣品的制備
取白子菜葉樣品(編號S1),共7 份,每份50 g,洗凈、攤晾8 h 后,分別經陰干、曬干、烘箱干燥(60、70、80 ℃)、微波干燥及冷凍干燥,均干燥至葉質硬而脆且質量恒定。將干燥后的樣品粉碎,過40 目篩,備用。不同干燥方式及干燥條件見表2。
2.2 不同采收時間樣品的制備
取8 批白子菜葉樣品,每份50 g,洗凈、攤晾8 h 后,于60 ℃干燥至質量恒定,將干燥后的樣品粉碎,過40 目篩,備用。
2.3 水溶性浸出物的測定
參考2020 年版《中國藥典》(四部)通則“2201 浸出物測定法”項下“熱浸法”測定白子菜葉中的水溶性浸出物[13]:取樣品粉末(過50 目篩)2 g,精密稱定,置于250mL錐形瓶中,加水50 mL,密塞,稱定質量,靜置1 h 后,連接冷凝回流管,加熱至沸騰,并保持微沸1 h 后放冷,再次稱定質量,用水補足減失的質量,搖勻,濾過,精密量取濾液25 mL,置于干燥至恒定質量的蒸發皿中,水浴蒸干,于105 ℃干燥3 h 后,置于干燥器中冷卻30 min,迅速精密稱定質量,并按下式計算水溶性浸出物含量(%):水溶性浸出物含量(%)=[(m2-m0)×50]/(25×m1)×100%(式中,m0為蒸發皿質量,m1為供試品質量,m2為干燥后蒸發皿+供試品質量)。每個樣品平行測定3次。
2.4 總黃酮含量的測定
采用紫外-可見分光光度法測定白子菜葉中總黃酮(以蘆丁計)的含量。
2.4.1 線性關系考察精密稱取蘆丁對照品10 mg,加80%乙醇,超聲(功率300 W,頻率25 kHz,下同)溶解并定容至10 mL,搖勻,即得蘆丁質量濃度為1.0 mg/mL的對照品溶液。分別吸取上述對照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,置于25 mL量瓶中,加水至6 mL,加5%亞硝酸鈉溶液1 mL,搖勻,靜置6 min,加10%硝酸鋁溶液1 mL,搖勻,靜置6 min,加4%氫氧化鈉溶液10 mL,以80%乙醇定容,靜置15 min。以80%乙醇為空白對照,使用紫外-可見分光光度計于510 nm波長處測定吸光度[14]。以蘆丁對照品的質量濃度為橫坐標(X)、吸光度為縱坐標(Y)進行線性回歸,得蘆丁的回歸方程為Y=0.478 5X-0.008 5(R 2=0.999 9),表明蘆丁檢測質量濃度的線性范圍為0.008~0.048 mg/mL。
2.4.2 方法學考察(1)取上述蘆丁對照品溶液0.5mL,按“2.4.1”項下方法顯色后于510 nm 波長處連續測定吸光度6 次。結果顯示,蘆丁吸光度的RSD為0.02%(n=6),表明儀器精密度良好。(2)取白子菜葉(編號S1)粉末0.5 g,置于具塞錐形瓶中,加石油醚150 mL,超聲30 min,濾過,揮干石油醚,殘渣加80%乙醇45 mL,超聲30 min,濾過,濾液用80%乙醇定容至50 mL,即得供試品溶液。取上述供試品溶液5.0 mL,置于25 mL 量瓶中,按“2.4.1”項下方法顯色后,分別在室溫下放置0、10、20、30、40、50、60 min 時于510 nm 波長處測定吸光度。結果顯示,蘆丁吸光度的RSD 為2.41%(n=7),表明供試品溶液于室溫下放置60 min 內穩定性良好。(3)取上述供試品溶液(編號S1)5.0 mL,共6 份,按“2.4.1”項下方法顯色后于510 nm波長處測定吸光度并按標準曲線法計算樣品含量。結果顯示,蘆丁含量的RSD為2.83%(n=6),表明方法重復性良好。(4)精密稱取白子菜葉(編號S1)0.5 g,共9 份,分別精密加入一定量的蘆丁對照品溶液,按上述方法制備供試品溶液,再按“2.4.1”項下方法顯色后于510 nm波長處測定吸光度并計算加樣回收率,結果顯示,蘆丁的平均加樣回收率為103.60%(RSD=2.56%,n=9)。
2.4.3 總黃酮含量測定精密稱取待測白子菜葉粉末0.5 g,按“2.4.2(2)”項下方法制備供試品溶液,再按“2.4.1”項下方法顯色后于510 nm波長處測定吸光度并按標準曲線法計算樣品含量。每個樣品平行測定3 次。
2.5 多糖含量的測定
采用紫外-可見分光光度法測定白子菜葉中多糖(以D-無水葡萄糖計)的含量。
2.5.1 線性關系考察精密稱取D-無水葡萄糖對照品10 mg,加80%乙醇,超聲溶解并定容至100 mL,搖勻,即得D-無水葡萄糖質量濃度為0.1 mg/mL 的對照品溶液。分別吸取上述對照品溶液0.2、0.4、0.6、0.8、1.0 mL,置于10 mL試管中,加水至2 mL,加5%苯酚溶液1 mL,搖勻,迅速精密加入濃硫酸5 mL,搖勻,避光靜置15min,取出。以水為空白對照,使用紫外-可見分光光度計于490 nm波長處測定吸光度[14]。以D-無水葡萄糖對照品的質量濃度為橫坐標(X)、吸光度為縱坐標(Y)進行線性回歸,得D-無水葡萄糖的回歸方程為Y=11.458X+0.003(R 2=0.999 6),表明D-無水葡萄糖檢測質量濃度的線性范圍為0.01~0.05 mg/mL。
2.5.2 方法學考察(1)取上述D-無水葡萄糖對照品溶液0.4 mL,按“2.5.1”項下方法顯色后于490 nm波長處連續測定吸光度6 次。結果顯示,D-無水葡萄糖吸光度的RSD為0.02%(n=6),表明儀器精密度良好。(2)取白子菜葉(編號S1)粉末0.5 g,置于錐形瓶中,加80%乙醇100 mL,加熱回流1 h,趁熱濾過,濾渣和濾器經80%乙醇30 mL分3 次洗滌后移至燒瓶中,加水150 mL,加熱回流2 h,趁熱濾過,用少量熱水洗滌濾器,合并濾液及洗液,放冷,用水定容至250 mL,即得供試品溶液。取上述供試品溶液0.5 mL,置于具塞試管中,按“2.5.1”項下方法顯色后,分別在室溫下放置0、10、20、30、40、50、60min 時于490 nm波長處測定吸光度。結果顯示,D-無水葡萄糖吸光度的RSD為2.98%(n=7),表明供試品溶液于室溫下放置60 min 內穩定性良好。(3)取上述供試品溶液(編號S1)0.5 mL,共6 份,按“2.5.1”項下方法顯色后于490 nm波長處測定吸光度并按標準曲線法計算樣品含量。結果顯示,D-無水葡萄糖含量的RSD為3.59%(n=6),表明方法重復性良好。(4)精密稱取白子菜葉(編號S1)0.5 g,共9 份,分別精密加入一定量的D-無水葡萄糖對照品溶液,按上述方法制備供試品溶液,再按“2.5.1”項下方法顯色后于490 nm波長處測定吸光度并計算加樣回收率。結果顯示,D-無水葡萄糖的平均加樣回收率為98.57%(RSD=1.66%,n=9)。
2.5.3 多糖含量測定精密稱取待測白子菜葉粉末0.5g,按“2.5.2(2)”項下方法制備供試品溶液,再按“2.5.1”項下方法顯色后于490 nm波長處測定吸光度并按標準曲線法計算樣品含量。每個樣品平行測定3次。
2.6 紫云英苷含量的測定
采用HPLC法測定白子菜葉中紫云英苷的含量。
2.6.1 色譜條件以Diamonsil C18(2)(4.6 mm× 250mm,5 μm)為色譜柱,以乙腈-0.1%磷酸溶液為流動相進行梯度洗脫(0~6.0 min,10%A→17%A;6.0~7.5 min,17%A→27%A;7.5~11.0 min,27%A→90%A;11.0~15.0 min,90%A→17%A);流速為1.0 mL/min;檢測波長為348 nm;柱溫為35 ℃;進樣量為10 μL。
2.6.2 溶液的制備(1)精密稱取紫云英苷對照品5mg,置于5 mL量瓶中,加甲醇溶解并定容,搖勻,精密移取0.8 mL,用甲醇定容至10 mL,制成紫云英苷質量濃度為0.08 mg/mL 的對照品溶液。(2)取白子菜葉粉末1.0g,精密稱定,置于錐形瓶中,加50%乙醇20 mL,稱定質量,超聲提取30 min,冷卻至室溫,再次稱定質量,用50%乙醇補足減失的質量,經0.45 μm濾膜濾過,取濾液,即得供試品溶液。(3)以50%乙醇為空白對照溶液。
2.6.3 系統適用性試驗精密吸取上述對照品溶液、供試品溶液和空白對照溶液,按“2.6.1”項下色譜條件進樣測定,記錄色譜圖,詳見圖1。由圖1 可知,紫云英苷的分離度大于1.5,理論板數按紫云英苷峰計均大于2 500,空白對照溶液對測定無干擾。
2.6.4 線性關系考察精密吸取“2.6.2(1)”項下對照品溶液1、2、5、10、15、20 μL,按“2.6.1”項下色譜條件進樣測定,記錄峰面積。以紫云英苷對照品的進樣量為橫坐標(X)、峰面積為縱坐標(Y)進行線性回歸,得紫云英苷的回歸方程為Y=35.266X-0.087(R2=0.999 8),表明紫云英苷檢測進樣量的線性范圍為0.08~1.60 μg。
2.6.5 方法學考察(1)精密吸取“2.6.2(1)”項下對照品溶液10 μL,按“2.6.1”項下色譜條件連續進樣測定6次,記錄峰面積。結果顯示,紫云英苷峰面積的RSD為0.59%(n=6),表明儀器精密度良好。(2)精密吸取“2.6.2(2)”項下供試品溶液(編號S1),分別于室溫下放置0、2、4、6、8、12、24 h 時按“2.6.1”項下色譜條件進樣測定,記錄峰面積。結果顯示,紫云英苷峰面積的RSD 為1.76%(n=7),表明供試品溶液于室溫下放置24 h 內穩定性良好。(3)精密稱取白子菜葉(編號S1)1.0 g,共6份,按“2.6.2(2)”項下方法制備供試品溶液,再按“2.6.1”項下色譜條件進樣測定,記錄峰面積并按標準曲線法計算樣品含量。結果顯示,紫云英苷含量的RSD為3.60%(n=6),表明方法重復性良好。(4)精密稱取白子菜葉(編號S1)1.0 g,共9 份,分別精密加入一定量的紫云英苷對照品溶液,按“2.6.2(2)”項下方法制備供試品溶液,再按“2.6.1”項下色譜條件進樣測定,記錄峰面積并計算加樣回收率。結果顯示,紫云英苷的平均加樣回收率為104.65%(RSD=6.91%,n=9)。
2.6.6 紫云英苷含量測定精密稱取待測白子菜葉樣品粉末1.0 g,按“2.6.2(2)”項下方法制備供試品溶液,再按“2.6.1”項下色譜條件進樣測定,記錄峰面積并按標準曲線法計算樣品含量。每個樣品平行測定3次。
2.7 綜合評分的計算
采用層次分析法進行綜合評價。本研究構建的兩兩比較矩陣中,多糖、總黃酮、紫云英苷是發揮臨床作用的物質基礎,其重要性高于水溶性浸出物;多糖、黃酮類成分的抗氧化、抗炎、增強免疫等作用與白子菜具有的清熱涼血、活血止痛功效契合,且總黃酮的作用強于多糖;紫云英苷具有的降血糖、降血脂作用與白子菜的藥理作用相對應[15]。故總黃酮、多糖、紫云英苷及水溶性浸出物含量的相對重要性分別記1、3、5、7 分,矩陣結果見表3。
首先,按上述層次分析法計算各指標成分的權重系數及隨機一致性比率(consistency ratio,CR):CR=CI/RI[ 式中,CI(consistency index)為一致性指標,RI(random consistency index)為隨機一致性指標]。若CR<0.1,表示矩陣具有滿意的一致性,且權重計算正確[15]。
2.8 不同干燥方式對白子菜葉質量的影響
按“2.1”項下方法制備不同干燥方式的白子菜葉樣品,記錄干燥時間并觀察其外觀性狀,分別按“2.3”“2.4.3”“2.5.3”“2.6.6”項下方法測定樣品中水溶性浸出物、總黃酮、多糖、紫云英苷的含量,并按“2.7”項下方法進行綜合評價。采用Excel 2010 軟件錄入數據,利用SPSS 23.0 軟件進行方差分析(下同)。
2.8.1 干燥時間及外觀性狀干燥時間以微波干燥最短,其次為80 ℃烘干,最長為陰干。陰干、微波干燥及冷凍干燥所得白子菜葉均呈深淺不同的綠色,而烘干所得白子菜葉的顏色較深;冷凍干燥所得白子菜葉的葉片平展,最接近鮮葉片,其余干燥方式所得白子菜葉的葉片均存在不同程度皺縮;80 ℃烘干及微波干燥所得白子菜葉有一定香氣且具咸味。結果見表4。
2.8.2 含量測定結果水溶性浸出物含量以曬干、微波干燥、冷凍干燥相對較高且3 種方式無明顯差異,80 ℃烘干最低;總黃酮含量以微波干燥最高,80 ℃烘干最低,且微波干燥明顯高于其他干燥方式;多糖含量以冷凍干燥最高,陰干最低,而冷凍干燥與其他5 種干燥方式(除陰干外)比較均無明顯差異;紫云英苷含量以陰干和微波干燥較高,80 ℃烘干最低,且陰干和微波干燥顯著高于其他干燥方式。結果見表5。
2.8.3 綜合評價按“2.7”項下方法計算得CR為0.043 8(<0.1),總黃酮、多糖、紫云英苷、水溶性浸出物含量的權重系數分別為0.563 8、0.263 4、0.117 8、0.055 0。陰干、曬干、60 ℃烘干、70 ℃烘干、80 ℃烘干、微波干燥、冷凍干燥的綜合評分分別為0.811 8、0.855 8、0.629 5、0.546 1、0.492 8、0.996 3、0.665 4 分,提示微波干燥所得白子菜葉的質量較好。
2.9 不同采收時間對白子菜葉質量的影響
按“2.2”項下方法制備不同采收時間的白子菜葉樣品,分別按“2.3”“2.4.3”“2.5.3”“2.6.6”項下方法測定樣品中水溶性浸出物、總黃酮、多糖、紫云英苷的含量,按“2.7”項下方法進行綜合評價。
2.9.1 含量測定結果水溶性浸出物含量由高到低依次為9 月>8 月>3 月>7 月>6 月>4 月>10 月>5 月,總黃酮含量為8 月>6 月>5 月>7 月>9 月>10 月>4月>3 月,多糖含量為8 月>7 月>9 月>6 月>5 月>4月>10 月>3 月,紫云英苷含量為6 月>5 月≈7 月≈9月>8月>4月≈10月>3 月。結果見表6。
2.9.2 綜合評價按“2.7”項下方法計算得CR為0.043 8(<0.1),總黃酮、多糖、紫云英苷、水溶性浸出物含量的權重系數分別為0.563 8、0.263 4、0.117 8、0.055 0。3~10 月樣品的綜合評分分別為0.658 0、0.752 1、0.937 0、0.962 9、0.965 8、0.988 6、0.929 2、0.808 4 分,提示5~9月采收的白子菜葉質量較好。
3 討論
3.1 實驗條件的優化
本課題組前期參考2020 年版《中國藥典》(一部)[14],分別考察了甲醇、30%乙醇、40%乙醇、50%乙醇、60%乙醇、70%乙醇、80%乙醇等不同提取溶劑及超聲、回流提取對白子菜葉中總黃酮提取率的影響,結果顯示,當以80%乙醇超聲提取時,總黃酮的提取率較高。同時,本課題組參考2020 年版《中國藥典》(一部)[14],對多糖的提取時間進行了考察,結果顯示,回流3 h 的多糖提取率較高。此外,本課題組還分別考察了不同色譜柱[AgilentPoroshell SB-C18(100 mm×2.1 mm,2.7 μm)、DiamonsilC18(2)(4.6 mm× 250 mm,5 μm)] 及不同流動相(乙腈-0.1%磷酸溶液、甲醇-0.1%磷酸溶液),結果顯示,以Diamonsil C18(2)為色譜柱、乙腈-0.1%磷酸溶液為流動相進行梯度洗脫時,所得色譜峰峰形較好,且待測成分峰周圍無雜峰干擾。
3.2 含量測定結果分析
有研究發現,白子菜的水提取物及乙醇提取物具有顯著的降血糖作用[3]。總黃酮及多糖是白子菜降血糖、降血脂的主要活性成分[3,17]。本研究結果顯示,微波干燥所得白子菜葉中水溶性浸出物、總黃酮、多糖及紫云英苷的含量均較高,且微波干燥的時間顯著短于其他干燥方式;80 ℃烘干所得各成分含量變化有所不同;綜合評價結果顯示,微波干燥所得白子菜葉的綜合評分(0.996 3分)最高,表明此法所得白子菜葉樣品質量較好,這與微波干燥有利于保存多糖類、黃酮及黃酮苷類成分的結論一致[18]。8 月采收的白子菜葉中總黃酮、多糖及紫云英苷的含量均較高,3 月采收的白子菜葉中各成分含量均較低,提示不同采收時間樣品中各成分含量存在差異;綜合評價結果顯示,8 月采收白子菜葉的綜合評分(0.988 6 分)最高,除3、4、10 月外,其余采收時間白子菜葉的綜合評分均大于0.90 分,這與白子菜中總黃酮含量以5~9 月較高一致。
綜上所述,微波干燥所得白子菜葉的質量較好,5~9 月采收較優。

