牛蒡子苷減輕脂多糖誘導人鼻咽上皮細胞炎癥損傷的作用
聶發龍 趙顯芳 朱紫陌 江自鮮 代蓉 李秀芳
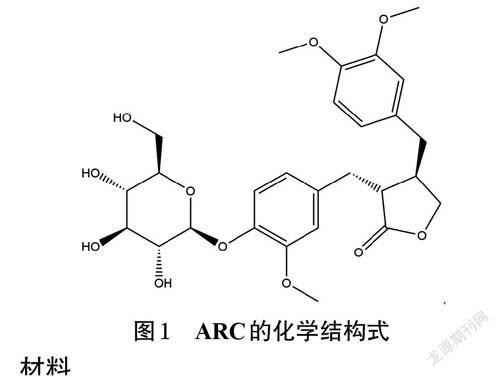


關鍵詞牛蒡子苷;脂多糖;NP-69細胞;炎癥反應;鼻黏膜上皮屏障
上呼吸道感染(upper respiratory tract infection,URTI)是鼻、咽、喉急性炎癥的總稱,是危害人類健康的常見疾病之一,且大多由病毒和細菌感染所致[1-2]。作為與外界直接相連的器官,鼻咽上皮細胞在呼吸時會暴露于空氣當中,容易受到病毒、細菌、真菌等病原微生物攻擊,作為機體防御URTI 的首道屏障,鼻咽上皮細胞對維持上呼吸道的穩定具有重要作用[3]。病原微生物致感染或炎癥信號增強等多種因素的作用會導致鼻黏膜上皮細胞受到損傷并發生功能紊亂,進而易使外界病原體或機會致病菌進入黏膜,最終引發URTI[4]。牛蒡子為菊科植物牛蒡Arctium lappa L.的干燥成熟果實,是中醫臨床治療URTI 的常用藥材,牛蒡子苷(arctiin,ARC,化學結構式見圖1)是其主要活性成分之一[5]。研究發現,ARC具有抗炎、抗病毒、保護肝臟、改善內皮細胞損傷的作用[6-9]。基于ARC在抗炎和保護細胞方面均具有較好的作用,考慮到上皮細胞是先天免疫和炎癥反應的重要參與者之一[10],本課題組推測ARC可能具有改善鼻黏膜上皮細胞炎癥損傷的作用。因此,本研究采用脂多糖(lipopolysaccharide,LPS)刺激人鼻咽上皮細胞NP-69 復制炎癥損傷模型,從抗炎、促進受損上皮細胞遷移等方面探討ARC 對人鼻咽上皮細胞炎癥損傷的改善作用,旨在為后續深入研究ARC在增強鼻黏膜上皮屏障中的作用奠定基礎。
1 材料
1.1 主要儀器
本研究所用的主要儀器包括Infinite M200 Pro 型酶標儀(瑞士Tecan 公司)、311 型二氧化碳(CO2)細胞培養箱(美國Thermo Fisher Scientific 公司)、Ti-S 型倒置顯微鏡(日本Nikon 公司)、Mx3005P 型實時熒光定量聚合酶鏈反應(real-time quantitative polymerase chain reaction,q-PCR)儀(美國Agilent 公司)、Bio Spectrum 型凝膠成像系統(美國Spectrum 公司)、SN310C型高壓蒸汽滅菌器(日本Yamato 公司)、XS125A型分析天平(瑞士Precisa公司)、CF16RX型低溫高速離心機(日本Hitachi 公司)、UPH-III-20T 型超純水系統(四川優普超純科技有限公司)等。
1.2 主要藥品與試劑
ARC對照品(批號LE207100,純度98%)購自北京百靈威科技有限公司;LPS(批號O19M4009V)購自美國Sigma-Aldrich 公司;RPMI 1640 培養基(批號2103012)購自美國Bimake 公司;青鏈霉素雙抗(批號1744939)購自美國Gibco 公司;BCA 蛋白濃度檢測試劑盒(批號P0010)購自上海碧云天生物技術有限公司;MTS細胞增殖試劑盒(批號0000408248)購自美國Promege 公司;一氧化氮(nitric oxide,NO)試劑盒(批號20210727)購自北京索萊寶科技有限公司;人腫瘤壞死因子α(tumor necrosisfactor-α,TNF-α)、白細胞介素6(interleukin-6,IL-6)、IL-1β酶聯免疫吸附測定(enzyme linked immunosorbentassay,ELISA)試劑盒[批號分別為20210105(H052-1-2)、20210105(H007-1-2)、20210105(H002-1-2)]均購自南京建成生物工程研究所;TRIZOL 試劑、RNA逆轉錄試劑盒、胎牛血清(批號分別為15596-018、k1622、1601001)均購自美國Thermo Fisher Scientific 公司;鼠源胞質緊密連接蛋白1(zonula oecludens protein 1,ZO-1)單克隆抗體、鼠源信號轉導及轉錄活化因子3(signal transducerand activator of transcription 3,STAT3)單克隆抗體、鼠源Janus 激酶1(Janus kinase 1,JAK1)單克隆抗體、鼠源β-肌動蛋白(β-actin)單克隆抗體、辣根過氧化物酶標記的山羊抗鼠免疫球蛋白G二抗、靈敏ECL化學發光增強試劑盒(批號分別為21773-1-AP、10003218、10004856、20536-1-AP、SA00001-1、B500023)均購自美國Proteintech公司;鼠源β-防御素3(β-defensins 3,BD3)多克隆抗體(批號GR3207641-3)購自英國Abcam 公司;q-PCR 檢測試劑盒(批號31598800)購自瑞士Roche 公司;其余試劑均為分析純,水為超純水。
1.3 細胞
人鼻咽上皮細胞株NP-69(貨號49415)購自蘇州北納創聯生物技術有限公司。
2 方法
2.1 NP-69 細胞增殖的檢測
取對數生長期的NP-69 細胞,制成細胞懸液,計數并調整細胞密度至4×105個/mL,接種于96 孔培養板中,每孔100 μL。將細胞分為空白組(只加培養基,不加細胞)、正常組(正常培養細胞)、不同濃度(0.000 1、0.001、0.01、0.1、1.0、10 μmol/L[11])ARC組,每組設置6 個復孔。ARC 組細胞加入含相應濃度藥物的完全培養基(即含10%胎牛血清及1%青鏈霉素雙抗的RPMI 1640 培養基,下同),正常組加入完全培養基,于37 ℃、5%CO2條件下培養24 h。每孔加入MTS試劑20 μL,同條件孵育2 h 后,使用酶標儀于490 nm波長處測定各孔的光密度(optical density,OD)值,按下式計算細胞增殖率:細胞增殖率(%)=(實驗組OD值-空白組OD值)/(正常組OD值-空白組OD值)×100%。
2.2 ARC對NP-69 細胞遷移影響的檢測
取對數生長期的NP-69 細胞,制成細胞懸液,計數并調整細胞密度至4×105個/mL,接種于6 孔培養板中,每孔2 mL。將細胞分為正常組和不同濃度(0.01、0.1、1.0 μmol/L,濃度參考“2.1”項下結果設置)ARC組,每組設置3 個復孔。ARC組細胞用含相應濃度藥物的完全培養基培養24 h,正常組用完全培養基培養24 h。用無菌槍頭在皿底作等寬的直線劃痕,并用無菌磷酸鹽緩沖液(PBS)清洗3 次。分別在同條件培養0、24 h 時于倒置顯微鏡下觀察、拍照并采集圖片,采用Image J V1.8.0 軟件分析劃痕寬度并計算細胞遷移率:細胞遷移率(%)=(0 h 劃痕寬度-24 h 劃痕寬度)/0 h 劃痕寬度×100%。
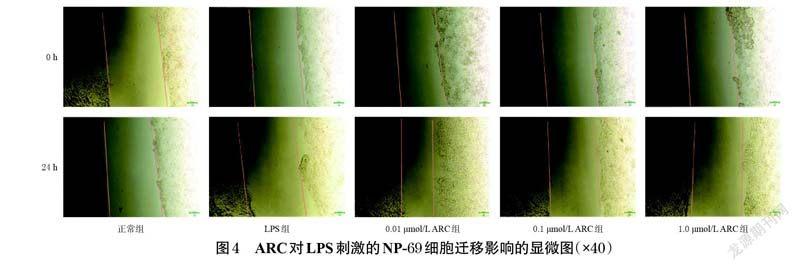
2.3 ARC對LPS刺激的NP-69細胞遷移影響的檢測
取對數生長期的NP-69 細胞,制成細胞懸液,計數并調整細胞密度至4×105個/mL,接種于6 孔培養板中,每孔2 mL。同條件培養至細胞鋪滿孔板底部。將細胞分為正常組、LPS 組(1.0 μg/mL[11])和不同濃度(0.01、0.1、1.0 μmol/L,濃度參考“2.1”項下結果設置)ARC組,每組設置3 個復孔。ARC組細胞用含相應濃度藥物的完全培養基培養24 h,正常組和LPS 組用完全培養基培養24 h;隨后,ARC 組和LPS 組細胞用相應濃度的LPS刺激24 h。用無菌槍頭在皿底作等寬的直線劃痕,并用無菌PBS清洗3 次。分別在刺激0、24 h 時于倒置顯微鏡下觀察、拍照并采集圖片,采用Image J V1.8.0 軟件分析劃痕寬度并按“2.2”項下方法計算細胞遷移率。
2.4 ARC 對LPS 刺激的NP-69 細胞上清液中NO、TNF-α、IL-6、IL-1β水平影響的檢測
取對數生長期的NP-69 細胞,制成細胞懸液,計數并調整細胞密度至4×105個/mL,接種于6 孔培養板中,每孔2 mL。將細胞分為正常組、LPS組(1.0 μg/mL[11])和不同濃度(0.1、1.0 μmol/L,濃度參考“2.1”項下結果設置)ARC組,每組設置6 個復孔。ARC組細胞用含相應濃度藥物的完全培養基培養24 h,正常組和LPS 組用完全培養基培養24 h;隨后,ARC組和LPS 組用相應濃度的LPS 刺激24 h。收集各組細胞上清液,檢測其中NO、TNF-α、IL-6、IL-1β水平,嚴格按照各試劑盒說明書方法操作。
2.5 ARC 對LPS 刺激的NP-69 細胞中ZO-1、BD3、JAK1、STAT3 mRNA表達影響的檢測
同“2.4”項下方法進行細胞分組(每組設置6 個復孔)及干預,于LPS 刺激24 h 后收集各組細胞,采用TRIZOL 法提取RNA,采用q-PCR 法檢測細胞中ZO-1、BD3、JAK1、STAT3 mRNA 的表達水平:PCR 擴增體系包括上/下游引物各0.6 μL、cDNA 1.0 μL、ddH2O 7.8 μL。擴增程序為95 ℃預變性15 min;95 ℃變性10 s,60 ℃退火30 s,共45 個循環。隨后,進行溶解曲線分析,以β-actin 為內參,以正常組為參照,運用2-ΔΔCt法確定各目的基因mRNA的相對表達量。目的基因的引物信息如表1所示(內參略)。
2.6 ARC 對LPS 刺激的NP-69 細胞中ZO-1、BD3、JAK1、STAT3 蛋白表達影響的檢測
同“2.4”項下方法進行細胞分組(每組設置6 個復孔)及干預,于LPS 刺激24 h 后收集各組細胞,采用Western blot 法檢測細胞中ZO-1、BD3、JAK1、STAT3 蛋白的表達情況:于各組細胞中加入細胞裂解液(含1%蛋白酶抑制劑的裂解液)100 μL,冰上裂解5 min 后,以14 000 r/min 離心5 min,取上清液采用BCA法檢測細胞總蛋白濃度后進行高溫變性。取變性蛋白30 μg 進行10%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(分離膠電壓為70 V,濃縮膠電壓為110 V,電泳時間為90 min),然后轉移到聚偏二氟乙烯膜(電流為200 mA;轉膜時間根據蛋白分子量決定,一般1 kDa 蛋白轉膜1 min)上,用5%脫脂奶粉于室溫搖床上封閉2 h,加入相應一抗(目的蛋白的稀釋比例均為1 ∶ 500,β-actin 的稀釋比例為1 ∶2 000),4 ℃孵育過夜;用TBST緩沖液洗膜5 min×4次,加入二抗(稀釋比例為1 ∶2 000),室溫下搖床孵育2 h;用TBST 緩沖液洗膜5 min×4 次,以ECL 顯色后于凝膠成像系統上成像并拍照,利用Image J V1.8.0 軟件進行圖像灰度值處理,以目的蛋白與內參蛋白(β-actin)的灰度值比值作為前者的相對表達量。
2.7 統計學方法
分別采用SPSS 23.0、Graphpad Prism 8.0 軟件進行統計分析、繪圖。數據以x±s 表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD-t 檢驗(方差齊)或Tamhane’s T2分析(方差不齊)。檢驗水準α=0.05。
3 結果
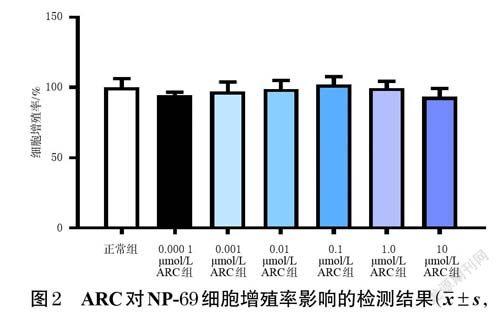
3.1 ARC對NP-69 細胞增殖率的影響
在0.000 1、0.001、0.01、0.1、1.0、10 μmol/L 濃度下,ARC對NP-69 細胞均無明顯毒性;ARC組細胞增殖率與正常組比較,差異均無統計學意義(P>0.05)。結果見圖2。
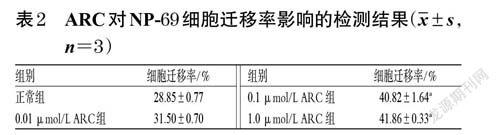
3.2 ARC對NP-69 細胞遷移的影響
與正常組比較,經0.1、1.0 μmol/LARC干預后,細胞的遷移率均顯著升高(P<0.05)。結果見表2、圖3。
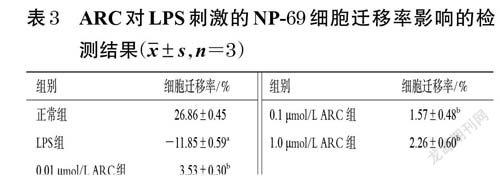
3.3 ARC對LPS刺激的NP-69細胞遷移的影響
與正常組比較,LPS 組出現細胞損傷脫落現象,細胞遷移率顯著降低(P<0.01);與LPS 組比較,不同濃度的ARC 均可使NP-69 細胞的遷移率顯著升高(P<0.01)。結果見表3、圖4。
3.4 ARC 對LPS 刺激的NP-69 細胞上清液中NO、TNF-α、IL-6、IL-1β水平的影響
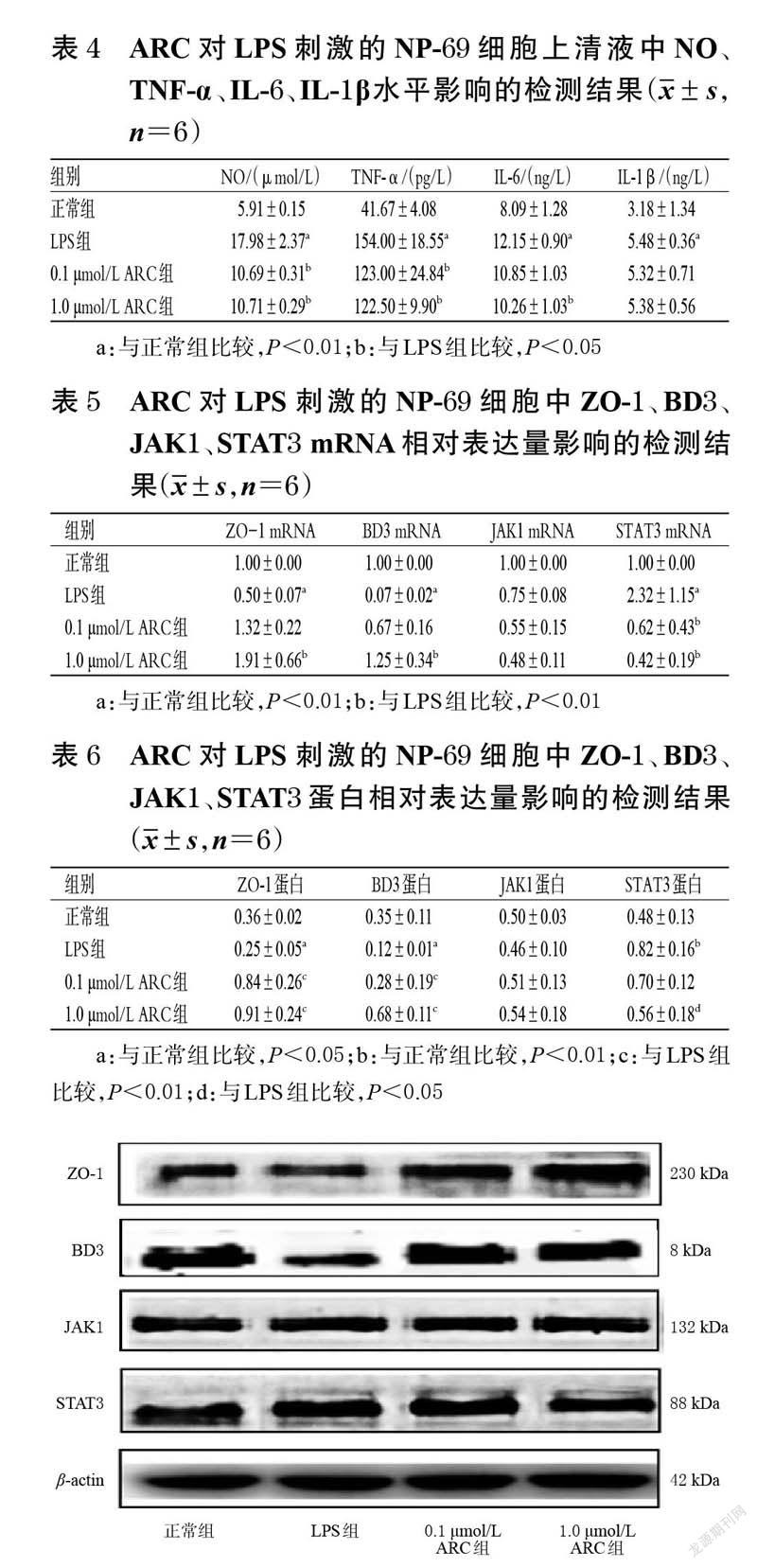
與正常組比較,LPS 組細胞上清液中NO、TNF-α、IL-6、IL-1β水平均顯著升高(P<0.01)。與LPS 組比較,0.1、1.0 μmol/LARC組細胞上清液中NO、TNF-α、IL-6 水平(0.1 μmol/LARC組除外)均顯著降低(P<0.05);各藥物組IL-1β水平雖有降低趨勢,但組間比較差異均無統計學意義(P>0.05)。結果見表4。
3.5 ARC 對LPS 刺激的NP-69 細胞中ZO-1、BD3、JAK1、STAT3 mRNA表達的影響
與正常組比較,LPS 組NP-69 細胞中ZO-1、BD3mRNA 的相對表達量均顯著降低(P<0.01),STAT3mRNA的相對表達量顯著升高(P<0.01)。與LPS 組比較,1.0 μmol/L ARC組細胞中ZO-1、BD3 mRNA的相對表達量均顯著升高(P<0.01),0.1、1.0 μmol/L ARC組細胞中STAT3 mRNA的相對表達量均顯著降低(P<0.01);各藥物JAK1 mRNA的相對表達量雖有降低趨勢,但組間比較差異均無統計學意義(P>0.05)。結果見表5。
3.6 ARC 對LPS 刺激的NP-69 細胞中ZO-1、BD3、JAK1、STAT3 蛋白表達的影響
與正常組比較,LPS 組細胞中ZO-1、BD3 蛋白的相對表達量均顯著降低(P<0.05),STAT3 蛋白的相對表達量顯著升高(P<0.01)。與LPS 組比較,0.1、1.0 μmol/LARC組細胞中ZO-1、BD3 蛋白的相對表達量均顯著升高(P<0.01),1.0 μmol/LARC組細胞中STAT3 蛋白的相對表達量顯著降低(P<0.05);各藥物組JAK1 蛋白的相對表達量雖有升高趨勢,但組間比較差異均無統計學意義(P>0.05)。結果見表6、圖5。
4 討論
由于引起URTI 的高致病性病原體(如冠狀病毒、鼻病毒、呼吸道合胞病毒等)大多是從口鼻入侵,故覆蓋于鼻腔結構的鼻黏膜是機體與病毒接觸的首個部位[12]。鼻上皮細胞與內皮細胞組成細胞片層,構成了鼻黏膜的第1 道屏障,其結構和功能的完整性對于防御病原體經鼻入侵、維持機體內環境穩態均具有至關重要的作用[13]。由于直接與外界相通,鼻黏膜上皮細胞不可避免地經常受到細菌、病毒、吸入顆粒物的損傷。正常情況下,當上皮屏障受損時,上皮細胞將迅速啟動傷口修復機制,以保持上皮屏障的完整性,其中上皮細胞快速遷移是上皮屏障修復中最早出現且較為重要的修復途徑之一,這一過程對于受損氣道上皮細胞的修復和再生格外重要[14]。上皮細胞遷移受到多種因素的影響,有研究證實炎癥反應可明顯抑制氣道上皮細胞的遷移[15]。
本研究結果顯示,不同濃度(0.1、1.0 μmol/L)的ARC均能促進NP-69 細胞的遷移,表明該成分具有促進細胞遷移的作用。隨后,本研究采用LPS 刺激NP-69 細胞以復制細胞炎癥損傷模型,以細胞劃痕實驗再次考察ARC對NP-69 細胞遷移的影響。結果顯示,經LPS刺激后,細胞損傷脫落,細胞遷移率顯著降低,說明炎癥環境抑制了上皮細胞的黏附和遷移能力;與此同時,細胞上清液中炎癥介質NO和炎癥因子TNF-α、IL-1β、IL-6 水平均顯著升高。經不同濃度ARC預先干預后,NP-69 細胞損傷有所恢復,細胞遷移率顯著升高,細胞上清液中NO、TNF-α、IL-6 水平均有不同程度降低,提示該成分具有促進上皮屏障損傷愈合的作用。
有研究指出,ZO-1 是上皮細胞維持細胞極性的重要結構蛋白,也是鼻黏膜物理屏障的重要構成部分,具有防止病原體入侵的重要作用[16]。在炎癥環境下,NP-69 細胞中ZO-1 mRNA 和蛋白表達均顯著降低,說明上皮屏障結構受損、物理屏障功能減弱;預先給予ARC干預后,ZO-1 mRNA和蛋白的表達得以上調,說明ARC可以增強鼻黏膜上皮細胞的物理屏障功能。
BD主要分布于鼻黏膜上皮及呼吸道黏膜下腺體組織中,是具有獨特二硫鍵的陽離子抗菌肽,其不但可通過靶向細菌細胞膜和病毒外殼蛋白的方式來快速殺滅病原微生物,而且可通過提高免疫細胞的活性及趨化性調節作用來增強呼吸道黏膜的防御功能[17]。近年來,BD因其獨特的組織分布、作用特點及對URTI 的影響而受到了學者的廣泛關注。本研究結果顯示,經LPS 刺激后,NP-69 細胞中BD3 mRNA 和蛋白的表達均顯著降低,提示在炎癥環境中,上皮屏障的抗菌肽表達減少,屏障的免疫防御功能有所減弱。預先給予ARC 干預后,BD3 mRNA和蛋白的表達均明顯上調,說明ARC可以提高鼻黏膜上皮屏障的免疫防御功能。
有研究報道,當上皮屏障受損時,在沒有任何外界刺激或非上皮細胞參與的情況下,受損部位鄰近的上皮細胞能以35~45 μm/s 的速度迅速遷移到受損部位并覆蓋受損區域,增加受損區域內的細胞總數,同時可分化為具有不同功能的上皮細胞(如基底細胞、黏液分泌細胞),從而完成對上皮屏障的修復[18]。上皮細胞的快速遷移是由IL-6/JAK1/STAT3 蛋白激酶信號通路介導并精密調控的[19]。其中,STAT3 在多種細胞和組織中都有表達,對調節正常細胞的增殖、分化、生存、凋亡均具有重要作用[20]。研究表明,特異性敲除STAT3 基因的腸上皮細胞不但對葡聚糖硫酸鈉鹽引起的炎癥性腸炎易感,而且使受損上皮屏障的愈合速度也明顯減慢[21]。STAT3 可被多種配體激活,其中IL-6 是STAT3 的重要細胞內調節分子之一,當細菌或病毒入侵上呼吸道后可誘導呼吸道釋放IL-6、IL-8,后者與IL-6 受體α(interleukin-6 receptoralpha,IL-6Rα)特異性結合,引起糖蛋白130(glycoprotein130,gp130)的同源二聚化,JAK 與gp130 的胞質區交聯,使gp130 磷酸化,進一步促進了STAT3 激活,從而發揮促進細胞增殖、遷移和抑制細胞凋亡等作用;但當STAT3 過度表達時,則可引起炎癥及腫瘤的發生[22]。本研究結果顯示,NP-69 細胞經LPS 刺激后,其上清液中IL-6 水平明顯上升,中下游效應因子JAK1 mRNA和蛋白雖未及時上升(可能與藥物作用時效性有關),但同樣上調了非磷酸化STAT3 mRNA 和蛋白的表達,提示IL-6/JAK1/STAT3 信號通路被激活。預先給予ARC 干預后,該信號通路受到明顯抑制,提示ARC 可抑制由STAT3 過度激活所造成的炎癥反應。
綜上所述,ARC具有明顯減輕LPS致NP-69 細胞炎癥損傷的作用,并可增強炎癥環境下鼻黏膜上皮屏障的物理及免疫防御功能;上述作用可能與抑制IL-6/JAK1/STAT3 蛋白激酶信號通路相關。

