清呼合劑急性毒性試驗(yàn)研究
景慕嫻,謝曉莉,李連缺,張一麗,米國(guó)華,劉 明,趙 達(dá)
(1.石家莊江山動(dòng)物藥業(yè)有限公司,石家莊050200;2.河北工程技術(shù)學(xué)院,石家莊 050000;3.河北工程大學(xué)生命科學(xué)與食品工程學(xué)院,河北邯鄲 056038;4.石家莊市藁城區(qū)畜牧工作總站,石家莊 050000;5.河北省口服獸藥制劑創(chuàng)新技術(shù)中心,石家莊050200)
清呼合劑為本文研究的新獸藥復(fù)方制劑,由黃芩、枇杷葉等6味中藥組成,具有清肺化痰、止咳平喘之功效,主治由風(fēng)熱犯肺或風(fēng)寒郁而化熱等各種原因引起的肺熱咳喘證。為客觀評(píng)價(jià)該制劑的安全性,依據(jù)農(nóng)業(yè)部獸藥評(píng)審中心《獸藥研究技術(shù)指導(dǎo)原則匯編(2006-2011)》[1],通過(guò)對(duì)KM小鼠單次灌胃清呼合劑,連續(xù)觀察試驗(yàn)小鼠出現(xiàn)的中毒癥狀、中毒程度、性質(zhì)及死亡情況,評(píng)價(jià)受試藥物毒性作用的性質(zhì),毒效應(yīng)的特征及可能的靶器官,初步判斷受試藥物的危險(xiǎn)性,并探求受試藥物的劑量-效應(yīng)關(guān)系,求出半數(shù)致死量LD50及95%可信限,為評(píng)價(jià)其安全性提供依據(jù)[2-4]。
1 材料與方法
1.1 受試藥物 清呼合劑,250 mL/瓶,每1 mL相當(dāng)于原生藥1 g,批號(hào)20180327,由石家莊江山動(dòng)物藥業(yè)有限公司生產(chǎn)。試驗(yàn)時(shí)取本品加入蒸餾水,按最大劑量組配制供試品溶液,其他濃度按等容量稀釋法(1:K稀釋)進(jìn)行稀釋。
1.2 實(shí)驗(yàn)動(dòng)物 SPF級(jí)健康KM小鼠,體重18 g~22 g,72只(其中12只用于首次實(shí)驗(yàn)),雌雄各半,北京華阜康生物科技股份有限公司提供,生產(chǎn)許可證號(hào):SCXK(京)2019-0008。將KM小鼠隔離檢疫5~7 d,在檢疫期間動(dòng)物攝食、飲水和健康狀態(tài)良好。皮毛光滑、反應(yīng)靈敏,糞便成形,眼、耳、鼻及會(huì)陰處無(wú)分泌物,動(dòng)物確認(rèn)健康無(wú)病后可用于試驗(yàn)。
1.3 試驗(yàn)動(dòng)物分組及給藥劑量 選取SPF小鼠12只(雌、雄各半)進(jìn)行首次試驗(yàn),設(shè)3個(gè)劑量組,每組4只(雌、雄各半)。試驗(yàn)前禁食不禁水12 h,分別灌服清呼合劑1次,灌胃體積為0.2 mL/10 g體重,具體劑量見(jiàn)表1。如果高劑量組(劑量為5000 mg/kg)死亡率為0%,則進(jìn)行重復(fù)試驗(yàn)一、重復(fù)試驗(yàn)二[5-7],即分別選取30只小鼠(雌、雄各半),各設(shè)3個(gè)劑量組,每組10只(雌、雄各半),灌服清呼合劑1次,灌胃體積為0.2 mL/10 g體重,具體劑量見(jiàn)表2和表3。
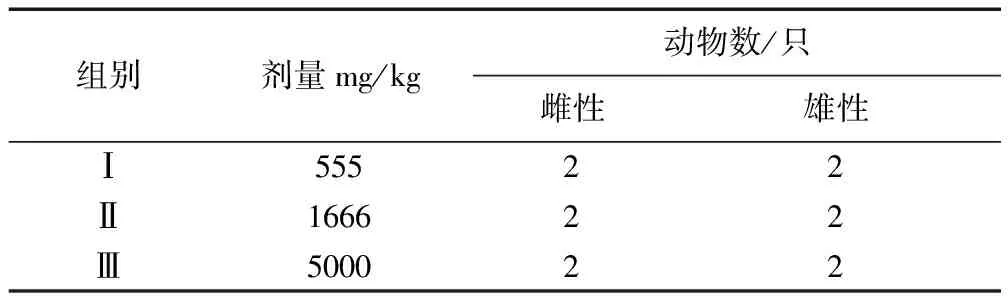
表1 清呼合劑KM小鼠急性毒性試驗(yàn)首次試驗(yàn)-劑量及分組
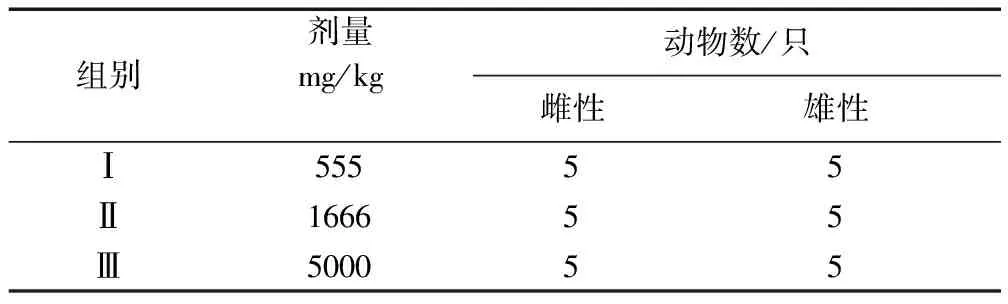
表2 清呼合劑KM小鼠急性毒性試驗(yàn)重復(fù)試驗(yàn)一-劑量及分組

表3 清呼合劑KM小鼠急性毒性試驗(yàn)重復(fù)試驗(yàn)二-劑量及分組
1.4 試驗(yàn)觀察 給藥4 h嚴(yán)密觀察動(dòng)物對(duì)供試品的反應(yīng),以后每天觀察一次,連續(xù)觀察7 d,4 d如有動(dòng)物死亡則觀察14 d。觀察內(nèi)容:動(dòng)物外觀、活動(dòng)情況、呼吸狀態(tài)、糞便形態(tài)、營(yíng)養(yǎng)狀況、被毛光澤[1,8]。對(duì)動(dòng)物毒性反應(yīng)情況、中毒癥狀、嚴(yán)重程度、中毒發(fā)生時(shí)間、持續(xù)時(shí)間、恢復(fù)時(shí)間、動(dòng)物死亡時(shí)間及死亡數(shù)量進(jìn)行詳細(xì)記錄,對(duì)死亡動(dòng)物進(jìn)行大體解剖。
1.5 結(jié)果統(tǒng)計(jì) 統(tǒng)計(jì)并分析清呼合劑各劑量組的動(dòng)物死亡數(shù)。
1.6 毒性分級(jí)評(píng)定 依據(jù)半數(shù)致死量(LD50)及急性毒性(LD50)劑量分級(jí)表[1],對(duì)受試藥物的毒性進(jìn)行分級(jí)。見(jiàn)表4。

表4 急性毒性(LD50)劑量分級(jí)表
2 結(jié)果與分析
2.1 首次試驗(yàn)結(jié)果 首次試驗(yàn)中,清呼合劑各劑量組實(shí)驗(yàn)小鼠灌胃給藥后,4 h內(nèi)小鼠均未出現(xiàn)異常現(xiàn)象,連續(xù)觀察小鼠7 d后,各組小鼠行為及精神狀態(tài)良好(臨床表現(xiàn)如2.2圖1所示),眼、鼻、口腔及肛門均無(wú)分泌物,二便正常,且各組小鼠均未出現(xiàn)死亡。結(jié)果見(jiàn)表5、表6。

表5 急性毒性試驗(yàn)首次試驗(yàn)結(jié)果
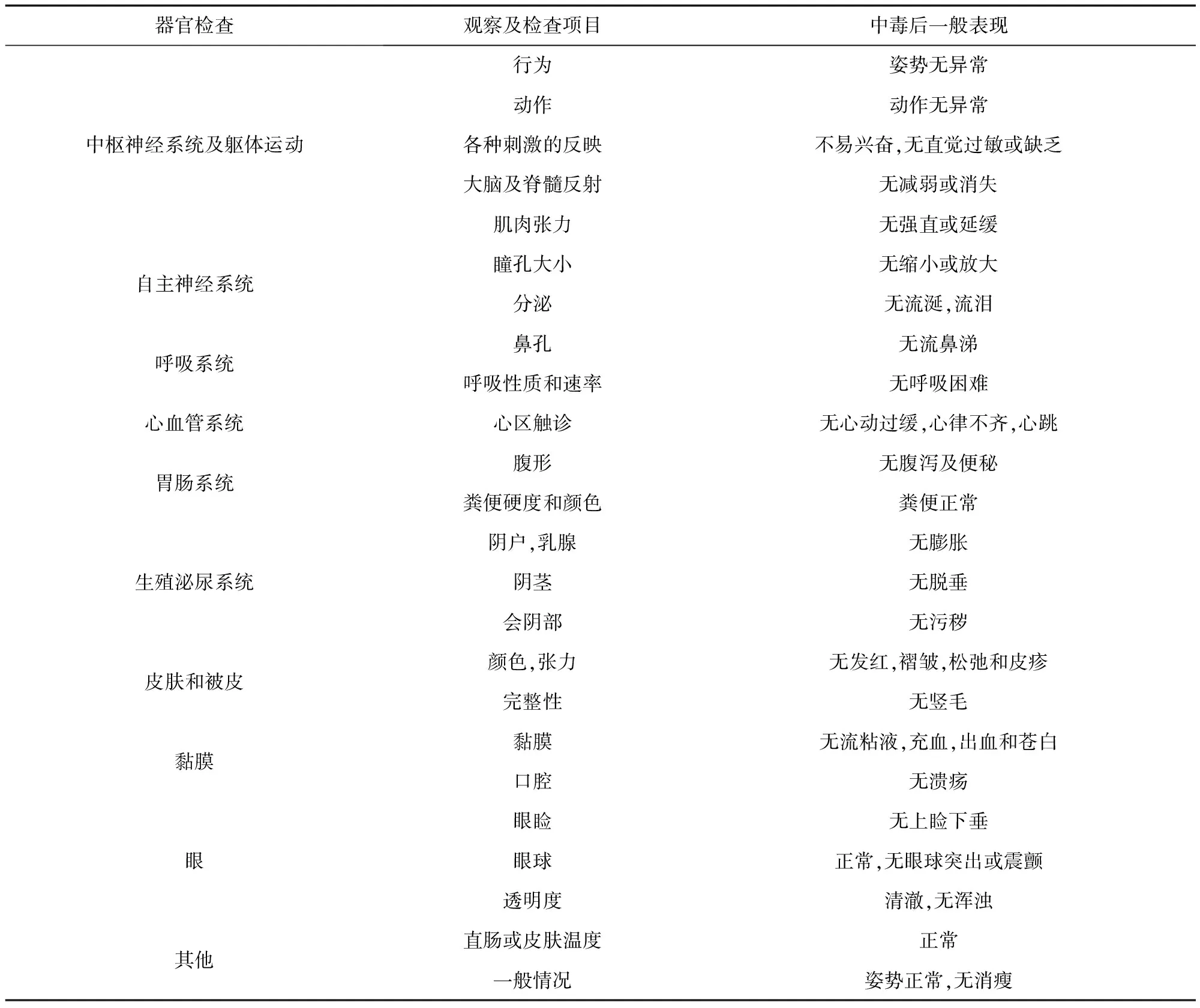
表6 嚙齒動(dòng)物中毒表現(xiàn)及觀察項(xiàng)目
2.2 重復(fù)試驗(yàn)結(jié)果 重復(fù)試驗(yàn)一和重復(fù)試驗(yàn)二中,清呼合劑各劑量組實(shí)驗(yàn)小鼠灌胃給藥后,4 h內(nèi)小鼠均未出現(xiàn)異常現(xiàn)象,連續(xù)觀察小鼠7 d后,各組小鼠均未出現(xiàn)死亡(表7),且小鼠行為及精神狀態(tài)等均正常(圖1),觀察結(jié)果同表6。各組小鼠均未出現(xiàn)死亡,即小鼠的死亡率為0。由此可見(jiàn),清呼合劑對(duì)KM小鼠的LD50大于5000 mg/kg·bw。

表7 急性毒性試驗(yàn)重復(fù)試驗(yàn)結(jié)果
2.3 毒性分級(jí)評(píng)定 從本試驗(yàn)結(jié)果可知清呼合劑的LD50大于5000 mg/kg,按1.6表4急性毒性(LD50)劑量分級(jí)表進(jìn)行分級(jí),清呼合劑屬于實(shí)際無(wú)毒類中獸藥。
3 討論與結(jié)論
獸藥三個(gè)基本要素屬性包括安全性、藥品的質(zhì)量可控性以及臨床的有效性。獸藥的優(yōu)與劣,除取決于有效性,還取決于毒性的高低。因此,在新獸藥的開(kāi)發(fā)與研究中必須要進(jìn)行安全性評(píng)價(jià)[9-10]。急性毒理試驗(yàn)是安全性評(píng)價(jià)的首要內(nèi)容,指一日內(nèi)對(duì)動(dòng)物單次或多次給藥,連續(xù)觀察給藥后動(dòng)物產(chǎn)生的毒性反應(yīng)及死亡情況的試驗(yàn)方法[11],進(jìn)而測(cè)定引起動(dòng)物急性中毒的劑量,揭示動(dòng)物在中毒過(guò)程中出現(xiàn)的毒性反應(yīng)和靶器官[12]。常用LD50的測(cè)定來(lái)評(píng)價(jià)獸藥急性毒性試驗(yàn)。
清呼合劑為純中藥復(fù)方新制劑,由黃芩、枇杷葉等6味中藥組成,前期藥效學(xué)試驗(yàn)表明,清呼合劑具有鎮(zhèn)咳、祛痰、平喘、抗菌、抗炎等作用[13]。本試驗(yàn)依據(jù)《獸藥研究技術(shù)指導(dǎo)原則匯編(2006-2011)》“獸藥急性毒性試驗(yàn)(LD50測(cè)定)指導(dǎo)原則”,對(duì)清呼合劑進(jìn)行了急性毒性評(píng)價(jià)試驗(yàn)。首次試驗(yàn)結(jié)果顯示,KM小鼠口服高劑量已達(dá)5000 mg/kg的清呼合劑,未出現(xiàn)小鼠的死亡、精神及行為等異常。將小鼠增加至10只(雌雄各半)重復(fù)兩次試驗(yàn),結(jié)果仍未見(jiàn)死亡及中毒癥狀。因此,確定了清呼合劑對(duì)KM小鼠的LD50大于5000 mg/kg。根據(jù)急性毒性(LD50)劑量分級(jí)表進(jìn)行分級(jí)判斷,清呼合劑屬于實(shí)際無(wú)毒類中獸藥,這為評(píng)價(jià)其安全性提供了有力依據(jù),同時(shí)為后續(xù)長(zhǎng)期毒性試驗(yàn)的劑量使用提供依據(jù)。

