miR-204-5p通過調節TLR2的表達減輕哮喘小鼠的炎癥反應和氣道重塑
董學峰,楊亞龍
(泉州醫學高等專科學校內科教研室,福建 泉州 362000)
哮喘是一種慢性氣道炎癥性疾病,受遺傳及環境等多種因素的介導,由多基因參與調控,發病機制涉及多種炎性細胞、炎癥因子及細胞因子[1-2]。近年來,由于生活環境的變化,哮喘的發病率呈上升趨勢,據調查統計在全球范圍內有近3億哮喘患者,因此尋找治療哮喘的有效方法具有重要意義[3]。miRNA是真核生物內源性具有調控功能的微小非編碼RNA,通過靶向mRNA的轉錄后沉默來調節基因表達[4],miR-204-5p作為一種潛在的癌癥治療分子,多項研究[5-7]表明,其通過外泌體轉染至細胞內可調控抑制腫瘤細胞的生長,促進腫瘤細胞的凋亡。有研究[8]報道,miR-204-5p的過表達可抑制腫瘤轉換生長因子β1(TGF-β1)誘導的氣道平滑肌細胞增殖和ECM的沉積,有效預防哮喘氣道重塑。TLR2為參與非特異性免疫的TLRs家族成員之一,其與TLR4可識別侵入的微生物病原體,促進機體炎性細胞及炎癥因子的釋放,是哮喘易感性的主要影響因素[9]。本研究旨在通過探討miR-204-5p對哮喘小鼠的炎癥反應和氣道重塑的影響及其可能分子機制。
1 材料與方法
1.1 材料
1.1.1 實驗儀器及試劑 離心機(Multifuge X1/X1R Pro,賽默飛)、DNA擴增儀(T100,BIORAD)實時熒光定量PCR儀(LightCycler 480,羅氏診斷)、激光共聚焦顯微鏡(Echo REVOLUTION,ECHO)、紫外分光光度計(U-3900/3900H,日立)酶標儀(Multiskan FC,賽默飛)、灰度分析軟件(alphaEaseFC,Alpha Innotech)。miR-204-5p激動劑(miR-204-5p agomir),miR-204-5p拮抗劑(miR-204-5p antagomir)(貨號:miR40000237-4-5、miR30000237-4-5,廣州銳博),BCA蛋白質定量試劑盒(貨號:AR1110,武漢博士德生物工程限公司),TLR2/ toll樣受體2兔多克隆抗體、TGF-β 1/2兔多克隆抗體、NF-κB p65兔多克隆抗體、辣根過氧化物酶標記山羊抗兔IgG(H+L)(貨號:AF8181、AF0297、AF0246、A0208,上海碧云天),Trizol、TaqManTMMicroRNA逆轉錄試劑盒及熒光定量試劑盒SYBR Premix Ex Taq TM(貨號:RR036A、RR820A,TaKaRa),小鼠白細胞介素4(IL-4)ELISA試劑盒、小鼠IL-5 ELISA試劑盒(貨號:PI612、PI620,上海碧云天),小鼠IL-13 ELISA試劑盒(貨號:ml063123,上海酶聯)。
1.1.2 實驗動物 40只7周齡的SPF級昆明白雄性小鼠,體重(24.6±3.4)g,購自洛陽普萬泰生物技術有限公司,室溫保持在(25±2) ℃,濕度保持(55±5)%,動物自由飲食,保持12 h/d的晝夜循環。實驗動物使用獲得本院實驗動物管理委員會批準。
1.2 方法
1.2.1 哮喘小鼠模型建立與分組 挑選10只作為對照組,其余30只小鼠于實驗第1、3、5天腹腔注射200 μL致敏液[3 mg/mL OVA+ 5% Al(OH)3],1次/d;于第6天開始以25 μL/10 g的劑量致敏液[6 mg/mL OVA+5% Al(OH)3]滴鼻激發引喘,1次/d,連續7 d,以激發時出現呼吸急促、腹肌抽動及肢體呈團等癥狀為哮喘模型成功[10]。建模成功后隨機分為哮喘組、表達上調組、表達下調組,每組各10只。表達上調組小鼠尾靜脈注射 30 mg/kg miR-204-5p agomir干預;表達下調組尾靜脈注射 30 mg/kg miR-204-5p antagomir干預。對照組及哮喘組小鼠以同種方式注射等量0.9%生理鹽水。干預結束后24 h頸椎脫臼法處死小鼠,剪開其頸部皮膚,于氣管正中處剪一小口,插入氣管套管。用磷酸鹽緩沖液對支氣管肺泡進行灌洗,來回沖洗3次,收集小鼠肺泡灌洗液(BALF)[11],并留取小鼠肺組織,放入液氮中速凍,-80 ℃保存。
1.2.2 HE染色觀察各組小鼠肺組織病理學改變 切取適量的肺組織,固定于10%的磷酸鹽緩沖福爾馬林溶液,經脫水、包埋后切片(切片厚度為5 μm),行HE染色,中性樹脂封片,顯微鏡下觀察小鼠肺組織形態學變化。
1.2.3 RT-qPCR檢測肺組織中miR-204-5p及TLR2 mRNA水平 取各組小鼠新鮮肺組織50 mg,Trizol法提取組織中的總RNA,分光光度計測定RNA的濃度。依據試劑盒說明逆轉錄合成cDNA,反應體系5 μL(5×Prime Script RT Master MiX 2 μL,RNase-free ddH2O 3 μL),輕柔混勻后加入DNA擴增儀中,反應條件為:37 ℃ 15 min反轉錄,85 ℃ 5 s反轉錄酶失活后,4 ℃保存。PCR擴增反應體系(20 μL):SYBR Premix Ex TaqⅡ(2×)10 μL、PCR正反向引物(10 μM)各0.8 μL、 ROX Reference Dye(50×)0.4 μL、cDNA 2 μL、滅菌蒸餾水6 μL,反應條件:預變性:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s循環40次,95 ℃ 5 s,60 ℃ 60 s 融解,50 ℃ 30 s降溫。以相對對量2-ΔΔCt計算目的基因的相對表達量,以U6為內參對miR-204-5p定量,以β-actin為內參對TLR2定量。miR-204-5p F:5′-AAC ACG CTT CCC TTT GTC ATC C-3′,R:5′-GCC UAU CCU ACU GUU UCC CUU-3′,擴增片段大小256 bp。U6 F:5′-CTC GCT TCG GCA GCA CA-3′,R:5′-AAC GCT TCA CGA ATT TGC GT-3′,擴增片段大小287 bp。TLR2 F:5′-AGA ATC AAT ACA ATA GAG GGA GAC-3′,R:5′-TCG ACT TTA GAC TTT GGG AC-3′,擴增片段大小354 bp。β-actin F:5′-ATG GAT GAC GAT ATC GCT G-3′,R:5′-ATG AGG TAG TCT GTC AGG-3′,擴增片段大小382 bp。
1.2.4 Western blot檢測TLR2、TGF-β1及NF-κB p65蛋白表達水平 分別取各組小鼠的新鮮肺組織100 mg,4 ℃ PBS浸洗5 min,2 000 rpm離心10 min,去上清后加入200 μL RIPA 細胞裂解液與2 μL蛋白酶抑制劑混勻,4 ℃ 2 000 rpm離心10 min,收集總蛋白懸液。BCA蛋白質定量試劑盒所取組織中各蛋白的表達濃度。取蛋白溶液每孔上樣50 μL,行SDS-PAGE電泳(12%或15%),電泳儀分別按 80 V 20 min,120 V 60 min操作,至溴酚藍剛達膠底部立刻關閉電泳儀。PVDF膜置于轉移緩沖液中平衡后轉膜,裝置從下至上依次按陽極碳板、24層濾紙、PVDF膜、凝膠、24層濾紙、陰極碳板。接通電源,根據蛋白量大小,決定轉膜需要的電壓和時間。轉移結束后取出PVDF膜,割取待測膜條做免疫印跡:將有蛋白標準的條帶染色,放入膜染色液中50 s后,50%甲醇脫色至背景清晰,PBS反復洗膜3次,10%脫脂奶粉的PBST封閉液室溫封閉1 h,棄封閉液,以5%脫脂奶粉的PBS配制的一抗(TLR2:1∶1 000、TGF-β1:1∶2 000、NF-κB p65:1∶2 000),4 ℃孵育過夜。回收一抗,加入辣根標記二抗(1∶1 000)室溫慢搖下孵育1 h,棄二抗,PBST清洗條帶15 min。以β-actin為內參,采取ECL發光試劑盒顯影成像,然后使用Image J 軟件分析各蛋白的相對表達。
1.2.5 ELISA法檢測各組小鼠BALF中IL-4、IL-5、IL-13等細胞因子濃度 在EP管中加入1 mL BALF,1 000 rpm離心10 min,取上清。采用ELISA試劑盒檢測各細胞因子濃度:分別取100 μL稀釋樣品與不同濃度標準品加入相應孔,封板膜封孔,室溫孵育2 h,洗板5次并吸干水分后加入生物素化抗體100 μL/孔,封板膜封孔,室溫孵育1 h,洗板5次并吸干水分后加入辣根過氧化物酶標記100 μL/孔,封板膜封孔,室溫避光孵育20 min,洗板5次并吸干水分后加入顯色劑TMB溶液100 μL/孔,封板膜封孔,室溫避光孵育20 min,加入終止液50 μL/孔,混勻后立即測量A450值。
1.3 統計學分析
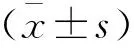
2 結果
2.1 各組小鼠一般行為特征
對照組小鼠飲食及行為正常,呼吸節律平穩,無異常癥狀;哮喘模型小鼠出現呼吸急促、腹肌抽動及肢體呈團;miR-204-5p表達干預后,表達上調組小鼠呼吸急促、腹肌抽動現象減輕,表達下調組小鼠呼吸急促、腹肌抽動等現象加重,出現點頭呼吸現象。
2.2 各組小鼠肺組織病理學改變
對照組小鼠肺組織及支氣管結構正常,肺泡結構輪廓清晰,哮喘組、表達下調組小鼠氣道壁嚴重增厚,細胞排列雜亂且疏松;表達上調組小鼠氣道壁增厚情況明顯減輕,細胞排列較為整齊,結構較為清晰。見圖1。

2.3 各組小鼠肺組織中miR-204-5p及TLR2mRNA水平
與對照組相比,哮喘組小鼠的miR-204-5pmRNA表達水平下降(P<0.05),TLR2 mRNA表達水平上升(P<0.05);與哮喘組相比,表達上調組miR-204-5p mRNA表達水平上升(P<0.05),TLR2 mRNA表達水平下降(P<0.05);表達下調組miR-204-5p mRNA表達水平下降(P<0.05),TLR2 mRNA表達水平上升(P<0.05)。見表1。
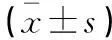
表1 各組小鼠肺組織中miR-204-5p及TLR2 mRNA水平
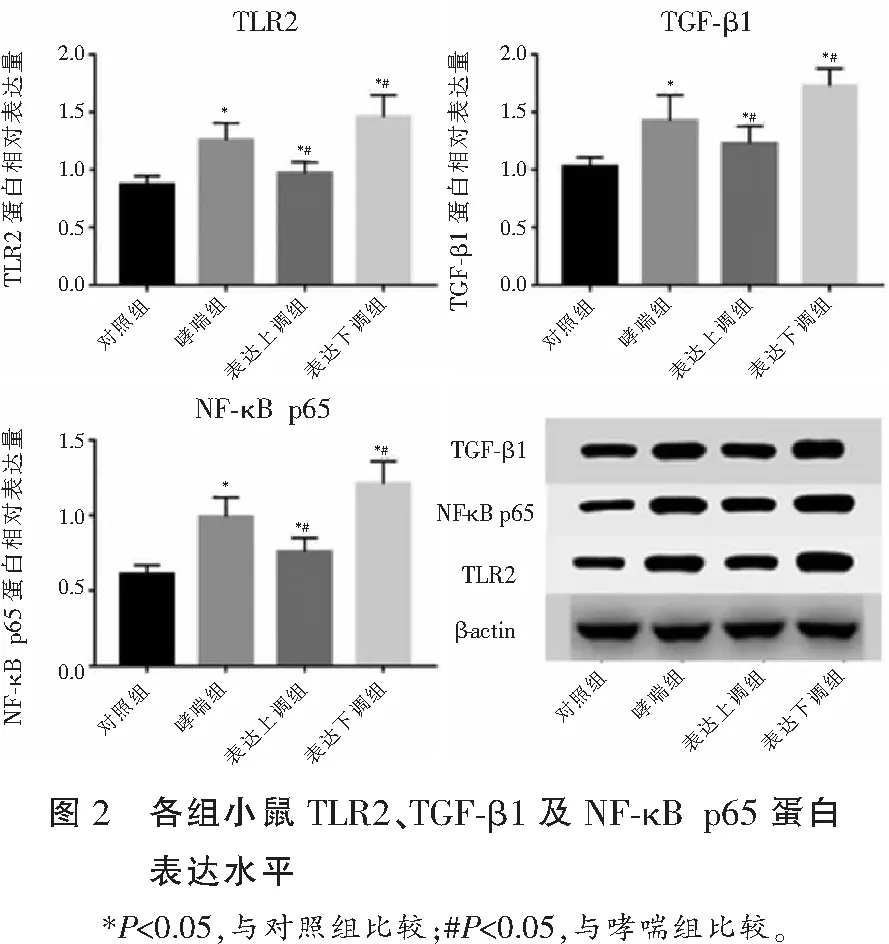
2.4 各組小鼠TLR2、TGF-β1及NF-κB p65蛋白表達水平
與對照組相比,各組小鼠TLR2、TGF-β1及NF-κB p65蛋白表達水平均上升(P<0.05);與哮喘組相比,表達上調組TLR2、TGF-β1及NF-κB p65蛋白表達水平下降(P<0.05),表達下調組TLR2、TGF-β1及NF-κB p65蛋白表達水平上升(P<0.05)。見圖2。
2.5 各組小鼠肺組織IL-4、IL-5、IL-13等細胞炎癥因子濃度
與對照組相比,各組小鼠的IL-4、IL-5、IL-13等細胞因子濃度均上升(P<0.05);與哮喘組相比,表達上調組IL-4、IL-5、IL-13等細胞因子濃度下降(P<0.05),表達下調組IL-4、IL-5、IL-13等細胞因子濃度上升(P<0.05)。見表2。
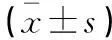
表2 各組小鼠肺組織IL-4、IL-5、IL-13細胞炎癥因子濃度
3 討論
哮喘是常見的呼吸系統慢性氣道疾病,主要表現為氣道表皮細胞組織得損傷及脫落,且氣道表皮細胞及組織損傷越嚴重,氣道得高反應會越明顯;主要發病原因之一為氣道重塑,氣道平滑肌細胞增殖和細胞外基質的產生在氣道重塑過程中具有重要作用[12]。miRNA是真核生物內源性具有調控功能的微小非編碼RNA,研究[13]發現,在哮喘的發病機制中有多種miRNA參與調控。相關研究[8]報道,miR-204-5p可通過調節Six1抑制TGF-β1誘導的氣道平滑肌細胞增殖和細胞外基質產生,作為預防哮喘氣道重塑的潛在治療靶點。
本研究通過探討miR-204-5p對哮喘小鼠的炎癥反應和氣道重塑的影響,并對其潛在的分子機制進行研究。結果顯示,miR-204-5p的上調會抑制TLR2的表達,且與哮喘組相比,miR-204-5p表達上調組TGF-β1及NF-κB p65蛋白表達水平下降(P<0.05),miR-204-5p表達下調組TGF-β1及NF-κB p65蛋白表達水平上升(P<0.05)。氣道平滑肌細胞增生會直接導致氣道壁增厚,從而影響氣道反應性,使氣流受限。TGF-β1具有強烈的促纖維化作用,可刺激氣道平滑肌細胞增殖,促使氣道重塑。作為啟動及維持氣道重塑的潛在關鍵因子,TGF-β1通過參與上皮間質轉化、成纖維細胞分化等氣道重塑的相關途徑,并通過激活多條細胞內信號轉導途徑從而影響細胞周期,最終導致氣道重塑的發生[14]。有研究[15]表明,TGF-β1可通過增強氣道平滑肌細胞之間的興奮-收縮偶聯機制從而上調的信號轉導蛋白Smad3和TGF-βRⅡ的表達導致平滑肌細胞增殖。而NF-κB為多條信號傳導通路的樞紐,在調控哮喘氣道重塑過程中同樣具有重要作用,其活性的增強與哮喘的發生密切相關,可通過調控細胞炎癥因子、生長因子、VCAM-1、ICAM-1及MMP等參與哮喘發病機制的多個環節。另研究[16]表明,TLR2/MyD88/NF-κB信號通路中關鍵蛋白的表達水平可有效影響機體的炎癥反應,可參與氣道炎癥反應的發生及發展。TLR2為參與非特異性免疫的TLRs家族成員之一,是哮喘易感性的主要決定因素,多項研究均表明TLR2可通過介導下游的NF-κB通路和JNK信號分子參與過敏性氣道炎癥及支氣管哮喘[17]。在本研究中,miR-204-5p的上調與TLR2的表達成負相關,且miR-204-5p表達上調組TGF-β1及NF-κB p65蛋白表達水平均下降(P<0.05),miR-204-5p表達下調組TGF-β1及NF-κB p65蛋白表達水平均上升(P<0.05)。因此推測miR-204-5p可通過調控TLR2抑制TGF-β1及NF-κB p65的表達,有效抑制氣道平滑肌細胞增殖和細胞外基質的產生。
在過敏性氣道炎癥及支氣管哮喘發生過程中,TLR2被激活與連接蛋白髓樣分化蛋白的結合,從而激活下游的信號傳遞通路,啟動細胞合成及釋放炎性因子[18],且NF-κB為一種多效轉錄因子,可對哮喘氣道炎癥過程中相關細胞炎癥因子的基因轉錄水平進行調控[19]。本研究結果顯示,表達上調組IL-4、IL-5、IL-13等細胞因子濃度下降(P<0.05),表達下調組IL-4、IL-5、IL-13等細胞因子濃度上升(P<0.05)。IL-13、IL-4、IL-5為Th2型細胞炎癥因子,Th1及Th2趨化因子的表達水平變化同哮喘患者機體免疫應答反應關系密切。在哮喘發病過程中,氣道平滑肌處于活躍狀態,平滑肌細胞過度增殖,合成分泌多種因子。在該過程中IL-4、IL-5等細胞炎癥因子可通過ERK1/2通路與細胞外基質與氣道平滑肌細胞上相應受體結合,促使氣道平滑肌細胞的增殖,同時上調TGF-β1的水平,誘導纖維化的發生,并且導致炎癥反應[2,20]。因此推測哮喘氣道炎癥的發生機制可能為miR-204-5p通過調控TLR2從而抑制Th2型細胞的活化及NF-κB的活性,減少IL-13、IL-4、IL-5等炎癥因子的釋放[20]。
綜上所述,miR-204-5p可能通過調節TLR2的表達抑制哮喘小鼠由TGF-β1及NF-κB p65誘導的氣道重塑,有效減輕小鼠的炎癥反應,可作為預防哮喘氣道重塑的潛在治療靶點。

