腫瘤相關巨噬細胞、膠質瘤干細胞和PF-L1在不同病理分級腦膠質瘤組織中的表達及相關性研究
王曉英 萬學鋒 任艷霞
腦膠質瘤本身具有強破壞性、高侵襲性、進展迅速等特點[1,2],主要分為高級別型和低級別型,其中高級別致死率高,中位生存期方面膠質母細胞瘤病人存活時間不足1年。近年研究發現,腦膠質瘤致死率高的主要原因是由于其能夠誘導產生局部和系統性的免疫抑制,而免疫抑制狀態下,腫瘤生長迅速,且不受免疫系統攻擊。而在免疫抑制過程中,腫瘤組織的微環境以及腦膠質瘤干細胞發揮關鍵作用[3,4]。PD-L1作為一種負性共刺激分子可以讓腫瘤細胞出現免疫逃逸,目前臨床開始重點研究該蛋白[5-7]。CD133作為膠質瘤干細胞(GSCs)的重要標志物,臨床和科研中CD68廣泛被用作腫瘤相關巨噬細胞(TAMs)標志物。故本研究分析病理分級不同的腦膠質瘤組織中CD133、PD-L1和CD68的表達及相關性,報告如下。
1 資料與方法
1.1 一般資料
選取2018年4月至2020年6月神經外科收治的腦膠質瘤患者68例為研究對象,男性40例,女性28例,年齡24~68歲(中位年齡46歲)。納入標準:第一次確診為腦膠質瘤者;經手術切除治療,術后取得標本;術前未接受放、化療;對本研究知情同意。排除標準:合并其他惡性腫瘤、糖尿病和風濕免疫性疾病等;臨床、隨訪資料不完整者。按照WHO在2007年制定的標準將其分為Ⅰ級和Ⅱ級(低級別膠質瘤)和Ⅲ級和Ⅳ級(高級別膠質瘤),本研究低級別組34例,其中Ⅰ級9例,Ⅱ級25例;高級別組34例,其中Ⅲ級14例,Ⅳ級20例。兩組患者一般資料可比(P>0.05)。
1.2 方法
1.2.1 儀器與試劑 小鼠抗人CD68抗體(批號:ab201973)、兔抗人PD-L1抗體(批號:ab213524)均購自Abeam公司;兔抗人CDl33抗體(產品編號:bs-0395R)購自北京博奧森公司;SP試劑盒(批號:KIT-9720)、DAB顯色試劑盒(批號:DAB-0031)、緩沖液等均購于上海西格生物科技有限公司。
1.2.2 檢測方法 切取每例患者3張不間斷的石蠟標本,厚度在4 μm左右,按照說明書對其中的CDl33、PD-L1和CD68蛋白進行免疫組化染色。在400倍的視野下尋找不間斷的3張切片的相同區域位置,然后拍照,染色結果用Image-Pro 軟件分析其光密度,從而定量分析不同病理級別的腦膠質瘤組織內的CD133、PD-L1和CD68蛋白的表達情況。每張切片隨機觀察視野區域個數超過20個。
1.3 統計學處理

2 結果
2.1 CD133、CD68和PD-L1在不同病理級別腦膠質瘤組織中的表達
CD133、PD-L1和CD68在高級別組腦膠質瘤組織內的表達量顯著高于低級別組,差異顯著(P<0.001)。見表1。
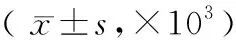
表1 CD133、CD68和PD-L1在不同病理級別腦膠質瘤組織中的表達
2.2 CD133、PD-L1和CD68表達與腦膠質瘤病理分級的相關性
CD133、PD-L1和CD68在腦膠質瘤組織中的表達與其病理分級呈正相關,見表2。
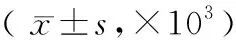
表2 CD133、PD-L1和CD68表達與腦膠質瘤病理分級的相關性
3 討論
腦膠質瘤高惡性程度,且患者預后極差,確診后采取各種措施綜合治療后,復發率仍較高[8]。隨著腫瘤病理學研究的不斷深入,Paget提出的腫瘤生長的“土壤和種子”學說[9],這使惡性腫瘤的認識有了飛躍式的進步。在腦膠質瘤組織內,GSCs作為“種子”可以利用誘導產生免疫抑制,進而使腫瘤細胞可以不讓自身的免疫系統監視、清除,在放化療過程中具有很強的抵抗性。GSCs被當做腦膠質瘤的起源細胞,有報道[10-12]表明,GSCs本身具有的逃避人體免疫監控能力和腫瘤微環境這種作為“土壤”的PD-L及巨噬細胞等關鍵成分之間關系密切。免疫細胞、腫瘤細胞以及各類因子共同構成的腫瘤微環境,其細胞成分中具有大量的TAMs[13],腦膠質瘤組織內大量的巨噬細胞/小膠質細胞浸潤在TAMs中,占腫瘤細胞團比例接近4成,遠超淋巴細胞數量,說明了TAMs在腦膠質瘤細胞免疫逃逸中發揮著極為重要額作用[14,15]。B7家族的負性共刺激分子成員之一的PD-L1,可以作用于受體PD-1,從而讓腫瘤免疫逃逸產生作用。因此,研究腫瘤組織中PD-L1蛋白的表達及調控對于腦膠質瘤意義重大。
在腦膠質瘤的組織細胞當中,同時存在GSCs、PD-L1和TAMs,但過去大量研究集中在PD-L1在TAMs和GSCs分開表達,對于它們是否在免疫逃逸中發揮作用的研究,并不多見。本研究探究了病理級別存在差異腦膠質瘤的組織內CDl33、PD-L1和CD68的表達及相關性,結果發現,腦膠質瘤的組織內PD-L1和CD68在巨噬細胞上共同表達,即PD-L1為陽性的巨噬細胞大多和腫瘤相關,且隨病理級別上升,PD-L1和CD68蛋白水平亦上升。腦膠質瘤組織內的CDl33、PD-L1和CD68 mRNA在的表達和病理分級呈正相關;高級別組中三者的表達水平較低級別組高;進一步分析發現,腦膠質瘤的組織細胞內的CDl33、PD-L1、CD68表達在不同病理分級中呈正相關。提示腦膠質瘤的惡性程度和CDl33、PD-L1和CD68的表達關系密切,且以往研究發現,CDl33、CD68均與PD-L1均存在一定的正相關關系。表明三者在腦膠質瘤發展中共同發揮作用。這可能是GSCs通過誘導TAMs高表達PD-L1,從而讓機體的免疫監視無法探測到,加速腦膠質瘤細胞快速生長。因此通過“種子”與“土壤”進行雙向調節,從而避免膠質瘤進一步惡化,或可為臨床治療帶來新的思路。
綜上所述,PD-L1在膠質瘤組織內主要通過腫瘤微環境中的TAMs進行表達;腦膠質瘤的惡性程度和CDl33、PD-L1和CD68表達關系密切。

