PTP1B基因缺失在膿毒癥胰島素抵抗大鼠中的作用及可能機制▲
周 賢 許 濤
(湖北省武漢市第四醫院重癥醫學科,武漢市 430034,電子郵箱:413360716@qq.com)
膿毒癥是由宿主對感染反應失調而引起的危及生命的器官功能障礙[1]。膿毒癥會引起神經-內分泌系統激活以及炎性介質過度釋放,導致機體代謝紊亂,出現高分解代謝狀態以及胰島素抵抗,進而導致高血糖狀態[2]。而長期高血糖狀態,會增加患者的病死率[3]。膿毒癥的胰島素抵抗不同于糖尿病患者的胰島素抵抗,膿毒癥的胰島素抵抗通常隨著應激因素的消失而改善,一般僅持續數天到數周,有學者將這種現象稱為急性胰島素抵抗[4]。對于膿毒癥所致胰島素抵抗及高血糖,臨床上一般采用強化胰島素治療方案。但是部分臨床研究結果卻提示強化胰島素治療反而增加了低血糖事件的發生,進而導致患者的病死率升高[5]。我們在臨床實踐中還觀察到,少部分重癥病例即使采用強化胰島素治療,其高血糖也難以控制。由此可見,對于膿毒癥重癥患者,探索能夠改善其急性胰島素抵抗的新方法具有重要臨床意義。有研究表明,炎癥因子在膿毒癥胰島素抵抗中發揮重要作用,而蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)是炎癥因子與代謝性疾病之間的關鍵紐帶[6]。為此,本文從胰島素受體前炎癥因子、受體后胰島素信號傳導通路以及葡萄糖轉運蛋白移位3個層面,探討大鼠PTP1B基因缺失對膿毒癥所致胰島素抵抗的影響。
1 材料與方法
1.1 實驗動物 選擇40只(其中20只敲除PTP1B基因)56日齡健康雌性無特定病原體級SD大鼠,大鼠購自湖北省實驗動物研究中心(許可證號:SCXK2020-0018),體重180~220 g,飼養于標準實驗室條件下[光/暗周期為12/12 h(光照時間7:00~19:00),溫度為21℃~24℃,濕度為40%~60%],自由攝食和飲水。
1.2 主要儀器和試劑 DR-200B型酶標儀(DIATEK公司),QY-PO-VPT型血糖儀(三諾生物傳感公司),TGL-16c型臺式離心機(上海安亭科學儀器廠),GNP9160型恒溫培養箱(上海精宏實驗設備有限公司),DYY-6C型電泳儀(北京市六一儀器廠),DYCZ-400D型轉移電泳儀槽(北京市六一儀器廠),CX-21型普通光學顯微鏡(Olympus公司),MicroPublisher成像系統(QImaging公司)。磷酸緩沖鹽溶液(phosphate buffered saline,PBS;批號:AS1044)、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝膠制備試劑盒(批號:AS1012)、RIPA總蛋白裂解液(批號:AS1004)、二喹啉甲酸蛋白質濃度測定試劑盒(批號:AS1086)、增強型化學發光檢測試劑盒(批號:AS1059)、辣根過氧化物酶(horseradish peroxidase,HRP)標記羊抗兔IgG二抗(批號:AS1107)、CY3標記山羊抗兔IgG二抗(批號:AS-1109)均由ASPEN Biotechnology CO.,LTD生產;大鼠腫瘤壞死因子α(tumor necrosis factor α,TNF-α)ELISA試劑盒(批號:ELK1396)、大鼠胰島素ELISA 試劑盒(批號:ELK2370)均由ELK Biotechnology CO.,LTD生產;甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體(批號:ab181602)由Abcam公司生產;蛋白激酶B(protein kinase B,Akt;批號:#4060)、磷酸化Akt(phosphorylated Akt,p-Akt;批號:#9272)由CST公司生產;葡萄糖轉運蛋白(glucose transporter,GLUT)-2抗體(批號:GTX0254)由Gentex公司生產;抗熒光淬滅劑(批號:AS1089)由武漢阿斯本生物技術有限公司生產。
1.3 分組與動物模型的建立 采用隨機數字表,將20只敲除PTP1B基因的大鼠分為PTP1B(-/-)假手術組(n=10,進行假手術)和PTP1B(-/-)膿毒癥組(n=10,建立膿毒癥所致胰島素抵抗模型),將其余20只野生型大鼠分為野生型假手術組(n=10,進行假手術)和野生型膿毒癥組(n=10,建立膿毒癥所致胰島素抵抗模型)。建模主要步驟如下[7]:使用腹腔注射氯胺酮75 mg/kg麻醉大鼠,麻醉成功后開腹后使用4號絲線結扎盲腸末端,再以手術針頭刺破腸壁,擠出少許糞便,然后將盲腸納入腹腔,逐層縫合腹壁,術畢腹腔內注射3 mg/kg內毒素(Sigma公司,批號:L2630)。假手術組的大鼠接受同樣的手術,但盲腸既不結扎也不穿刺,術畢腹腔內注射3 mL/kg生理鹽水。大鼠在麻醉前6 h及術后24 h禁食不禁水。
1.4 胰島素抵抗指數的測定 于術后12 h取大鼠尾靜脈血標本1 mL,采用血糖儀測大鼠空腹血糖值,采用ELISA法檢測大鼠空腹胰島素,按照試劑說明書進行操作。計算穩態模型評估胰島素抵抗(homeostasis model assessment-insulin resistance,HOMA-IR)指數,HOMA-IR指數=空腹血糖(mmol/L)×空腹胰島素(mIU/mL)/22.5。
1.5 血清炎癥因子的測定 于手術后24 h取大鼠尾靜脈血標本1 mL,采用ELISA法測定大鼠血清炎癥因子TNF-α水平,按照試劑說明書進行操作。
1.6 肝臟組織Akt磷酸化水平的檢測 術后24 h每只大鼠注射人胰島素(江蘇萬邦生化醫藥公司,批號:22112203)0.5 U/kg,使胰島素與胰島素受體結合,從而促進胰島素信號通路及轉運蛋白移位。15 min 后處死大鼠,取大鼠肝右葉組織。采用蛋白免疫印跡試驗檢測大鼠肝臟組織Akt與p-Akt表達水平,并根據灰度值計算p-Akt/Akt的比值,了解Akt磷酸化水平。取大鼠肝組織0.5 g,采用RIPA總蛋白裂解液提取總蛋白,采用二喹啉甲酸法測定總蛋白濃度。按照每泳道加入50 μg的蛋白樣品進行上樣,采用10%的SDS-PAGE凝膠進行蛋白電泳,完成電泳后進行濕法轉膜,然后使用2%牛血清白蛋白溶液封閉1 h。在4℃條件下孵育一抗GAPDH(1∶10 000)、p-Akt(1∶1 000)、Akt(1∶2 000)過夜,用 TBST漂洗,室溫下孵育HRP標記羊抗兔IgG二抗(1∶10 000)1 h,完成后再次用TBST漂洗。滴加配制的增強型化學發光試劑盒工作液到膜上,暗室中曝光。根據光強度調整曝光條件,顯影、定影。掃描并存檔膠片,AlphaEaseFC軟件分析目標帶的灰度值。
1.7 GLUT-2轉移情況的檢測 免疫熒光技術檢測GLUT-2向肝細胞膜轉移情況。取大鼠剩余肝右葉組織標本并制作石蠟切片備用,石蠟切片預處置后置于3%過氧化氫溶液中,室溫下避光孵育10 min,再用5%牛血清白蛋白封閉20 min。滴加一抗GLUT-2抗體(1∶100),4℃過夜。將切片用PBS洗滌3次,每次5 min。去除PBS,滴加CY3標記山羊抗兔IgG二抗(1∶50),37℃孵育50 min。每張切片加50~100 μL的4,6-聯脒-2苯基吲哚染液,室溫避光孵育5 min。染色后將切片放入PBS中洗3次,每次5 min。滴加適量的抗熒光淬滅劑于組織上,蓋玻片覆蓋,熒光顯微鏡下觀察。GLUT-2免疫熒光染色后紅染為陽性。
1.8 統計學分析 采用SPSS 19.0軟件進行統計分析,正態分布的計量資料以(x±s)表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗,以P<0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠的胰島素抵抗情況 野生型假手術組與PTP1B(-/-)假手術組大鼠的HOMA-IR指數差異無統計學意義(P>0.05);野生型膿毒癥組、PTP1B(-/-)膿毒癥組大鼠的HOMA-IR指數分別高于野生型假手術組、PTP1B(-/-)假手術組大鼠(均P<0.05);PTP1B(-/-)膿毒癥組大鼠的HOMA-IR指數低于野生型膿毒癥組(均P<0.05)。見表1。
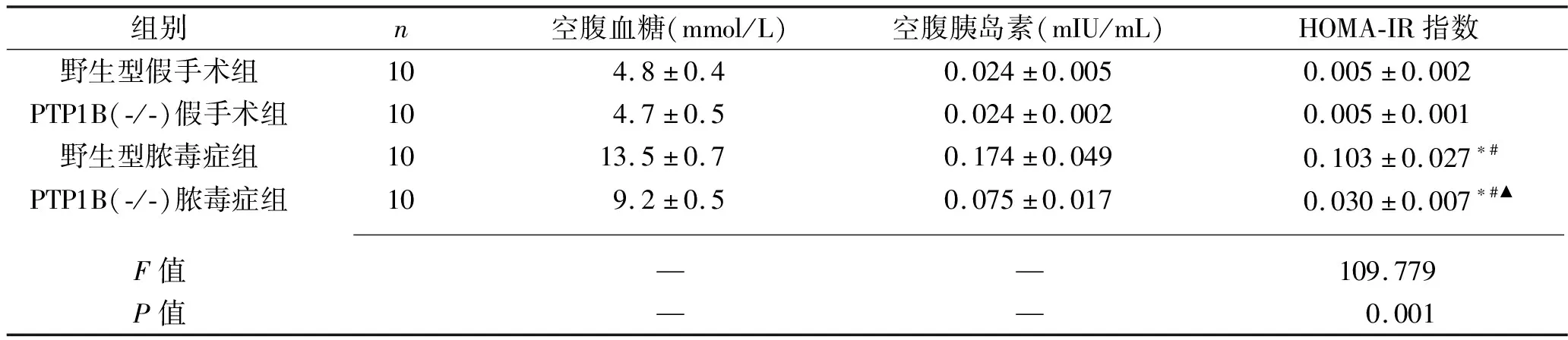
表1 各組大鼠胰島素抵抗情況的比較(x±s)
2.2 各組大鼠的血清炎癥因子水平 野生型假手術組與PTP1B(-/-)假手術組大鼠血清TNF-α水平差異無統計學意義(P>0.05);野生型膿毒癥組、PTP1B(-/-)膿毒癥組大鼠血清TNF-α水平分別高于野生型假手術組、PTP1B(-/-)假手術組(均P<0.05);PTP1B(-/-)膿毒癥組血清TNF-α水平低于野生型膿毒癥組(P<0.05)。見表2。

表2 各組大鼠血清TNF-α比較(x±s,pg/mL)
2.3 各組大鼠肝組織中的p-Akt/Akt表達 野生型假手術組與PTP1B(-/-)假手術組大鼠肝組織p-Akt/Akt比值差異均無統計學意義(均P>0.05);野生型膿毒癥組、PTP1B(-/-)膿毒癥組大鼠肝組織p-Akt/Akt比值分別低于野生型假手術組、PTP1B(-/-)假手術組(均P<0.05);PTP1B(-/-)膿毒癥組肝組織和p-Akt/Akt比值均高于野生型膿毒癥組(均P<0.05)。見表3和見圖1。
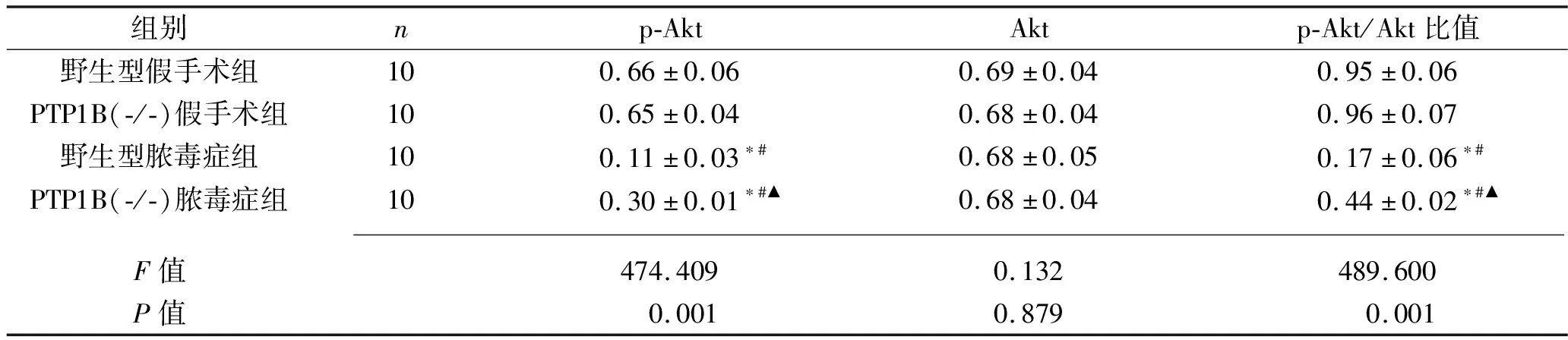
表3 各組大鼠肝組織中Akt蛋白磷酸化水平的比較(x±s)
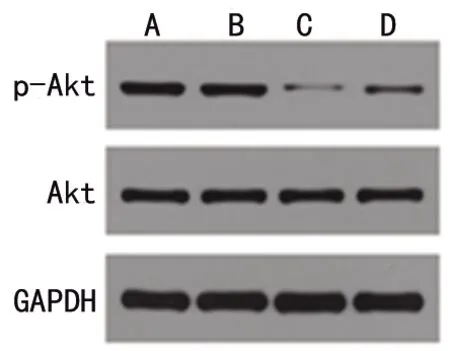
圖1 各組大鼠p-Akt、Akt蛋白表達情況
2.4 各組大鼠肝細胞GLUT-2轉移情況 野生型假手術組與PTP1B(-/-)假手術組中,GLUT-2蛋白在肝細胞漿和肝細胞膜上均有表達,且在膜上表達明顯;野生型膿毒癥組的GLUT-2蛋白大部分表達在肝細胞漿中,肝細胞膜上表達少;PTP1B(-/-)膿毒癥組的 GLUT-2蛋白在肝細胞漿和肝細胞膜上均有表達,但在膜上的表達較野生型假手術組與PTP1B(-/-)假手術組明顯減少,較野生型膿毒癥組明顯增多。見圖2。
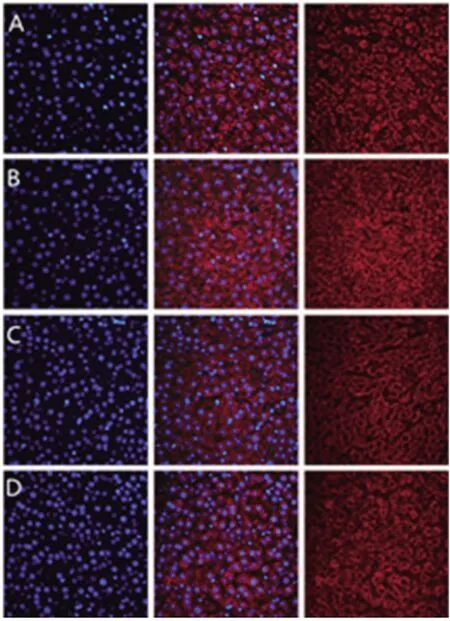
圖2 各組大鼠肝細胞膜GLUT-2表達情況(免疫熒光染色,×400)
3 討 論
PTP1B是由PTPN1基因編碼的蛋白質,由435個氨基酸組成。人體內總共有100多種蛋白酪氨酸磷酸酶,而PTP1B是第一個被發現的哺乳動物蛋白酪氨酸磷酸酶[8]。PTP1B的C端富含脯氨酸將其定位在內質網上,N端為N-乙酰基甲硫氨酸,起著催化結構域的作用[9]。PTP1B的催化結構域與胰島素受體結合,通過去磷酸化信號分子終止胰島素信號傳導,對胰島素信號傳導通路起到負性調節的作用。催化結構域的點突變不會影響PTP1B的整體活性,但是可以干擾PTP1B與胰島素受體的結合,使胰島素受體不能去磷酸化,從而影響胰島素信號傳導通路[10]。既往有關研究表明,在敲除PTP1B基因之后實驗大鼠的表型與壽命均正常,但是可以抵抗高脂肪喂養誘導的肥胖發生,并且胰島素的敏感性顯著增強[11]。此外,有研究顯示,體內細胞炎癥因子可以誘導PTP1B蛋白的過度表達,表明炎癥因子水平與PTP1B的表達密切相關[12]。
本研究采用大鼠進行盲腸結扎穿孔聯合腹腔內內毒素注射建立膿毒癥致胰島素抵抗大鼠模型,可以觀察到野生型膿毒癥組大鼠的HOMA-IR指數較野生型假手術組增加,提示建模成功;而PTP1B(-/-)膿毒癥組大鼠的HOMA-IR指數較野生型膿毒癥組降低,這說明PTP1B基因的缺失可以一定程度上改善膿毒癥大鼠的胰島素抵抗。此外,野生型膿毒癥組大鼠的血清TNF-α水平較野生型假手術組增加,而PTP1B(-/-)膿毒癥組大鼠的血清TNF-α水平低于野生型膿毒癥組,這說明膿毒癥發生時大鼠體內會產生大量炎性因子,而PTP1B基因的缺失可能影響炎性因子的釋放,從而可抑制機體的炎癥反應。
膿毒癥的主要病理生理學特點是全身炎癥反應綜合征,膿毒癥患者體內會產生大量炎性因子,例如由單核-巨噬細胞或者損傷組織釋放的促炎性介質TNF-α、白細胞介素(interleukin,IL)-1、IL-6、IL-10等;這些炎癥因子大量釋放并形成逐漸放大的“瀑布樣”鏈式反應,最終導致失控的全身炎癥反應,同時這些炎性因子還可以改變胰島素信號通路的傳導,其可能的機制是與胰島素競爭靶細胞膜上的胰島素受體[13]。而胰島素在靶細胞內發揮生理作用主要取決于葡萄糖的跨膜轉運,而這一過程需要借助于GLUT[14]。GLUT通常在細胞膜與細胞質之間循環,在胰島素與靶細胞膜上的胰島素受體結合之后,細胞質中的GLUT移位到細胞膜上,從而發揮其生理作用。GLUT的移位受到胰島素信號傳導通路的調節,其中的經典通路是磷脂酰肌醇3-激酶/Akt通路,胰島素與胰島素受體結合之后激活該通路,可以促進葡萄糖轉運蛋白向細胞膜移位[15],而Akt的磷酸化是該信號傳導通路的關鍵限速步驟之一。在本研究中,野生型膿毒癥組大鼠肝組織的p-Akt/Akt以及GLUT-2蛋白在肝細胞膜上的表達均較野生型假手術組減少,而PTP1B(-/-)膿毒癥組大鼠的上述指標均較野生型膿毒癥組增加。這表明PTP1B基因缺失可提高膿毒癥大鼠Akt磷酸化水平(p-Akt/Akt),進而增強胰島素傳導信號,同時可促進GLUT轉運至肝細胞膜,從而增強胰島素在靶細胞內的生理作用。
綜上所述,在大鼠中PTP1B基因缺失可以改善膿毒癥所致的胰島素抵抗,其可能機制是減輕細胞外的炎癥因子水平從而緩解對胰島素受體的競爭效應以及改變細胞內的胰島素信號轉導通路。本研究結果或可為PTP1B抑制劑治療膿毒癥所致胰島素抵抗提供一定的理論基礎。

