4種檢測項目對多發(fā)性骨髓瘤診療價值的研究
魏 娜,王 劍,陸 捷△
華中科技大學(xué)同濟醫(yī)學(xué)院附屬同濟醫(yī)院:1.檢驗科;2.計算機中心,湖北武漢 430030
多發(fā)性骨髓瘤(MM)是惡性漿細(xì)胞瘤中最常見的一種類型,以惡性漿細(xì)胞在患者骨髓組織中的克隆性增殖、積聚和對相關(guān)終末器官的損害為特征[1],可分泌大量單克隆免疫球蛋白(Ig)或其片段,而正常多克隆Ig分泌、漿細(xì)胞的增生受到限制,患者出現(xiàn)貧血、感染、骨質(zhì)破壞等表現(xiàn),可累及全身多個系統(tǒng)[2]。該病中老年人群易發(fā),男性患者略多于女性(男女比例約為1.4︰1),男性患者發(fā)病中位年齡69歲,女性患者發(fā)病中位年齡71歲,發(fā)病率在血液系統(tǒng)腫瘤中僅次于淋巴瘤,目前無法治愈[3-4]。隨著新型蛋白酶體抑制劑、新型免疫調(diào)節(jié)劑、造血干細(xì)胞移植、單克隆抗體及嵌合抗原受體T細(xì)胞免疫療法的應(yīng)用,MM患者生存率明顯提高。由于MM發(fā)病率逐年增高,臨床表現(xiàn)多種多樣,故早期診斷對該病的后期治療、預(yù)后具有重要意義。本研究總結(jié)了4種檢測方法對MM的診療價值,現(xiàn)報道如下。
1 資料與方法
1.1一般資料 選取本院2020年6月至2021年6月收治的235例MM患者作為觀察組,患者均符合《中國多發(fā)性骨髓瘤診治指南(2020年修訂)》[5]診斷標(biāo)準(zhǔn),并經(jīng)病理診斷確診。其中男141例,女94例;年齡35~91歲,平均(60.09±9.34)歲。選取同期80例體檢健康者作為對照組,其中男50例、女30例,平均年齡(59.52±8.12)歲。兩組在年齡、性別等方面比較,差異無統(tǒng)計學(xué)意義(P>0.05),具有可比性。
1.2儀器與試劑 使用美國Beckman公司IMMAGE800特種蛋白分析儀及配套試劑檢測IgG、IgA、IgM;血清游離κ和血清游離λ輕鏈定量采用Roche Cobas8000自動生化分析儀(德國羅氏公司)進行檢測,其配套試劑使用The Binding Site Group Ltd產(chǎn)品;血清免疫固定電泳(IFE)、血清蛋白電泳(SPE)的檢測使用法國Sebia Hydrasys 2型瓊脂糖凝膠電泳分析儀。
1.3方法 采集受檢者5 mL靜脈血,離心取上清液,采用免疫比濁法檢測IgG、IgA、IgM以及血清游離κ輕鏈和血清游離λ輕鏈。IFE:將血清標(biāo)本加樣、電泳、固定、洗脫和染色,掃描并分析結(jié)果。出現(xiàn)均一、深染的沉淀帶即為M帶。SPE:使用瓊脂糖凝膠電泳法進行檢測,獲得良好的分離效果后將蛋白分離成清蛋白,α1、α2、β、γ球蛋白和M蛋白,光密度掃描得到各蛋白百分含量。
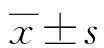
2 結(jié) 果
2.1兩種電泳方法M蛋白的檢出情況 SPE中M蛋白檢出率為89.36%,而IFE中M蛋白檢出率為98.3%。見表1。

表1 兩種電泳方法M蛋白的檢出率比較
2.2MM患者IFE的免疫分型結(jié)果 235例MM患者IFE可見M帶的有231例,4例非分泌型MM未檢出M蛋白。由表2可見,患者的M蛋白以IgG型最多(44.26%),IgA型和輕鏈型次之(分別為23.83%和17.45%),IgM型較少見(1.70%)。本次試驗發(fā)現(xiàn)5例雙克隆型,1例重鏈型,但未發(fā)現(xiàn)IgE型,IgM型M蛋白因檢出例數(shù)過少,本研究不納入比較。電泳結(jié)果顯示,可見條帶分布寬且分離良好的M帶,見圖1。

注:A為IgG-λ型;B為IgM-κ型;C為IgA-κ型;D為IgG-λ型伴IgM-κ型;ELP為對照泳道;標(biāo)有G、A、M、K、L字母的泳道是分別加用抗IgG、IgA、IgM重鏈和抗κ、λ輕鏈抗體的泳道。

表2 235例MM患者的IFE免疫分型結(jié)果
2.3Ig定量及游離輕鏈比值的測定 IgA型、IgG型和游離輕鏈型MM患者中,血清IgA、IgG和IgM均出現(xiàn)相應(yīng)變化,與對照者相比,差異均有統(tǒng)計學(xué)意義(P<0.05)。在κ型M蛋白的患者中,血清游離κ輕鏈和κ/λ均高于對照者(P<0.05);在λ型M蛋白的患者中,血清κ/λ低于對照者(P<0.05),血清游離λ輕鏈高于對照者(P<0.05)。見表3。
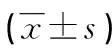
表3 MM患者和對照者輕鏈κ、λ水平和血清Ig定量測定
3 討 論
MM發(fā)病年齡呈年輕化趨勢,病情進展緩慢,早期大多表現(xiàn)為骨痛、貧血、紅細(xì)胞沉降率增快等多種不典型臨床表現(xiàn),且骨髓細(xì)胞形態(tài)學(xué)檢查很難將其與漿細(xì)胞白血病區(qū)分開來,Ig的增加也不能將其與諸如巨球蛋白血癥等疾病區(qū)分開來。相關(guān)研究報道,MM患者臨床誤診率可達50%[6]。因此,對MM的早期、準(zhǔn)確診斷具有非常重要的意義。
SPE屬于蛋白質(zhì)分離最為簡便的方式之一,同時也可以獲得血清蛋白的整體圖譜,對于血清中異常蛋白質(zhì)(α至γ球蛋白區(qū)間出現(xiàn)M條帶)的篩選效果十分突出[7]。但是SPE對于M蛋白與α或β區(qū)帶重合無法檢出,通過SPE難以分辨β球蛋白區(qū)與γ球蛋白區(qū)出現(xiàn)的急性時相反應(yīng)蛋白或脂蛋白急劇增加時所引起的峰型[8],需要聯(lián)合IFE做進一步篩查。另外,在非分泌型MM患者中由于血清中不產(chǎn)生單一的異常Ig,在SPE中未出現(xiàn)M蛋白峰,而輕鏈型中由于M蛋白含量低,部分蛋白電泳M帶也不明顯,容易漏診,此時則需要通過IFE進行確認(rèn)。
另外,輕鏈型、不常見型或非分泌型MM患者的血清球蛋白水平并不會增高,需要通過檢測Ig的血清蛋白水平進一步明確MM免疫類型[9],非分泌型MM患者還需要結(jié)合病情進行判斷,必要時需進行骨髓穿刺確認(rèn)。
臨床上通過IgM型M蛋白檢測,檢出的淋巴瘤或者巨球蛋白血癥患者較多,而MM患者較少。定量檢測血清Ig可以更加了解M蛋白的數(shù)量及具體類型,但MM患者普遍存在免疫功能障礙,單克隆Ig逐漸成為優(yōu)勢蛋白時,正常Ig水平會降低。只是單單依靠Ig定量檢測并不能準(zhǔn)確診斷MM,還需要進一步行IFE。
IFE是由抗原-抗體反應(yīng)與電泳技術(shù)相結(jié)合的分析技術(shù),結(jié)合單克隆抗體的高敏感性、高特異性以及蛋白質(zhì)電泳的高分辨率分離技術(shù),具有分辨率好、敏感性高、特異性高、可直接判讀等優(yōu)點,是目前主要應(yīng)用于鑒別M蛋白的方法之一[10]。需要注意的是:某些單克隆蛋白質(zhì)可能因多聚體形成而導(dǎo)致所有的免疫固定泳道上均出現(xiàn)單克隆片段。這種情況下需準(zhǔn)備1% β-巰基乙醇,加25 μL還原劑于75 μL血清中,混勻并放置至少15 min(至多3 h)。
MM患者常常出現(xiàn)單克隆漿細(xì)胞異常增生并且分泌大量的單克隆Ig(M蛋白),同時產(chǎn)生大量過剩的游離輕鏈,從腫瘤性漿細(xì)胞中排到血清中,從而使正常的Ig生成受到抑制[11]。單克隆成分占據(jù)絕對優(yōu)勢而正常Ig水平降低是MM的M蛋白特點之一。因此,在日常檢測工作中,遇到某一種Ig水平升高而其他Ig水平降低,如IgG定量結(jié)果升高而IgA、IgM定量結(jié)果降低或低于檢測下限時,應(yīng)及時與臨床溝通并建議送檢IFE來進一步排查。
Ig定量使用的是免疫比濁法,當(dāng)抗原過剩時會造成鉤狀效應(yīng),Ig水平并未升高,從而導(dǎo)致部分樣本漏檢,這時就需要進一步采用IFE篩查。如果標(biāo)本在起始稀釋度條件下抗原過量,應(yīng)在更高稀釋度條件下重新檢測,進而得到更加符合電泳模式的結(jié)果。
血清游離輕鏈檢測則可以減少電泳技術(shù)對不分泌型多發(fā)性骨髓瘤(NSMM)的漏檢。國外的研究也顯示,經(jīng)過干細(xì)胞移植前的MM患者,其血清中的游離輕鏈比值與早期疾病的進展有關(guān),血清游離輕鏈水平的降低也可以預(yù)測干細(xì)胞移植后的良好結(jié)局[12]。目前,血清游離輕鏈κ/λ已成為MM部分緩解或完全緩解的判斷標(biāo)準(zhǔn)之一,是預(yù)測MM患者預(yù)后的獨立危險因子[13]。
綜上所述,SPE、IFE、血清Ig定量和游離輕鏈比值對MM的臨床診療價值較高,可先用Ig定量與SPE實現(xiàn)初步篩查,而后使用IFE技術(shù)實現(xiàn)臨床診斷及鑒別診斷。在結(jié)合型MM中,SPE中M蛋白水平的降低可作為療效監(jiān)測指標(biāo),而在游離型MM中可將游離輕鏈的比值應(yīng)用于監(jiān)測MM的病情變化,指導(dǎo)臨床選擇與制訂診療方案,評估療效。因此,這4種項目聯(lián)合檢測可以更好地為臨床診斷和療效評估提供參考。

