嗜酸硫桿菌在工農業中的應用
高雪彥 陳林旭 陳顯軻 龐昕 潘登 林建群
(1. 山東第一醫科大學(山東省醫學科學院)醫學科技創新中心,濟南 250000;2. 山東大學微生物技術國家重點實驗室,青島 266237; 3. 山東億安生物工程有限公司,濟南 250000)
嗜酸硫桿菌(屬)(Acidithiobacillus spp.)是一類嗜酸性專性化能自養細菌,能從亞鐵、硫或還原性硫化物(reduced inorganic sulfur compounds,RISCs)的氧化中獲得生長所必需的能量和還原力,以卡爾文循環固定空氣中的二氧化碳為碳源,實現自養生長[1-3]。嗜酸硫桿菌廣泛存在于陸地或海洋的酸性環境中,作為地質微生物的重要成員,因其亞鐵和硫代謝的生理特點參與地球硫和鐵元素循環,促進酸性環境的產生和酸性微生態系統的形成[4-5]。隨著微生物分離培養技術的進步和生物信息學的發展,越來越多的嗜酸硫桿菌被發現、分離并鑒定。根據NCBI數據庫上的信息,目前已經鑒定的嗜酸硫桿菌有9種,包括A. ferrooxidans、A. ferrivorans、A. ferridurans、A. ferriphilus、A. ferrianus、A. thiooxidans、A. caldus、A. albertensis和A. sulfuriphilus,這9種嗜酸硫桿菌都具有硫氧化的能力,其中A. ferrooxidans、A. ferrivorans、A. ferridurans、A. ferriphilus和A. ferrianus這5種細菌,既具有亞鐵氧化的能力也具備硫氧化的能力,部分嗜酸硫桿菌還具有代謝氫的能力 (表1)[6-14]。
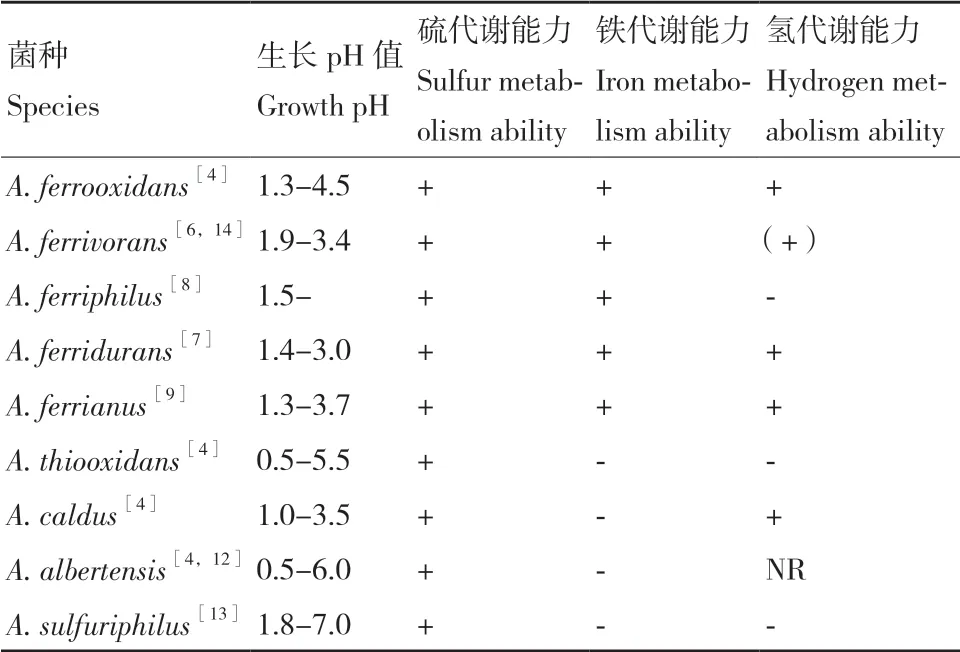
表1 九種嗜酸硫桿菌基本生理代謝特征Table 1 Physiological and metabolic characteristics of 9 species of Acidithiobacillus spp.
近年來,由于嗜酸硫桿菌獨特的硫和亞鐵代謝能力以及對重金屬離子和酸性環境較強的適應能力,使其在工農業中的應用價值越來越顯著[15-16]。本文綜述了嗜酸硫桿菌基本的生理代謝特點和環境適應機制,介紹了嗜酸硫桿菌在金屬礦產資源的開采、重金屬的資源回收、重金屬環境污染治理、生物脫硫以及土壤修復等方面的應用,結合社會需求和嗜酸硫桿菌的研究現狀,分析了嗜酸硫桿菌在理論基礎和應用實踐中亟待解決的重要科學問題,助力嗜酸硫桿菌理論基礎和產業應用的研究。
1 嗜酸硫桿菌生理代謝特點
1.1 嗜酸硫桿菌硫代謝機制
元素硫是構成生命體重要組成元素,具有-2到+6多種價態形式,從而產生了多種多樣的含硫化物,包括連四硫酸鹽(S4O62-)、硫代硫酸鹽(S2O32-)、亞硫酸鹽(SO32-)、硫化物(S2-)、硫酸鹽(SO42-)和元素硫(S0)[4]。嗜酸硫桿菌可以高效氧化各種還原態的無機硫化合物(RISCs)以獲得用于自養生長的能量,因而成為地球硫元素循環的重要組成部分。嗜酸硫桿菌具有復雜的硫代謝酶系,如元素硫氧化酶、硫代硫酸鹽氧化途徑中的酶、亞硫酸鹽氧化酶等,這些酶分布在細胞膜、細胞周質、細胞質等不同的區域協同作用,將單質硫或還原的無機硫化合物氧化為最終產物硫酸鹽[11,17-19]。
硫代謝過程涉及到復雜的酶促反應,根據在細胞中的反應區域可以劃分為細胞外膜、細胞周質、細胞內膜和細胞質幾個部分。首先,細胞外的元素硫被分布在細胞外膜上的蛋白(outer-membrane proteins,OMP)激活轉運,進入周質空間[11,17]。單質硫活化轉運是硫代謝過程中至關重要的環節,據報道,嗜酸硫桿菌以單質硫為能源培養時延遲期時間比較長,細胞生長緩慢,推測這一時期單質硫被活化轉運。其次,在細胞周質空間,硫氧化酶系統(sulfur oxidizing enzyme system,Sox)發揮了重要作用[4]。典型的Sox系統由SoxYZ、SoxXA、SoxB和Sox(CD)2四種蛋白組成,二聚體蛋白SoxYZ在硫代謝過程中具有結合硫化物的作用,SoxXA能夠催化氧化還原反應并獲得電子[4]。Sox系統的4個組成蛋白形成一個循環反應,具有將單質硫、硫代硫酸鹽、亞硫酸鹽和硫化氫等還原性硫化物氧化成硫酸鹽的能力,硫代硫酸鹽氧化是該氧化途徑的核心[20]。Sox系統以多種形式在部分嗜酸硫桿菌中存在,研究發現A. caldus,A. thiooxidans和A. albertensis中含有缺失了Sox(CD)2蛋白的兩套不完整的Sox系統,Sox I和Sox II,分別由soxYZBhyp-resB-soxAX-resC和soxXYZA-hyp-soxB基因編碼的蛋白構成。在Sox II系統基因簇的上游發現了依賴于sigma54轉錄因子的的雙組分系統tspS-tspR[21]。具有硫和亞鐵雙能量代謝途徑的A. ferrooxidans細菌缺失Sox系統[18-19]。然而,在A. ferrooxidans中存在硫代硫酸鹽脫氫酶(thiosulfate dehydrogenase,TSD),推測可能是周質中存在的硫代硫酸鹽代謝途徑[4,19]。此外,由連四硫酸鹽水解酶(tetrathionate hydrolase,TetH)和硫代硫酸鹽-輔酶Q氧化還原酶(thiosulfate quinone oxidoreductase,TQO)介 導的連四硫酸鹽和硫代硫酸鹽的轉化反應也是細胞周質空間中重要的硫氧化反應過程[4,18]。在細胞內膜和胞質中同樣存在具有硫氧化作用的蛋白酶,如定位于內膜的硫化物-輔酶Q氧化還原酶(sulfide:quinone oxidoreductase,SQR)、HDR復合體(hdr-like complex),位于胞質中的硫加氧還原酶(sulfur oxygenase reductase,SOR)以及硫氰酸酶(rhodanese,RHD)等,部分氧化酶與輔酶Q相連,傳遞硫氧化過程中產生的電子,獲得能量[11,17-18]。
由于元素硫的價態比較多,硫化物的種類繁雜、多樣,因此嗜酸硫桿菌的硫代謝機制比較復雜,涉及到分布在不同細胞區域的幾十種活性蛋白的協同作用。目前文獻報道的嗜酸硫桿菌硫代謝模型大部分都是基于基因測序技術和生物信息學的模擬推測,尚有很多未解之謎值得繼續深入研究。
1.2 嗜酸硫桿菌亞鐵代謝途徑
目前發現的9種嗜酸硫桿菌中,A. ferrooxidans、 A. ferrivorans、A. ferriphilus、A. ferridurans和A. ferrianus具有氧化亞鐵獲得能量和電子的能力。
早在20世紀80年代,Ingledew等[22]提出了亞鐵氧化電子傳遞鏈的模型,提出了電子傳遞的分叉途徑。經過幾十年的研究,越來越多的亞鐵氧化電子傳遞鏈中的傳遞體蛋白功能被證實。隨著組學技術的進步和生物信息學的發展,2009年Quatrini等[18]通過基因差異表達轉錄譜和RT-qPCR實驗,結合生物信息學分析提出了A. ferrooxidans 23270的亞鐵氧化電子傳遞鏈模型,該電子傳遞鏈模型中存在順電勢和逆電勢兩條電子傳遞途徑。
在順電勢電子傳遞途徑中,亞鐵離子氧化失去的電子被鑲嵌在外膜上的細胞色素蛋白Cyc2傳遞給細胞周質中的銅藍蛋白Rus,途經細胞色素蛋白Cyc1、細胞色素氧化酶aa3,傳遞給最終電子受體O2,并與質子結合生成H2O,同時形成跨膜質子動勢,驅動ATP合成[18-19]。因此,順電勢電子傳遞途徑中電子傳遞的順序可以簡要概括為Fe2+→Cyc2→Rus→Cyc1→ aa3→O2。順電勢電子傳遞途徑中電子傳遞體蛋白由rus操縱子編碼,rus操縱子包含8個編碼基因,cyc2-cyc1-cup-coxBcoxA-coxC-coxD-rus[23-24]。研究表明,rus操縱子在以亞鐵為能源時轉錄水平顯著上調,表明了rus操縱子在亞鐵代謝中的重要作用[24-25]。rus操縱子中,Cyc2位于細胞外膜上,是電子傳遞的第一個受體蛋白,在亞鐵氧化電子傳遞模型中具有至關重要的作用。銅藍蛋白Rus位于細胞周質空間,是順電勢和逆電勢電子傳遞鏈中的分支蛋白[25]。
在逆電勢電子傳遞途徑中,以Rus為分支,電子經Cyc2、Rus 傳遞給細胞色素蛋白CycA1、細胞色素bc1復合體、泛醌、NADH-Q還原酶,最后傳遞給NAD(P)+,生成NAD(P)H,提供細胞固定CO2和參與有氧代謝所需的還原力,而A. ferrooxidans產生還原力的這一途徑是耗能的。逆電勢電子傳遞途徑中電子傳遞體蛋白由pet I操縱子編碼,pet I操縱子包含5個編碼基因,cycA1-sdrA1-petA1B1C1[18,23]。
1.3 嗜酸硫桿菌氫代謝特點
部分嗜酸硫桿菌能夠在H2的環境中生長,氧化H2獲得質子和電子,O2或者Fe3+可以作為氫氧化的電子受體[7,26]。然而,目前關于嗜酸硫桿菌利用氫的報道比較少。
氫化酶(hydrogenase)作為參與氫代謝的酶廣泛存在于細菌,古細菌和一些真核生物中。氫化酶是一組金屬酶,許多純化的氫化酶的催化活性是雙向的,能夠催化H2轉化為質子和電子以及生成H2的逆向反應,反應方向取決于細胞內的生理環 境[27-28]。20世紀90年代,研究者在A. ferrooxidans中發現并純化了氫化酶,序列分析表明A. ferrooxi- dans細菌的氫化酶與藍藻的氫化酶同屬于一個蛋白家族[29]。在結構上,A. ferrooxidans細菌的氫化酶是由64 kD的大亞基(HoxG)和34 kD的小亞基(HoxK)構成的異源二聚體,HoxG大亞基中獨特的[NiFe]簇被認為是氫化酶的催化活性中心,[NiFe]活性位點的結構在所有[NiFe]氫化酶中非常相似。HoxK小亞基含有幾個Fe-S簇,具有傳遞電子的作用[29-30]。 雖然嗜酸硫桿菌生活在酸性環境中,但是實驗發現純化的A. ferrooxidans細菌氫化酶最佳反應pH值為9[30]。當以氫氣為培養條件時,A. ferrooxidans有氧生長,以O2為電子受體,生長速率慢,無氧生長則以Fe3+作為氫氧化的電子受體[7,26]。Gao等[31]在研究嗜酸性氧化亞鐵硫桿菌群體密度感應系統時發現了一組與氫化酶和電子傳遞相關的涉及20個基因的基因簇(AFE_0700-AFE_0719)。其中,AFE_0701和AFE_0702兩個基因在基因組上的注釋分別是氫化酶的小亞基和大亞基(圖1)。研究發現,該基因簇在以亞鐵為能源培養時基因表達差異顯著,推測在A. ferrooxidans中亞鐵代謝與氫代謝之間存在某種聯系,尚需進一步的實驗證實。
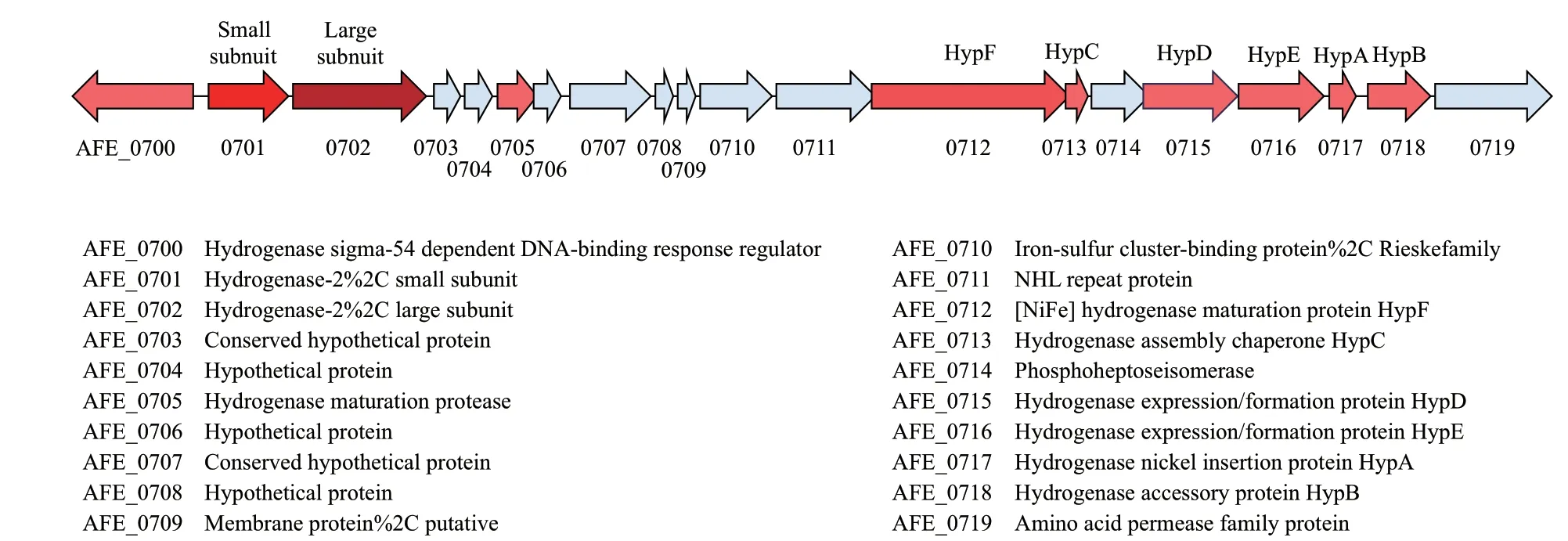
圖1 氫化酶相關基因簇(AFE_0700-AFE_0719)Fig. 1 Hydrogenase related gene cluster(AFE_0700-AFE_0719)
2 嗜酸硫桿菌對極端環境的適應機制
嗜酸硫桿菌作為極端環境微生物的重要成員,在長期共同進化和自然選擇中衍生出了對極端環境的特殊適應能力,充分了解嗜酸硫桿菌屬的生長和環境適應機制對于理解菌株的生態行為和嗜酸硫桿菌的應用價值具有重要意義。
2.1 嗜酸硫桿菌群體感應系統與生物膜
群體密度感應(quorum sensing,QS)是一種普遍存在的現象,它使細菌能夠通過產生、分泌和檢測信號分子(也稱為自誘導分子)感知群體密度和外界環境,建立細胞間的交流[32-33]。QS系統合成和分泌的信號分子種類繁多。其中N-酰基高絲氨酸內酯(acyl-HSL)是革蘭氏陰性細菌中最常見的QS系統信號分子,分子結構上由高絲氨酸內酯環和酰胺側鏈組成[32]。QS系統的研究已有50、60年的歷史,近年來,借助生物信息學、分子生物學和化學分析等現代分析實驗技術,越來越多的QS系統的信號分子、調控機制和功能被發現,然而相比于病原微生物和其他模式細菌,由于分子操作技術的限制,嗜酸硫桿菌中QS系統的研究比較局限。
2005年,Farah等[34]在A. ferrooxidans中發現了LuxI/R型QS系統(AfeI/R)。AfeI/R型QS系統包含3個編碼基因,afeI-orf3-afeR。AfeI屬于LuxI蛋白家族,以S-腺苷甲硫氨酸(SAM)和來自于脂肪酸代謝過程的acyl-ACP為底物合成acyl-HSLs類型的信號分子,在亞鐵、硫和硫代硫酸鹽能源底物培養條件下,A. ferrooxidans能夠合成9種acyl-HSLs。AfeR是LuxR家族蛋白,具有識別和結合信號分子以及調節基因表達的功能,位于AfeI和AfeR之間的Orf3的功能目前未知[34-35]。生物信息學分析表明,AfeI/R型QS系統在嗜酸硫桿菌中的分布具有普遍性和特殊性,除了A. ferrianus和A. ferriphilus,AfeI/R型QS系統存在于其他具有硫和亞鐵兩種能量代謝途徑的嗜酸硫桿菌中,而僅具有單一能源(硫)代謝途徑的嗜酸硫桿菌中,只有在A. thiooxidans中發現了AfeI/R型QS系統[31]。此外,AfeI/R系統在A. ferrooxidans中依賴于能源底物的調節機制被揭示,A. ferrooxidans根據所處的能源底物環境(硫和亞鐵能源底物),合成不同類型和濃度的acyl-HSLs,有針對性的調控硫代謝和亞鐵代謝以及其他與環境底物相適應的遺傳表型,反映了QS系統在嗜酸硫桿菌與能源環境之間的調控和適應機制[36]。
2007年,Rivas等[37]在A. ferrooxidans中發現了另一套QS系統(QS-II)。該QS系統包括4個共轉錄基因,glyQ、glyS、gph和act,分別編碼甘氨酸t-RNA合成酶的α和β亞基、磷酸酶和酰基轉移酶。在大腸桿菌中異源表達Act蛋白可以檢測到C14-HSL。半定量RT-PCR實驗表明act基因以亞鐵為能源底物培養時表達量高于以硫為能源底物培養。然而,與Act對應的信號分子受體調控蛋白尚未發現,Act是否能在A.ferrooxidans中合成acyl-HSLs或其他類型的信號分子,至今未見報道。因此,Act介導的QS系統仍存在爭議[38]。
許多嗜酸硫桿菌如A. ferrooxidans、A. ferrivorans和A. thiooxidans生長代謝受到acyl-HSLs添加的影響[38-39],而這些影響嗜酸硫桿菌生長代謝的acyl-HSLs并不一定是由菌株本身合成。人工合成的四唑類似物也能夠刺激A. ferrooxidans基因的差異表達[40]。可以推測,嗜酸硫桿菌存在種間信號的交叉識別和通訊,相關的研究工作有待深入開展。
QS系統是調節細胞外聚合物(extracellular polysaccharides,EPS)合成和生物膜(biofilm)形成的重要途徑[41]。生物膜是微生物在極端環境下“抱團”的一種群體行為。基于胞外多聚物形成的生物膜導致細胞聚集和特殊生態微環境的形成,有利于嗜酸硫桿菌在營造的微環境中生長繁殖,加速礦物氧化,抵制不良環境[42]。激光共聚焦顯微鏡和原子力顯微鏡觀察到,添加acyl-HSLs可以影響黃鐵礦表面嗜酸硫桿菌生物膜的形成[39,42]。轉錄組數據表明,酰基高絲氨酸四唑類似物添加刺激了100多個 A. ferrooxidans基因的差異表達,其中42.5%的差異表達基因與生物膜合成有關[40]。QS系統的過表達不僅可以促進EPS的合成和生物膜的形成,還可以增加細胞的硫氧化能力,增強A. ferrooxidans細胞對硫的侵蝕作用,提高細菌對金屬硫化礦的氧化和金屬離子的浸出效率[39,42]。
2.2 嗜酸硫桿菌對重金屬離子的抗性及其分子 機制
生物冶金是嗜酸硫桿菌在工業上的一項重要應用,嗜酸硫桿菌通過直接或間接作用將礦石中的各種金屬溶解到浸出液中,浸出體系中金屬離子的濃度越來越高,成為制約微生物生長代謝和浸礦效率的重要環境壓力,因此研究嗜酸硫桿菌對重金屬離子的抗性及其分子機制是生物冶金應用領域的迫切需求[16]。
當重金屬離子濃度過高而對微生物產生毒害作用時,微生物可以通過轉運、螯合等多種方式降低重金屬的毒害作用[43-44]。嗜酸硫桿菌在與重金屬環境的適應進化中衍生出了高效的抗毒和解毒機制。其一是胞外吸附,嗜酸硫桿菌合成和分泌EPS,形成生物膜,吸附和抵制胞外重金屬離子。EPS主要由蛋白質、多糖和脂類組成,通過與重金屬離子建立共價連接或靜電相互作用從而達到很好的吸附效果[43]。其二是離子外排,嗜酸硫桿菌可以利用金屬離子外排系統將金屬離子泵出到胞外,如金屬離子外排P型ATPase家族蛋白,水解ATP提供能量,將金屬離子逆濃度梯度主動排出到胞外,達到解毒的效果[44]。其三是胞內螯合,細胞內的一些氨基酸、金屬結合蛋白、磷酸鹽等組分通過螯合胞內的金屬離子降低胞內金屬離子的濃度。研究發現A. ferrooxidans能夠積累多聚磷酸鹽(polyphosphate,polyP)顆粒,polyP顆粒在多種細菌中都被證實具有供能和“隔離”重金屬離子的雙重功能[45]。在重金屬離子濃度過高時,polyP水解生成的無機磷酸與重金屬離子結合形成復合物,通過磷酸鹽轉運系統將重金屬離子排出到細胞外[45]。此外嗜酸硫桿菌還可以通過生物轉化將毒害作用大的重金屬離子轉化為毒性小或無毒的成分、建立金屬離子滲透屏障、降低細胞重金屬離子靶標蛋白的敏感性等多種方式實現對重金屬的抗毒和解毒作用[46]。
2.3 嗜酸硫桿菌的酸耐機制
嗜酸硫桿菌能夠在酸性環境下生長繁殖(pH 0.5-6.0),9種嗜酸硫桿菌生長的pH范圍在表1中列出。嗜酸硫桿菌能夠在外部酸性條件下維持相對中性的細胞內環境,避免酸性環境對胞內蛋白質、DNA等生物大分子的損傷。嗜酸硫桿菌在與酸環境漫長的適應過程中演化出多種多樣的耐酸響應機制和調控策略包括,細胞膜組分和蛋白通道的調節、質子外排和消耗、反向跨膜電位的產生、DNA和蛋白質修復等[47-48]。
細胞膜是嗜酸硫桿菌應對酸環境的屏障,嗜酸硫桿菌能夠合成高度不透性的細胞膜以應對胞外高濃度的質子。這些膜由大量的支鏈脂肪酸、飽和和單不飽和脂肪酸、β-羥基、ω-環己基和環丙烷脂肪酸組成[49]。位于細胞膜上的蛋白通道在酸環境下其通道大小和離子選擇性受到調節,以應對外界質子脅迫。其次,嗜酸硫桿菌進化出高效的質子外排能力,質子外排是涉及細胞能量的復雜系統。目前在嗜酸硫桿菌如A. ferrooxidans、A. thiooxidans和A. caldus等細菌基因組中鑒定出了幾種質子外排蛋白[50]。在酸脅迫下,嗜酸硫桿菌中的H+-ATPase活性和NAD+/NADH比率上調[20,48]。呼吸鏈復合體蛋白的表達增加,這些復合物可以將質子泵出細胞[20]。當胞質中質子濃度過高時,細菌可以利用氨基酸脫羧酶催化脫羧反應消耗胞內質子,在一定程度上維持細胞內pH值穩態。此外,嗜酸硫桿菌能夠利用陽離子轉運蛋白(如Na+/K+轉運蛋白)產生反向跨膜電位(Δψ)以抑制質子向胞內流動[20,48]。研究數據表明,A. thiooxidans的基因組中含有大量的陽離子轉運蛋白基因,這些轉運蛋白可能參與反向跨膜電位的形成以抑制質子流入[20,50]。當細胞暴露于高濃度的質子環境或質子流入細胞時,大量的DNA修復蛋白和分子伴侶會修復受損的DNA和蛋白。
酸環境是嗜酸硫桿菌在生物冶金工業應用中的重要條件,是礦石中金屬溶解浸出的關鍵因素。在過去幾十年中,嗜酸硫桿菌的分子和生化分析與基因組、轉錄組、蛋白質組等多組學數據相結合,為嗜酸硫桿菌的耐酸機制提供了見解。然而,目前一些pH穩態機制和耐酸模型仍缺乏嚴格的實驗證據,需要深入的研究和挖掘。
3 嗜酸硫桿菌在工農業中的應用
我國“十四五”規劃明確指出的“綠色發展”理念,“綠水青山就是金山銀山”的科學論斷也體現出人與環境和諧共存的內在需求。微生物是聯系人類與環境的重要紐帶,嗜酸硫桿菌在重金屬礦產資源開采、有色金屬回收、重金屬污染物治理、生物脫硫、土壤環境改善等領域具有重要作用(圖2),是實現資源高效轉化和環境污染治理不可或缺的微生物資源。

圖2 嗜酸硫桿菌在工農業中的應用Fig. 2 Application of Acdithiobacillus spp. in industry and agriculture
3.1 嗜酸硫桿菌在工業中的應用
生物冶金是嗜酸硫桿菌在工業中的重要應用,該技術是利用微生物的直接或間接作用將礦石中的各種金屬溶出,并加以回收利用[16,51]。嗜酸硫桿菌是生物冶金中的優勢菌株,通過其獨特的硫和亞鐵代謝能力,利用礦石中的亞鐵和硫化物生長,產生Fe3+和硫酸,Fe3+是參與生物冶金的關鍵因素,可以作為氧化劑攻擊金屬,自身被還原為Fe2+,產生的酸性環境有利于礦石的溶解和金屬離子的浸 出[15,51]。嗜酸硫桿菌能夠從低品位礦石中浸出銅、鋅、鎳、鈷等金屬[16,51]。據報道,在伊朗51.0%的鋅被A. ferrooxidans細菌從復雜的低品位鋅鉛礦石中浸出[52],此外,A. ferrooxidans也被用于從低品位的硫化礦中提取鈷,浸出效率達62%[53]。由A. ferrooxidans、A. thiooxidans以及其他幾種浸礦微生物組成的菌種能夠從低品位礦中回收70%的銅[54]。此外嗜酸硫桿菌可以利用生物氧化作用將金礦石中的硫化物等組分氧化分解從而使金裸露而易于提取。越來越多的研究證實與傳統的冶煉技術相比,嗜酸硫桿菌參與的生物冶金過程在處理低品位礦、尾礦中具有明顯的優勢。
近年來,嗜酸硫桿菌的應用已從重金屬礦產資源開采拓展到含金屬廢棄物的資源回收[55]。隨著科技的進步,電氣和電子設備(electrical and electronic equipment,EEE)已成為生活中必不可少的一部分。電子產品更新換代導致廢舊手機、電腦、電視、電池等電子廢棄物的大幅增加,2020年全球電子垃圾監測報告指出上一年度全球產生了53.6 Mt電子垃圾[56]。這些電路板、電池等廢棄物中含有金、銀、鋰、鈷、銅、鉛等多種稀有金屬和貴重金屬[15],是放錯了地方的資源。嗜酸硫桿菌能夠有效回收利用這些電子廢棄物中的各種金屬,避免電子垃圾帶來的環境污染,提高資源利用效率。在最佳條件下A. thiooxidans在72 h浸出時間內能從廢舊手機印刷電路板中回收98%的銅和82%的鎳[57]。通過逐步間接生物浸出法,在A. ferrooxidans的作用下,廢舊發光二極管中鎵、銅和鎳浸出率分別提高到83%、97%和84%[58]。
隨著社會的進步,皮革廠、電鍍廠、畜禽糞便等污水、污泥廢棄物排放量與電子垃圾同樣急劇增加,第二次全國污染源普查公報顯示,2017年我國工業固體危險廢棄物產生量達6 581.45萬t[59],這些廢棄物中通常含有鉻、鉛等重金屬,直接排放到環境中會造成重金屬在食物鏈中積累,破壞生態環境,危害人類健康。嗜酸硫桿菌由于自身的生理代謝特點和較高的重金屬離子耐受能力而被廣泛應用于含重金屬的廢棄物治理中。利用A. ferrooxidans處理焚燒后的垃圾殘渣,在同時含有亞鐵和元素硫的介質中培養時,錳、鈷、銅和鋅的浸出效率高達100%[60]。來自天津當地市政污泥處理廠的污泥,在經過10 d的亞鐵氧化細菌生物浸出反應后其鋅、銅、鎘、鉻、錳、鎳和鉛得到一定程度的浸出和去除[36]。A. ferrooxidans和A. thiooxidans被報道能夠從煉油廠廢棄物回收鋁、鈷、鉬和鎳[61]。
生物脫硫(biodesulfurization)是嗜酸硫桿菌在污染物治理中的另一項重要應用,生物脫硫是利用微生物自身的生理代謝實現硫化物脫除的技術,廣泛應用在石油脫硫、煤炭脫硫、沼氣脫硫等領域,以減少SO2的排放和對環境的影響[62-64]。據報道A. ferrooxidans和A.thiooxidans細菌能夠有效去除煤炭中黃鐵礦硫和總硫的含量[63,65]。Cheng等[62]將A. ferrooxidans細菌固定化,對高濃度的H2S氣體[(15 000±100)ppmv]的脫除率達到80%。
3.2 嗜酸硫桿菌在農業中的應用
嗜酸硫桿菌在農業上的應用與其在工業中的應用相比研究的較少,但是嗜酸硫桿菌與農業應用的聯系由來已久。嗜酸硫桿菌中的A. thiooxidans細菌是20世紀20年代從堆肥中分離得到的[66]。20世紀60、70年代,針對我國北方土壤缺磷的現狀,通過對A. thiooxidans的深入研究,利用A. thiooxidans和硫磺、磷礦粉、硫酸銨、麥糠或碎秸稈制成的堆肥可以提高磷礦粉的速效性,促進小麥和玉米的生長,提高農作物的產量。基于嗜酸硫桿菌能夠產酸的特點,降低土壤pH值,改善鹽堿地的土壤環境[10]。隨著土壤pH值降低,土壤酸化,有利于土壤中一些不溶性礦質鹽的溶解,土壤中的硫酸鹽和可溶性的鉀、鈣、磷等元素含量增加,從而改善了作物的礦質營養[9]。此外,嗜酸硫桿菌能夠有效浸出重金屬污染土壤的鉻、鎘、鉛、銅等重金屬實現土壤修復的目的[67]。
4 總結與展望
嗜酸硫桿菌是資源環境微生物研究與微生物工業應用有機結合的典范,其獨特的能量代謝和極端環境適應機制不僅是微生物學研究中的重要科學問題,也是它們具有重要工農業應用價值的核心。基于前期的研究成果,為更好的解決我國資源與環境問題,服務國家需求,嗜酸硫桿菌的研究在以下四個方面需要重點布局。
第一、能量代謝機制研究。嗜酸硫桿菌具有硫、亞鐵、氫多種能量代謝途徑,能量代謝是細菌改造和應用研究的基石。目前嗜酸硫桿菌的代謝途徑大多是基于序列信息和生物信息學分析的模型,缺乏實驗證據。通過完善微生物細胞的分子代謝網絡、關鍵酶及代謝途徑中代謝物的調控作用,加深理論研究解答嗜酸硫桿菌生存之謎。
第二、極端環境抗逆和適應機制研究。嗜酸硫桿菌能夠在酸、重金屬離子、鹽等各種極端環境下生長,研究酸、重金屬離子等極端環境因素對微生物分子、遺傳和群落演化的作用特征,揭示嗜酸硫桿菌適應極端環境的分子機制有利于針對特殊環境設計極端環境抗逆菌株,提高菌株應用價值。
第三、嗜酸硫桿菌種群信號交流和調控機制研究。嗜酸硫桿菌應用價值的發揮是微生物整體作用的結果。研究嗜酸硫桿菌種間和種內的信號交流傳遞和外界環境感應機制,分析不同信號分子的調控功能及其引起的基因表達和細胞行為,開展微生物種群之間調控作用研究,有利于從群體角度指導嗜酸硫桿菌的應用,為種群調控策略提供理論基礎。
第四、嗜酸硫桿菌研究技術的開發。相比于大腸桿菌等模式微生物,嗜酸硫桿菌分子操作困難、效率低,制約了嗜酸硫桿菌的理論研究和分子遺傳改造,深入探索嗜酸硫桿菌分子遺傳操作手段以及蛋白酶學、細胞表型檢測技術等,為高效菌株設計改造和開發極端環境微生物底盤細胞奠定基礎。