細胞外基質修飾的電紡纖維對施萬細胞及神經生長的影響
管延軍,許文靜,張 健,李超超,孟繁琪,3,楊博堯,張鐵元,任致奇,4,劉修志,儀鵬朝,王 玉,彭 江
1 解放軍醫學院,北京 100853;2 解放軍總醫院第四醫學中心 骨科醫學部研究所,北京 100853;3 北京大學人民醫院 脊柱外科,北京 100044;4 解放軍總醫院第一醫學中心 神經外科,北京 100853;5 66168 部隊醫院 門診部,北京 101301
細胞外基質(extracellular matrix,ECM)為其周圍定居的細胞提供機械支持和表型調控的生物化學信號[1]。在組織工程與再生醫學發展過程中,再生微環境一直是研究人員關注的焦點,生物支架材料的設計趨向于再現天然基質特征,力求還原組織器官的最初(損傷前)微環境,即目標相關的機械線索以及生物引導信號,以此達到再生的目的[2]。周圍神經損傷后的核心再生環節包括施萬細胞的遷移以及軸突生長引導[3-4]。因此神經再生材料的設計思路就針對于模擬再生微環境。施萬細胞(Schwann cells,SCs)是周圍神經組織中的膠質細胞,參與有髓神經纖維的髓鞘包裹以及神經纖維的營養支持;在損傷的神經組織中,施萬細胞是最早一批響應軸突損傷的細胞。在損傷發生后,施萬細胞重編程并形成邦格氏帶,伴隨其分泌的可溶性蛋白(促神經生長因子)以及不可溶性蛋白(細胞外基質)作為引導軸突生長的橋梁[5]。本研究組裝了一種改性靜電紡絲材料,即在傳統的取向聚己內酯(polycaprolactone,PCL)-絲素蛋白(silk fibroin,SF)納米纖維上沉積大鼠SCs 的ECM。取向納米纖維在結構上再現神經的基底膜結構,而SCs-ECM 則提供軸突生長的信息結合位點。通過體外大鼠背根神經節(dorsal root ganglion,DRG)培養評估這種策略對神經軸突生長的影響。
材料與方法
1 實驗動物 大鼠原代施萬細胞、背根神經節組織分別取自72 時齡、12 時齡的SD 乳鼠(雌雄不限),各5 只,均購自北京科宇動物養殖中心。本實驗經解放軍總醫院實驗動物倫理委員會審批通過(批準號:2016-x9-07)。
2 主要實驗設備及材料 體視顯微鏡(Nikon DSRi2);靜電紡絲設備(北京永康樂業 ET-2531);真空凍干機(河南兄弟儀器 LGJ-18);熒光顯微鏡(Nikon Ni-U);相差顯微鏡(Olympus 1X53);激光共聚焦顯微鏡(Zeiss LSM780);核酸提取分析儀(QIAGEN QIAcube HT);熒光分光光度儀(infinite 200Pro);核酸定量檢測試劑盒(invitrogen P7589);DMEM/F-12(Gibco 11965084);磷酸鹽緩沖液(CORNING 21-031-CV);胎牛血清 (Gibco 10099-141);EGF-D(R&D 396-HB);毛喉素(Sigma F6886);B-27 添加因子(gibco 17504-044);青-鏈霉素雙抗(Gibco 15070063);Ⅰ型膠原酶(Invitrogen 17018-029);胰酶(Gibco 15050065);阿糖胞苷(Sigma C6645);Glutamax(Gibco 35050061);L-抗壞血酸(Wako 014-04801);聚-D-賴氨酸(sigma P6407);明膠(Sigma G7041);聚己內酯(Sigma 440744);蠶絲蛋白(美倫生物 MB4792);六氟異丙醇(阿拉丁 H1-7501);Triton-X100(Sigma T8787);DNA 酶Ⅰ(Sigma D5025);氨水(北京化工廠);封閉用山羊血清(索萊寶 SL038);兔來源Fibronectin 一抗(Abcam ab2413);兔來源 S100β 一 抗 (Abcam ab52642);小鼠來源NF-200 一抗(Sigma N0142);山羊抗兔-Alexa Fluor ? 594(Abcam ab150080);山羊抗小鼠-Alexa Fluor ?488(Abcam ab150117);DAPI 染色液(四正柏生物 FXP 139-100)。
3 大鼠原代施萬細胞的提取、純化與增殖培養施萬細胞基礎培養基:DMEM/F-12、10%胎牛血清、2 mm/L GlutaMAX-I、1×雙抗。施萬細胞純化培養基:施萬細胞基礎培養基添加10 μm/L 阿糖胞苷。施萬細胞完全培養基:施萬細胞基礎培養基添加2 μm Forskolin、10 ng/mL EGF-D。在無菌環境中,體視顯微鏡下獲取5 只乳鼠的全部坐骨神經(1 cm),以DF-12 沖洗血跡并離心,加入10 mL胰酶/Ⅰ型膠原酶/DF-12 混合液后,在37℃下消化30 min;離心,棄上清,加入4 mL 施萬細胞基礎培養基,槍頭吹打10~20 次,至無明顯組織塊,轉移至 35 mm2培養瓶中,于37℃,5% CO2環境下培養。24 h 后更換施萬細胞純化培養基以抑制并殺死成纖維細胞,繼續培養72 h。之后更換施萬細胞完全培養基以增殖施萬細胞。細胞每融合至90%左右進行傳代,P2~P3 代的施萬細胞用于細胞外基質的獲取。
4 靜電紡絲材料制備 配制聚己內酯-絲素蛋白(PCL-SF)紡絲溶液:將0.8 g 聚己內酯、絲素蛋白分別溶解于10 mL 六氟異丙醇中,室溫下攪拌過夜形成均一穩定的溶液。將制得的8%聚已內酯/絲素蛋白紡絲溶液1∶1 混勻,吸入注射器裝入電紡絲供給裝置,通過流量泵調控電紡絲的流量供給速度為0.166 mm/min。通過高壓發生器給電紡絲過程提供電壓,施加的正電壓為15.00 kV,負電壓為-5.00 kV。將轉速為2 800 r/min 的滾筒與接地端相連,覆蓋錫箔紙,作為紡絲收集基板。
5 施萬細胞ECM 修飾的電紡絲材料制備 將電紡膜裁剪并固定于2.2 cm×2.2cm 玻片,輻照滅菌后置于六孔板,以0.2%明膠包被4 h,PBS 沖洗3 次;胰酶消化增殖的SCs,以8 000/cm2的密度種植于電紡材料表面。待細胞達到100%融合后,更換添加50 μm/L L-抗壞血酸完全培養基以刺激細胞外基質分泌,刺激時間為12 d,每3 d 更換1 次培養基。為了獲得無細胞材料,將培養基棄去并用PBS 沖洗,在脫細胞緩沖液中(0.5% Triton X-100 和20 mm/L 氨水溶解在PBS 中),37℃下孵育5 min,然后用100 U/mL DNA 酶Ⅰ在37℃下處理2 h。去細胞材料用PBS 洗3 次以去除殘留的DNA 酶,在4℃下保存。
6 去細胞材料DNA 殘留檢測 為檢測脫細胞效率,脫細胞和未經脫細處理的復合材料經真空凍干機凍干24 h 后,稱重并經過核酸提取分析儀程序提取總DNA,按照核酸定量檢測試劑盒操作說明進行定量,于熒光分光光度儀以激發光波長480 nm、發射波長520 nm 讀取熒光強度數值;繪制標準曲線并計算DNA 含量。該實驗重復3 次。
7 復合材料的掃描電子顯微鏡檢測 為驗證此策略是否成功將SCs-ECM 與PCL-SF 納米纖維復合,通過掃描電鏡直接觀察復合情況。脫細胞處理后的樣本經4%戊二醛溶液固定后,沖洗并與無ECM 復合的電紡膜一同干燥、噴金、上機觀察拍照。
8 復合材料的免疫熒光染色 SCs-ECM分泌后,經脫細胞處理后的與未處理的復合材料經4%多聚甲醛溶液固定10 minPBS 沖洗,之后以封閉用山羊血清工作液孵育30min,兔來源Fibronectin 一抗4℃孵育過夜,第2 天以PBS 沖洗3 次后,取山羊抗兔-Alexa Fluor ?594 二抗避光孵育2 h,沖洗3 次,水性封片劑封片,至熒光顯微鏡觀察。
9 大鼠DRG 的種植 脫細胞處理后的復合材料與單純PCL-SF 電紡材料在種植前使用多聚賴氨酸工作液37℃下包被3 h,PBS 沖洗3 次備用。取生后12 h 乳鼠1 只脫頸處死,浸泡于75%乙醇中消毒15 min。將乳鼠俯臥位固定于蠟臺,體視顯微鏡下剪開背部正中皮膚、皮下及肌層,暴露脊柱下頸段至腰段,完整剝離并取出脊柱,置于DMEM/F-12 中洗去血跡。用顯微鑷從正中將脊柱剪開,去除脊髓,暴露兩側椎間孔,于兩側椎間孔處取出各節段DRG,剝除DRG 外膜,接種于復合電紡材料和單純電紡材料表面上,加2.5 mL DRG 培養液(DRG 培養液配方:DMEM/F-12、2 mm GlutalMAX-I、1×雙抗、1×B-27 因子),置于37℃、5% CO2環境下培養7 d。
10 DRG 免疫熒光染色及軸突長度測量 去除復合電紡材料和單純電紡材料表面培養的DRG 培養液,PBS 清洗后以4%多聚甲醛固定15 min。再以PBS 清洗,山羊血清封閉30 min,取兔來源S100β、小鼠來源NF-200 一抗稀釋,4℃孵育過夜。第2 天以PBS 沖洗3 次后,取山羊抗兔-Alexa Fluor?594、山羊抗小鼠-Alexa Fluor?488 二抗避光孵育2 h,沖洗3 次,水性封片劑封片,至共聚焦顯微鏡觀察拍攝全景圖片。并用Image Pro Plus 軟件分析計算各組DRG 軸突長度,取每個DRG 最長的軸突計算平均長度,每組隨機選取6 個DRG 進行分析。
11 統計學方法 采用GraphPad Prism 7.0 進行統計學分析以及繪圖,計量資料以±s表示,兩兩比較采用Student'st檢驗,P<0.05 為差異有統計學意義。
結果
1 大鼠施萬細胞純化培養的情況 經阿糖胞苷純化后的施萬細胞經傳代后鏡下觀察呈細長紡錘形且細胞核折光性強,而少見寬大的核無折光性成纖維細胞(圖1A),針對SCs 表面特異性標記蛋白S100β 的免疫熒光染色(圖1B),可見融合的SCs之間未見成纖維細胞摻雜,提取的細胞可用于后續實驗。
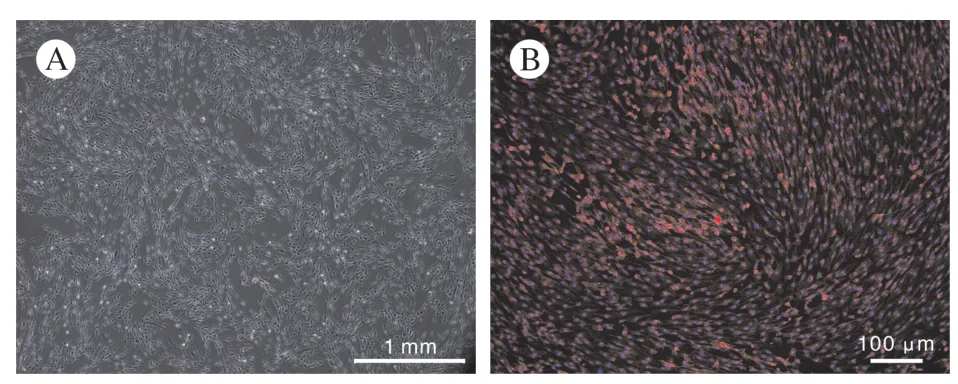
圖1 培養成功的施萬細胞(A)相差顯微鏡(40 ×)和S100β 免疫熒光染色(B)Fig.1 Phase contrast micrograph of purified P2 Schwann cells (A)and immunofluorescence staining of S100β of Schwann cells (B)
2 ECM 復合材料的表征 經ECM 修飾后的電紡材料在掃描電鏡下可見原始的納米纖維周圍包繞ECM 蛋白,這與未經修飾的紡絲材料初始形貌有很大差異(圖2)。經免疫熒光染色驗證了這些基質中Fibronectin 的存在:電紡材料在種植SCs 并完成刺激程序后,可見一致取向性排列,并且被ECM 包繞(圖3CD)。對復合材料進行去細胞處理后,細胞內容被脫去,且未見完整深染的核結構,但保留一定的細胞外基質成分(圖3AB)。在脫細胞處理的效率方面,與未做去細胞處理[對照組=(3 022±51.13) ng/mg]相比,去細胞處理后復合材料的DNA 殘余含量[(2.398±0.232 9) ng/mg]顯著降低(圖3E)。
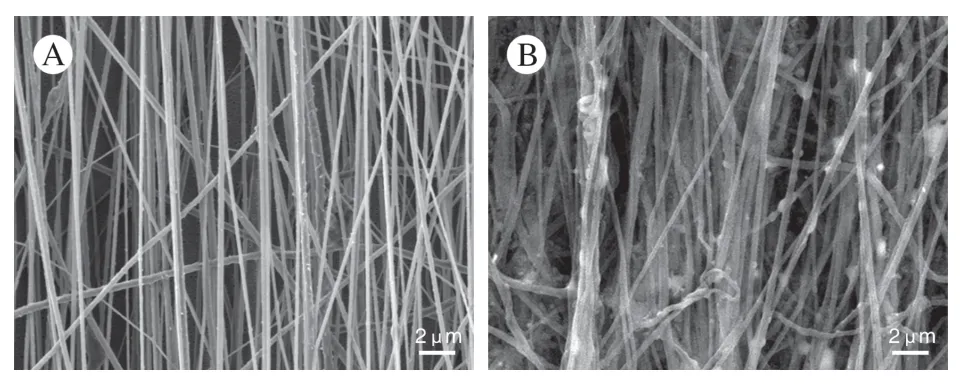
圖2 電紡材料掃描電子顯微鏡照片 A:原始聚己內酯-絲素蛋白取向電紡纖維;B:施萬細胞細胞外基質修飾的納米纖維Fig.2 Scanning electron micrographs A:Initial polycaprolactonesilk protein aligned electrospun fibers;B:Extracellular matrixmodified nanofibers of Schwann cells

圖3 去細胞前(A、B)、后(C、D)組復合電紡纖維免疫熒光染色及DNA 含量測定(E)(標尺=100 μm)Fig.3 Immunofluorescence staining of composite electrospun fibers in decellularized group (A,B) and before decellularization(control) group (C,D),and determination of DNA content (E)
3 復合材料對背根神經節軸突延伸以及施萬細胞遷移的影響 與單純的PCL-SF 電紡材料相比,SCs-ECM 修飾的PCL-SF 材料可顯著支持軸突的取向性再生和快速延伸(圖5B);SCs-ECM 修飾的PCL-SF 材料上DRG 組織中施萬細胞的遷移距離顯著大于軸突的生長距離[(2 073±112.9) μmvs(1 503±147.4) μm,P=0.005 6](圖4B)。

圖4 施萬細胞外基質修飾的電紡纖維上生長的背根神經節免疫熒光染色(A)和復合材料上施萬細胞遷移距離與軸突生長長度比較(B)[施萬細胞:S100β(紅色);軸突:NF200(綠色);細胞核:DAPI(藍色)]Fig.4 Immunofluorescence staining of dorsal root ganglia grown on electrospun fibers modified by the extracellular matrix of Schwann cells (A) and comparison of Schwann cells migration distances and axon growth lengths on composites (B)(Schwann cells:S100β [red];axon:NF200 [green];nucleus:DAPI [blue])
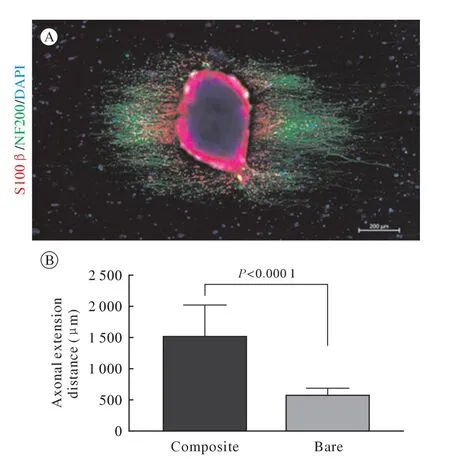
圖5 單純電紡纖維上生長的背根神經節免疫熒光染色(A)和兩種材料上軸突纖維生長長度比較(B)[施萬細胞:S100β(紅色);軸突:NF200(綠色);細胞核:DAPI(藍色)]Fig.5 Immunofluorescence staining of dorsal root ganglia grown on simple electrospun fibers (A) and comparison of axonal fiber growth lengths on the two materials (B)(Schwann cells:S100β[red];axon:NF200 [green];nucleus:DAPI [blue])
討論
再生支架材料包括天然聚合物,如殼聚糖、絲素蛋白、海藻酸鹽等;人工聚合物如硅膠、聚乙烯醇、聚己內酯等。這些聚合物已經被應用于3D 打印、靜電紡絲、凝膠等工藝以模擬神經組織的天然3D 場景[2]。本研究所選用的經典的聚己內酯具有良好的親和性和可定制性,目前在藥物遞送和組織工程等應用中進行了試驗[6]。然而,在實踐中發現PCL 電紡材料沒有很強的親水性能,不利于細胞的黏附和增殖,我們因此引入絲素蛋白與聚己內酯共紡,絲素蛋白提取自蠶絲,因其生物相容性、生物降解性而成為生物醫學應用的熱門材料[7]。我們通過兩者的結合進行靜電紡絲制造,聚己內酯為電紡材料提供物理強度支撐和取向性微納結構,以模擬天然神經基質結構;而絲素蛋白則能增強材料的親水性能。然而這些產物在置入后仍有可能會因異物反應導致低水平的宿主整合,且它們缺少原生ECM 所具備的生化信息[8]。
與合成材料相比,天然的組織器官或體外培養細胞沉積的ECM 分子顯示出增強的宿主反應和整合。然而,在大多數情況下,它們的快速重吸收阻止它們提供長期的結構支撐[9]。為了尋求優化,研究人員將單一的ECM 蛋白[10-12]、短肽段[13-14]、天然ECM(組織器官/細胞來源)[15-16]與聚合材料以物理或化學手段復合,可使兩者取長補短,既能維持ECM 的分子耐穩定性,又能賦予材料以可附著位點和再生相關的基質效應。除此之外,異種/同種異體去細胞神經基質能夠保留細胞活動的原始位點[17-19]。然而,脫細胞進程機械、化學處理十分容易對復雜基質結構產生破壞。另外,異體組織ECM 來源有限,而且具有生物不相容性和潛在的病原體傳播等難題[20]。
不同于組織來源細胞外基質,體外培養的細胞沉積的ECM 具備靈活的組織工程設計方案[21]。通過表面覆蓋或混合的方法與器官脫細胞基質、金屬、高分子生物材料等組合能得到具有生物活性的再生支架,修飾的支架材料被賦予了多種優秀的生物學屬性:細胞外基質分子為再生提供生化環境以及特殊的生物行為啟動位點等。已有報道稱細胞來源的細胞外基質蛋白修飾的3D 打印支架、靜電紡絲等材料可更好地輔助體內骨、肝、心肌等的再生[15,22-23]。在周圍神經再生的領域內,Wang 等[24]利用骨髓間充質干細胞分泌的細胞外基質修飾殼聚糖導管,修飾大鼠坐骨神經缺損效果與自體神經移植相似;借鑒于此,我們選擇細胞來源細胞外基質修飾傳統的靜電紡絲材料,探究其支持軸突再生的可行性及優勢。
施萬細胞是周圍神經的膠質細胞,其在生理以及損傷修復狀態下均發揮重要作用,其細胞外基質蛋白分子也隨不同場景開放不同的功能位點[25]。因此我們選擇施萬細胞作為細胞外基質的來源。首先,高純度施萬細胞的獲取十分重要,在其原代培養過程中,很容易發生成纖維細胞的污染,并且隨著細胞的增殖以及傳代,施萬細胞易發生表性改變以及衰老。通過在培養基中添加抗有絲分裂藥物-阿糖胞苷,能夠成功抑制成纖維細胞的有絲分裂而不影響施萬細胞的活性,完全培養基中的EGF-D 因子可支持施萬細胞的快速增殖。在細胞傳代后可獲得高純度的施萬細胞。掃描電鏡和Fibronctin 蛋白的免疫熒光染色證明我們成功將細胞外基質蛋白與取向性的電紡支架結合,而且經典的脫細胞方法未對ECM 蛋白造成很大的破壞。這樣,我們成功地在機械和生物效能兩個維度模擬神經再生的微環境,力求為神經再生提供最佳輔助。
在體外背根神經節培養模型中,復合材料能夠更好地支持軸突的取向性再生和快速延伸,這與未經ECM 修飾的電紡材料形成鮮明對比(圖4A、圖5A)。軸突的取向再生能夠提高再生效率,這在周圍神經損傷的恢復中意義重大。同時,我們還發現在復合材料組中,施萬細胞的遷移速度大于軸突生長。這是因為施萬細胞自身的基質蛋白為自身提供活動位點。施萬細胞遷移速度的提高也有利于神經再生進程[26]。
綜上所述,本研究成功構建了以施萬細胞細胞外基質修飾的聚己內酯-絲素靜電紡絲材料,并發現該材料可以顯著提高軸突生長速度和施萬細胞遷移速度。總之,本研究提供了一種針對經典再生材料的仿生化修飾策略,為周圍神經再生材料的設計提供了新見解。
致謝:感謝解放軍總醫院骨科研究所所有工作人員的技術指導和幫助。
利益沖突聲明:作者聲明本文無任何利益沖突。

