電子供體對向日葵秸稈厭氧發酵產酸和微生物群落結構的影響
封麗梅 林淼 姜茂成 程秀花 吉慧敏



摘要:為探究電子供體對瘤胃微生物發酵向日葵秸稈產C2~C6脂肪酸的影響,采用體外連續傳代和高通量測序技術,比較添加乙醇或乳酸對脂肪酸產量及細菌和真菌群落結構的影響。結果表明,添加乙醇和乳酸顯著提高了總C2~C6脂肪酸的產量,乙醇提高了乙酸、戊酸和己酸產量,乳酸提高了丙酸、丁酸、戊酸和己酸產量。與對照組相比,乙醇組的擬桿菌門相對豐度下降,而變形菌門相對豐度上升;乳酸組的變形菌門相對豐度下降,而放線菌門相對豐度上升。添加乙醇或乳酸對相對豐度前5的真菌菌門無顯著影響。添加2種電子供體都顯著改變了細菌和真菌的群落結構。添加乙醇顯著提高薩特氏菌屬、解琥珀酸菌屬和脫硫弧菌屬的相對豐度,添加乳酸顯著提高巨型球菌屬、Shuttleworthia、互營球菌屬、光岡菌屬、未定義的普雷沃氏菌的相對豐度。在種水平上,普雷沃氏菌、亨氏丁酸弧菌、埃氏巨型球菌與丁酸、戊酸產量呈顯著相關。
關鍵詞:乙醇;乳酸;瘤胃微生物;向日葵秸稈;C2~C6脂肪酸
中圖分類號:X712 ??文獻標志碼: A
文章編號:1002-1302(2022)09-0247-06
我國是農業大國,主要農作物秸稈產生量為9.84億t,可收集量達8.24億t,占全球秸稈總產量的20%左右[1]。2019年全球向日葵總種植面積約為2 590萬hm2,大部分地區在向日葵收獲后采用焚燒的方式處理,不僅污染環境,也浪費能源[2-5]。農作物秸稈含有很高的纖維性碳水化合物,對其進行有效的降解利用和轉化已成為研究的熱點,而生物質的資源化和能源化利用對能源發展和環境保護具有重要的價值和意義。目前生物法降解廢棄物,主要有酶處理法和微生物處理法,用于生產甲烷、乙醇和揮發性脂肪酸[6-8]。因具有反應條件溫和、污染小的特點,具有巨大的應用潛力[9-10]。
向日葵秸稈作為豐富的木質纖維素資源,可以發酵生產燃料乙醇,也可直接飼喂反芻動物[11-12]。瘤胃微生物棲息在反芻動物瘤胃中,是分解利用纖維類物質效率最高的天然微生態體系[13]。瘤胃微生物可實現厭氧發酵秸稈,獲得甲烷和揮發性脂肪酸,這在新型高值化利用方面也具有深度挖掘的價值[14]。厭氧發酵產生的揮發性脂肪酸主要通過水解和產酸步驟形成,其中,戊酸和己酸是乙酸、丙酸和丁酸進一步合成的產物,并且可提供更多能量[15-16]。利用乙醇或乳酸作為電子供體,在特定微生物的作用下進行脂肪酸β氧化的逆循環實現短鏈脂肪酸碳鏈延長,提高戊酸和己酸的產量[17-18]。相關研究表明,乙醇有助于奶牛瘤胃細菌發酵纖維類底物產生更多的乙酸和己酸,該類電子供體具備幫助細菌利用有機廢棄物生產己酸的潛力[19-20]。目前,對向日葵秸稈厭氧發酵生產C2~C6脂肪酸的能力和主要的微生物群落少有報道。
本試驗研究瘤胃液與向日葵秸稈共培養利用乙醇或乳酸的C2~C6脂肪酸產量的變化,闡明微生物群落結構特征,揭示瘤胃發酵向日葵秸稈的產酸特點,同時為向日葵秸稈的有效利用提供參考依據。
1 材料與方法
1.1 試驗材料
向日葵秸稈于2020年11月取自揚州大學試驗牧場。風干處理后的向日葵秸稈(65 ℃,干燥 48 h),再粉碎過40目標準篩,放入樣本瓶中保存備用。發酵液取自干奶期荷斯坦奶牛的瘤胃,瘤胃液經采集和過濾后,立刻于39 ℃水浴帶回實驗室。
1.2 厭氧發酵
礦物鹽培養緩沖液:1.10 mg/L CaCl 2·2H 2O,0.83 mg/L MnCl 2·4H 2O,0.08 mg/L CoCl 2·6H 2O,0.67 mg/L FeCl 3·6H 2O,5.83 mg/L NaHCO 3,0.95 mg/L Na 2HPO 4,1.03 mg/L KH 2PO 4,0.10 mg/L MgSO 4·7H 2O。在礦物鹽緩沖液中加入體積分數0.1%的刃天青,攪拌并持續通入CO 2(純度:99.9%以上)約3 h (pH值6.8±0.1)后密封備用。
稱取0.16 g向日葵秸稈于150 mL干燥厭氧培養瓶中,加入礦物鹽培養緩沖液15 mL,硫化鈉溶液(濃度2.5%)0.15 mL和瘤胃液2 mL,膠塞密封。將培養瓶放于39 ℃培養箱靜置發酵72 h。每3 d將2 mL混合發酵液取出,接種到含相同底物和新鮮礦物鹽緩沖液的新培養瓶中,其他操作同上,共培養8代。以不加乙醇和乳酸為對照組,試驗組加乙醇或乳酸(0.2 mL),每組4個平行。
1.3 pH值和C2~C6脂肪酸測定
收集第8代的發酵混合液,測定發酵液pH值(PB-21 型pH計,Sartorius)。脂肪酸測定參照Lin等的方法[21]:取2 mL發酵液,離心(12 000 r/min,20 min)后,取上清液1 mL,加入0.2 mL的偏磷酸(濃度25%,含60 mmol/L巴豆酸),-20 ℃保存,測定前取出解凍后離心(轉速和時間同前),過濾上清液(0.22 μm水相濾膜),上機測定C2~C6脂肪酸的含量。氣相色譜條件:毛細柱(Agilent J & W Advanced Capillary GC columns,30 m×0.32 mm×0.25 μm),柱溫100 ℃,FID檢測器,檢測器溫度 200 ℃,載氣為氮氣,進樣量1.0 μL。
1.4 微生物群落分析
用EDTA緩沖溶液(10 mmol/L EDTA,0.15 mol/L NaCl,100 mmol/L tris/HCl,pH值8.0)30 mL將固液混合發酵液洗滌至攪拌杯中,均質 2 min,經無菌紗布過濾入離心管,離心(12 000 r/min,30 min),棄上清,用1 mL提取緩沖液復懸沉淀,送北京諾禾致源生物技術有限公司測序分析。細菌和真菌的擴增引物分別為16S V4區的515F和806R、ITS 5-1737F和ITS 2-2043R。菌群結構分析參照Lin等的方法[21]:將一致性>97%的序列聚類為OTUs,從標準化OTUs (operational taxonomic units)數據中計算微生物群落結構,對相對豐度與C2~C6脂肪酸產量進行Spearman 相關分析。
1.5 統計方法
用單因素ANOVA進行差異顯著性分析,用Tukeys法進行兩兩比較(SPSS 18.0)。當方差齊性檢驗顯著時,用非參數檢驗重新分析數據在3組間的差異顯著性。表格內的數據以“平均值±標準差”表示。
2 結果與分析
2.1 不同處理pH值和產酸比較
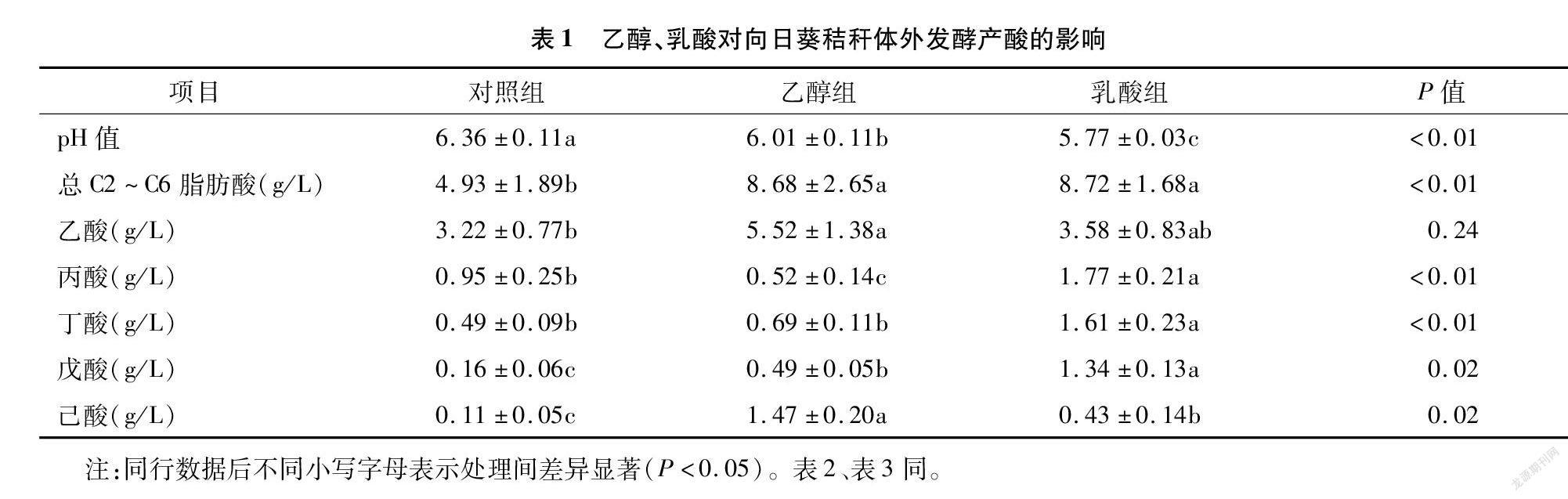
由表1可知,與對照組相比,添加乙醇和乳酸作為電子供體顯著降低pH值,并且乳酸組pH值最低。添加乙醇和乳酸顯著提高了總酸的產量,與對照組相比,乙醇和乳酸產量分別提高了76.1%和76.9%。對單一脂肪酸分析結果表明,添加乙醇顯著提高了乙酸、戊酸和己酸含量,分別提高了71.4%、206.3%和1 236.4%。添加乳酸顯著提高丙酸、丁酸、戊酸和己酸產量,分別提高了86.3%、228.6%,737.5%和290.9%。乙醇組乙酸和己酸產量最高,乳酸組丙酸、丁酸和戊酸產量最高。
2.2 不同處理多樣性分析
由表2可知,與對照組相比,乙醇組細菌和真菌的Chao1(豐富度)指數和Shannon(多樣性)指數顯著降低,細菌Shannon指數和Chao1指數分別下降了15.4%和24.6%,真菌Shannon指數和Chao1指數分別下降了16.3%和30.4%。與對照組相比,乳酸組與乙醇組相似,細菌Shannon指數和Chao1指數分別下降了25.4%和46.3%,真菌Shannon指數和Chao1指數分別下降了27.5%和47.6%。乳酸對瘤胃細菌和真菌的豐富度和多樣性影響大于乙醇。
2.3 不同處理相對豐度和相關性分析
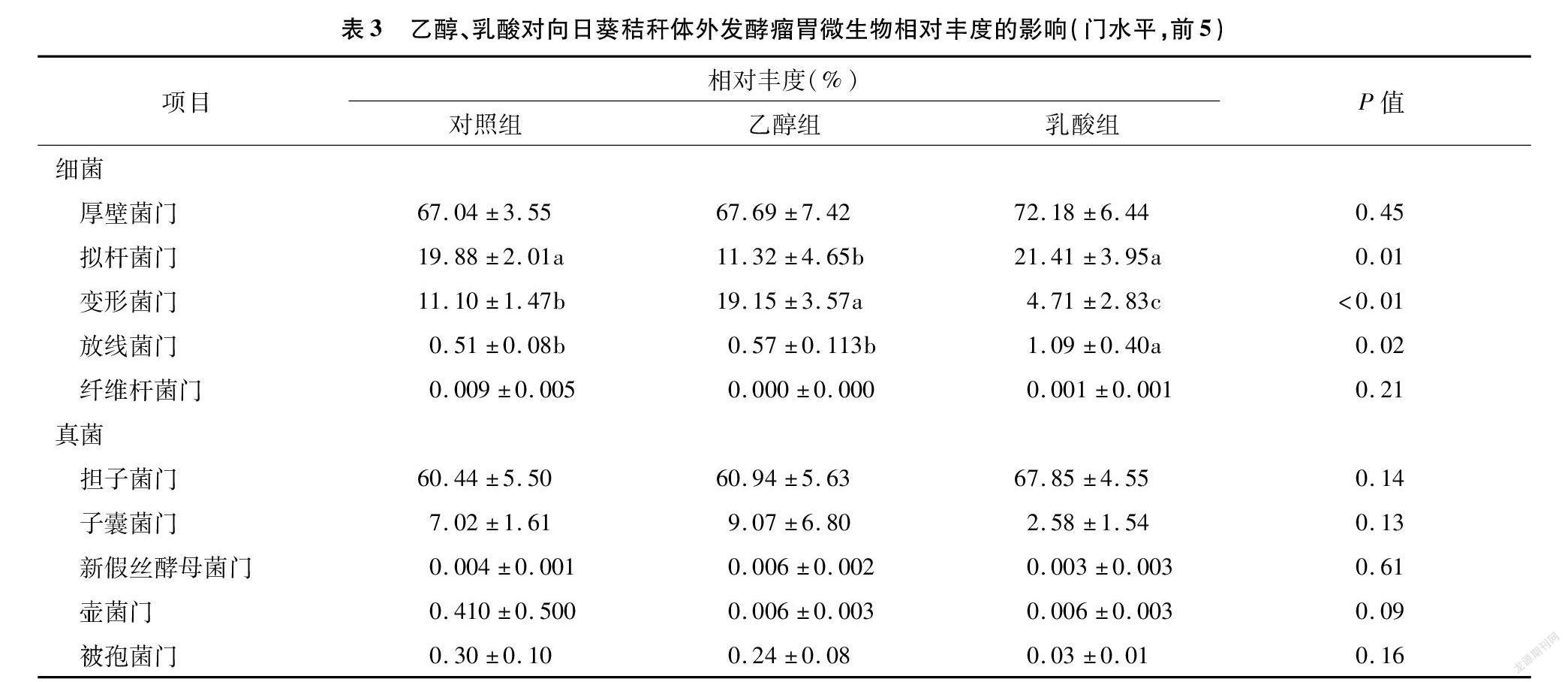
門水平上相對豐度的比較分析見表3。對照組和電子供體添加組的厚壁菌門、擬桿菌門和變形菌門的相對豐度總和均>95%,且厚壁菌門>擬桿菌門>變形菌門。與對照組相比,添加乙醇顯著降低擬桿菌門的相對豐度,降低43.1%;顯著提高變形菌門的相對豐度,提高72.5%。添加乳酸顯著降低變形菌門的相對豐度,降低57.6%;顯著提高放線菌門的相對豐度,提高113.7%。
對照組和電子供體添加組的擔子菌門和子囊菌門的相對豐度總和均>67%,是主要的優勢菌門,擔子菌門的相對豐度>子囊菌門。與對照組相比,添加乙醇或乳酸對相對豐度前5的真菌門無顯著影響。
屬水平上各組細菌和真菌相對豐度的差異見圖1。從圖1-A可知,與對照組相比,添加乙醇顯著提高脫硫弧菌屬、薩特氏菌屬和解琥珀酸菌屬的相對豐度,分別提高191.0%、294.4%和 1 157.6%;添加乳酸顯著提高巨型球菌屬、Shuttleworthia、互營球菌屬、光岡菌屬、未定義的普雷沃氏菌的相對豐度,分別提高7 700%、345.3%、1 968.2%、281.0%和101.4%。由圖1-B可知,在屬水平上,與對照組相比,添加乙醇顯著提高絲孢菌屬和畢赤酵母菌屬的相對豐度,分別提高403.1%和236.6%。添加乳酸顯著提高節擔菌屬的相對豐度,提高40.5%。
在種水平上,挑選r2≥0.8的數據分析,從表4可以看出,在菌相對豐度與產酸量之間,布氏普雷沃氏菌與丙酸呈顯著正相關,而亨氏丁酸弧菌與丙酸呈極顯著負相關。埃氏巨型球菌和普雷沃氏菌 sp. DJF CP65與丁酸和戊酸呈極顯著正相關。梅里科拉節擔與丁酸和戊酸呈極顯著正相關,粗糙肉齒菌與丁酸呈極顯著負相關。
3 討論與結論
瘤胃發酵有機物產生的有機酸增多會導致pH值降低。本研究中,瘤胃發酵在乙醇和乳酸都提高了體外總脂肪酸的產量,同時降低了pH值,說明pH值的下降可能是由于有機酸產量增加導致,同時推測由于乙醇和乳酸作為電子供體在降解纖維為有機酸中提供了底物,使發酵纖維更徹底。3組的發酵液pH值為5.77~6.36,其中乳酸組最低。瘤胃液pH值若長時間低于5.6會導致革蘭氏陰性菌的死亡[22],本試驗乳酸組的細菌和真菌的豐富度和多樣性均最低,推測原因是低pH值殺死了不耐酸的微生物。傳統的戊酸從甘油中獲得,己酸從椰子油中獲得,但得率很低。厭氧發酵有機廢棄物可以增加己酸的產量[20],添加乙醇可有效促進高纖維底物中己酸的產量[8,19]。Chwialkowska等比較乙醇或乳酸對乳清厭氧發酵的產酸效果差異發現,乳酸更能提高戊酸的產量[23]。本試驗同樣發現戊酸和己酸產量隨著添加乙醇或乳酸而升高,說明乙醇和乳酸在向日葵秸稈與瘤胃液共培養生產高附加值化學品中具有潛力。
埃氏巨型球菌是瘤胃的固有細菌,在研究奶牛乳脂降低中被認為可利用乳酸[24]。相關報道,該菌可利用葡萄糖和乳酸生產丁酸、戊酸和己酸[20,25]。Weimer等認為,該菌對葡萄糖的利用率低,且不具有工業化合成己酸的潛力[26]。Kim等認為,該菌可以轉化葡萄糖獲得高濃度己酸[27]。本研究中,乙醇促進了戊酸和己酸的產生,乳酸促進了丙酸、丁酸、戊酸和己酸的產生,并且埃氏巨型球菌相對豐度與丁酸、戊酸產量呈極顯著正相關,推測該菌與存在乙醇或乳酸的厭氧發酵向日葵秸稈時的產物可能是丁酸和戊酸。普雷沃氏菌屬于擬桿菌門,在瘤胃中分布廣泛,數量多,包括半纖維素分解菌和蛋白分解菌,降解蛋白質的產物是氨基酸和氨,降解碳水化合物的產物是丙酮酸和揮發性脂肪酸[28]。因此,普雷沃氏菌可增加瘤胃內乙酸和丁酸的比例[29]。本研究中,布氏普雷沃氏菌相對豐度與丙酸產量呈極顯著正相關,普雷沃氏菌 sp. DJF CP65相對豐度與丁酸和戊酸產量呈極顯著正相關,說明該菌能夠在產丙酸、丁酸和戊酸中發揮作用。Yang 等報道在含乙醇的污泥厭氧發酵液中,脫硫弧菌屬是優勢菌屬,稻秸瘤胃發酵液中添加乙醇也提高了脫硫弧菌屬的相對豐度[8,30],本試驗結果與這些結論相似,說明脫硫弧菌屬在利用乙醇作為碳源代謝產己酸過程中有潛在作用。
瘤胃厭氧真菌可以在木質纖維素底物降解過程中分泌一系列的粗纖維降解酶,從而達到預處理底物并釋放可溶性糖的作用,尤其與甲烷菌共培養后,其粗纖維降解能力增強[31]。梅里科拉節擔菌屬于擔子菌亞門,目前對該菌的研究較少。Sun等認為,該菌具有獨特的系統發育地位以及對環境的適應性很強[32]。Skalskid等在小鼠和人的疾病模型研究中發現,該菌具有耐藥性且可能加劇腸道菌群結構變化并加重病情[33]。本研究中,梅里科拉節擔菌相對豐度與丁酸和戊酸產量呈顯著正相關。表明該菌在瘤胃體外發酵產酸中有潛在作用,但是否能作為發酵產酸菌有待進一步研究。
本試驗結果表明,在向日葵秸稈的瘤胃體外發酵體系中,添加乙醇或乳酸顯著提高C2~C6總酸的產量。乙醇組己酸產量最高,乳酸組戊酸產量最高,二者對瘤胃細菌的影響大于真菌。埃氏巨型球菌屬、普雷沃氏菌屬、脫硫弧菌屬和梅里科拉節擔真菌在本試驗培養體系中實現碳鏈衍生發酵產酸中有潛在作用。
參考文獻:
[1]石祖梁,王 飛,王久臣,等. 我國農作物秸稈資源利用特征、技術模式及發展建議[J]. 中國農業科技導報,2019,21(5):8-16.
[2]Sharma R. Agricultural straw burning and its impact on the environment[J]. International Journal of Environment Research,2021,3(7):26-31.
[3]Kumar D,Singh B,Korstad J. Utilization of lignocellulosic biomass by oleaginous yeast and bacteria for production of biodiesel and renewable diesel[J]. Renewable and Sustainable Energy Reviews,2017,73:654-671.
[4]Tsui T H,Wong J W C. A critical review:emerging bioeconomy and waste-to-energy technologies for sustainable municipal solid waste management[J]. Waste Disposal & Sustainable Energy,2019(3):151-167.
[5]Sherif N,Gadalla M,Kamel D. Acid-hydrolysed furfural production from rice straw bio-waste:process synthesis,simulation,and optimisation[J]. South African Journal of Chemical Engineering,2021,38:34-40.
[6]Poszytek K,Ciezkowska M,Sklodowska A,et al. Microbial consortium with high cellulolytic activity (MCHCA) for enhanced biogas production[J]. Frontiers in Microbiology,2016,7:324.
[7]Safaripour M,Ghanbari A,Seyedabadi E,et al. Investigation of environmental impacts of bioethanol production from wheat straw in Kermanshah,Iran[J]. Biomass Conversion and Biorefinery,2021:1-11.
[8]林 淼,王闊鵬,陳映良,等. 乙醇對瘤胃液接種稻秸的體外發酵產物及細菌群落結構的影響[J]. 生物技術通報,2020,36(2):91-99.
[9]Patel A K,Singhania R R,Sim S J,et al. Thermostable cellulases:current status and perspectives[J]. Bioresource Technology,2019,279:385-392.
[10]Zheng Y,Zhao J,Xu F Q,et al. Pretreatment of lignocellulosic biomass for enhanced biogas production[J]. Progress in Energy and Combustion Science,2014,42:35-53.
[11]田亞紅,王巍杰,王麗萍,等. 向日葵秸稈發酵生產乙醇工藝的研究[J]. 釀酒科技,2013(6):40-42.
[12]張 佳,王 園,安曉萍,等. 向日葵副產物的營養特性及在反芻動物中的應用[J]. 中國畜牧獸醫,2021,48(3):916-924.
[13]Yue Z B,Li W W,Yu H Q. Application of rumen microorganisms for anaerobic bioconversion of lignocellulosic biomass[J]. Bioresource Technology,2013,128:738-744.
[14]艾 平,田啟歡,席 江,等. 稻秸預處理厭氧強化產揮發性脂肪酸研究[J]. 農業機械學報,2018,49(3):309-316.
[15]Bengtsson S,Hallquist J,Werker A,et al. Acidogenic fermentation of industrial wastewaters:effects of chemostat retention time and pH on volatile fatty acids production[J]. Biochemical Engineering Journal,2008,40(3):492-499.
[16]Weimer P J,Kohn R A. Impacts of ruminal microorganisms on the production of fuels:how can we intercede from the outside?[J]. Applied Microbiology and Biotechnology,2016,100(8):3389-3398.
[17]Grootscholten T I M,Steinbusch K J J,Hamelers H V M,et al. Chain elongation of acetate and ethanol in an upflow anaerobic filter for high rate MCFA production[J]. Bioresource Technology,2013,135:440-445.
[18]王薪淯,朱曉宇,李海翔,等. 乳酸碳鏈延長技術及其在有機廢棄物資源化中的應用研究進展[J]. 應用與環境生物學報,2020,26(4):827-835.
[19]Lin M,Dai X X,Weimer P J. Shifts in fermentation end products and bacterial community composition in long-term,sequentially transferred in vitro ruminal enrichment cultures fed switchgrass with and without ethanol as a co-substrate[J]. Bioresource Technology,2019,285:121324.
[20]Chen W S,Strik D P B T B,Buisman C J N,et al. Production of caproic acid from mixed organic waste:an environmental life cycle perspective[J]. Environmental Science & Technology,2017,51(12):7159-7168.
[21]Lin M,Feng L M,Cheng Z Q,et al. Effect of ethanol or lactic acid on volatile fatty acid profile and microbial community in short-term sequentially transfers by ruminal fermented with wheat straw in vitro[J]. Process Biochemistry,2021,102:369-375.
[22]Kleen J L,Hooijer G A,Rehage J,et al. Subacute ruminal acidosis (SARA):a review[J]. Journal of Veterinary Medicine Series A,2003,50(8):406-414.
[23]Chwialkowska J,Duber A,Zagrodnik R,et al. Caproic acid production from acid whey via open culture fermentation—evaluation of the role of electron donors and downstream processing[J]. Bioresource Technology,2019,279:74-83.
[24]Weimer P J,da Silva C L,Cacite F. Effects of ruminal dosing of Holstein cows with Megasphaera elsdenii on milk fat production,ruminal chemistry,and bacterial strain persistence[J]. Journal of Dairy Science,2015,98(11):8078-8092.
[25]Angenent L T,Richter H,Buckel W,et al. Chain elongation with reactor microbiomes:open-culture biotechnology to produce biochemicals[J]. Environmental Science & Technology,2016,50(6):2796-2810.
[26]Weimer P J,Moen G N. Quantitative analysis of growth and volatile fatty acid production by the anaerobic ruminal bacterium Megasphaera elsdenii T81[J]. Applied Microbiology and Biotechnology,2013,97(9):4075-4081.
[27]Kim H,Choi O,Jeon B S,et al. Impact of feedstocks and downstream processing technologies on the economics of caproic acid production in fermentation by Megasphaera elsdenii T81[J]. Bioresource Technology,2020,301:122794.
[28]張 潔,張力莉,徐曉鋒. 反芻動物瘤胃內普雷沃氏菌的研究進展[J]. 中國飼料,2020(7):17-21.
[29]Fraga M,Fernández S,Perelmuter K,et al. The use of Prevotella bryantii 3C5 for modulation of the ruminal environment in an ovine model[J]. Brazilian Journal of Microbiology,2018,49:101-106.
[30]Yang P X,Leng L,Tan G Y A,et al. Upgrading lignocellulosic ethanol for caproate production via chain elongation fermentation[J]. International Biodeterioration & Biodegradation,2018,135:103-109.
[31]Solomon K V,Haitjema C H,Henske J K,et al. Early-branching gut fungi possess a large,comprehensive array of biomass-degrading enzymes[J]. Science,2016,351(6278):1192-1195.
[32]Sun X H,Gostincˇar C,Fang C,et al. Genomic evidence of recombination in the basidiomycete Wallemia mellicola[J]. Genes,2019,10(6):427.
[33]Skalski J H,Limon J J,Sharma P,et al. Expansion of commensal fungus Wallemia mellicola in the gastrointestinal mycobiota enhances the severity of allergic airway disease in mice[J]. PLoS Pathogens,2018,14(9):e1007260.

