設施菜地種植年限對土壤nosZ型反硝化微生物群落結構和豐度的影響
王喜英 趙輝 譚智勇 余高



摘要:反硝化微生物在土壤氮素損失和溫室氣體轉化方面具有重要的作用,研究設施菜地土壤反硝化微生物群落結構和數量變化,對評價設施菜地長期種植土壤質量狀況和提高氮轉化認知水平具有重要意義。應用熒光定量PCR和 Illumina Miseq高通量測序技術,以nosZ基因為靶標,研究設施菜地種植3、5、7年和露天菜地(CK)對土壤反硝化微生物群落結構和數量的影響。結果表明:露天菜地(CK)nosZ基因豐度顯著高于其他處理,分別是3、5、7年的1.32倍、1.45倍和1.69倍。隨種植年限延長,nosZ基因豐度逐漸降低。不同處理土壤反硝化微生物群落α多樣性指數差異顯著,α多樣性指數隨種植年限延長逐漸降低,且露天菜地(CK)的Chao1指數和ACE指數最高。門水平上優勢類群為變形菌門;屬水平上優勢類群為慢生根瘤菌屬和無色桿菌屬;變形菌門和慢生根瘤菌屬相對豐度隨設施種植年限延長逐漸降低。主成分分析(PCA)結果表明,隨種植年限延長nosZ群落結構差異較大;其中3年和5 年群落結構相似,7、3、5 年群落結構差異較大。土壤速效鉀、銨態氮和硝態氮含量是nosZ型反硝化微生物數量、α多樣性和群落結構的主要影響因素。綜上可知,設施菜地長期種植顯著降低了nosZ型反硝化微生物數量,并對群落結構有顯著影響。
關鍵詞:設施菜地;種植年限;反硝化微生物;nosZ基因;群落結構
中圖分類號:S182 ??文獻標志碼: A
文章編號:1002-1302(2022)09-0240-07
設施蔬菜是現代農業集約化發展的一個重要分支,對提高自然資源利用率和增加農民收入具有重要的意義。隨著人口的不斷增長和對蔬菜消費需求的增加以及有限的耕地資源,設施蔬菜在過去的40年里得到了高度發展[1]。截至2016年,我國設施蔬菜種植面積已達387多萬hm2,位居世界第一,產值占蔬菜總產值的50%以上[2]。然而,設施蔬菜具有種植指數高、農業投入大、棚內溫濕度較高的封閉或半封閉環境,且無雨水淋溶等特點。因此,設施蔬菜長期種植已經引起了人們對土壤質量退化、土壤和蔬菜潛在污染以及對人類健康的負面影響的擔憂[3-4]。
土壤微生物在土壤生態系統中起著養分循環、有機質轉化、污染物降解和土傳病害防治等作用[5]。相關研究認為,設施蔬菜長期種植對土壤微生物群落結構和功能有負面影響,主要指從細菌為主到以真菌為主的群落演替,功能相關微生物群落成員和物種相互作用的減少,導致一些土傳病原菌替代了對生態有益的微生物群落[6-9]。目前,研究者更多關注的是土壤微生物群落的整體變化或某些選定的與土傳病害有關的微生物。由于土壤微生物具有高度的結構和功能多樣性,不同類型的土壤生物過程由所涉及的功能群微生物驅動完成。迄今為止,在設施蔬菜生產中,土壤功能微生物對蔬菜長期生產的響應仍然知之甚少,尤其是與養分循環相關的微生物。
氮(N)是植物生長的主要限制因子,土壤氮有效性在決定植物氮素吸收和產量方面起著重要作用[10]。氮轉化主要包括氮固定、礦化、硝化和反硝化過程[11]。反硝化作用產生的溫室氣體(N 2O)是大氣臭氧的主要消耗物質,變暖潛力是二氧化碳的298倍[12]。其中,由土壤微生物驅動的反硝化作用對調節氮循環及維持全球氮平衡起著重要的作用[13]。N 2O主要由反硝化作用產生,耕地土壤是最大的來源[14-15]。設施菜地由于投入大量氮肥和大水漫灌,導致土壤反硝化作用強烈,N 2O釋放通量比大田高1.41倍[16]。因此,如何通過微生物來調控N 2O轉化已經成為許多學者關注的焦點[17-18]。目前,反硝化中唯一已知的是通過nosZ基因編碼的N 2O還原酶還原N 2O的生物過程[19]。在森林、草地和耕地中已開始利用nosZ基因來研究反硝化微生物群落結構和多樣性[20-21]。然而,關于設施蔬菜長期種植對土壤nosZ型反硝化微生物群落結構和數量的研究未見報道。
為此,本研究運用熒光定量PCR和Illumina MiSeq高通量測序技術對不同種植年限設施菜地土壤nosZ型反硝化微生物群落結構及豐度進行研究,主要目的在于:(1)隨設施菜地種植年限延長,反硝化微生物群落結構和多樣性如何變化?有哪些優勢類群發生變化?(2)設施蔬菜長期種植中,哪些土壤環境因子對反硝化微生物群落結構影響較大?揭示設施蔬菜長期種植過程中的反硝化能力,為深入了解設施蔬菜土壤氮循環過程提供科學依據。
1 材料與方法
1.1 研究區域概況
試驗樣地位于貴州省銅仁市和平鄉(109°07′44″E,27°46′46″N),屬于亞熱帶季風氣候,年均溫18 ℃,年降水量1 313 mm,土壤類型為黃壤,有機碳含量為22.32 g/kg,全氮含量為1.05 g/kg,pH值為6.15,容重為1.23 g/cm3。
1.2 試驗設計
選擇3個種植年限(3、5和7 年)設施大棚(長、寬規格分別為8、40 m)各3個,以周圍種植的露天蔬菜為對照(CK)。設施菜地基肥施用氮磷鉀復合肥80~100 kg/667 m2,追施氮肥40~50 kg/667 m2。露天菜地施用基肥40~50 kg/667 m2,追肥20~30 kg/667 m2。設施大棚每年蔬菜種植類型一致,主要種植黃瓜和豇豆等。在整個試驗處理中,除種植年限差異外,其余生產管理措施一致。
于2017年7月取樣,當季種植的作物均為黃瓜,每個樣地按“S”形(五點法)采集0~10 cm土壤樣品,用低溫冰盒保存帶回實驗室進行2 mm過篩處理。土樣分為3份,一份新鮮土壤用于銨態氮和硝態氮含量測定;一份-80 ℃冰箱保存用于nosZ基因群落結構和豐度分析;一份室內風干處理用于土壤化學指標測定。
1.3 測定方法
1.3.1 土壤化學性質測定 采用鮑士旦的方法[22]進行測定。土壤pH值采用電位法測定;有機碳(SOC)含量采用重鉻酸鉀氧化法測定;全氮(TN)含量采用凱氏定氮法測定;速效磷(AP)含量采用碳酸氫鈉浸提-鉬銻抗比色法測定;速效鉀(AK)含量采用乙酸銨提取-火焰光度法測定;銨態氮(NH+ 4-N)含量采用靛酚藍比色法測定;硝態氮(NO- 3-N)含量采用酚二磺酸比色法測定。
1.3.2 土壤DNA提取及nosZ基因擴增和熒光定量PCR 稱取0.5 g土壤,按照E.Z.N.A. Mag-BindSoil DNA Kit(Omega,GA,USA)試劑盒操作步驟提取土壤DNA。用1%的瓊脂糖凝膠電泳檢測DNA完整性,用核酸定量儀(Nanodrop-NC2000)檢測DNA濃度和純度。采用引物nosZ-F(5′-GGGCTBGGGCCRTTGCA-3′)與nosZ-R(5′-GAAGCGRTCCTTSGARAACTTG-3′)擴增nosZ基因高變區片段[23]。
PCR產物純化回收后,將其連接至pMD8-T載體,轉化至大腸桿菌DH5α感受態中進行培養,篩選陽性克隆,提取nosZ基因重組質粒,質粒濃度經核酸定量儀測定后,計算基因拷貝數,按照10倍梯度稀釋至103~108拷貝數,制備標準曲線[24]。
1.3.3 高通量測序 PCR產物擴增后,樣品送至上海派森諾生物科技有限公司,運用Illumina MiSeq測序平臺進行測序。使用QIIME軟件調用UCLUST序列比對工具,按照97%的序列相似度進行OTU劃分和歸并,并選取豐度最高的序列作為該OTU的代表序列。利用QIIME軟件將OTU的代表序列與功能基因數據庫進行比對,獲取每個OTU對應的分類學信息。
1.4 數據分析
采用SPSS 21.0軟件進行土壤化學性質、反硝化細菌α多樣性指數、豐度和群落組成相對豐度的差異顯著性分析(α=0.05)和相關性分析。采用R軟件進行主成分分析和冗余分析。
2 結果與分析
2.1 土壤化學性質
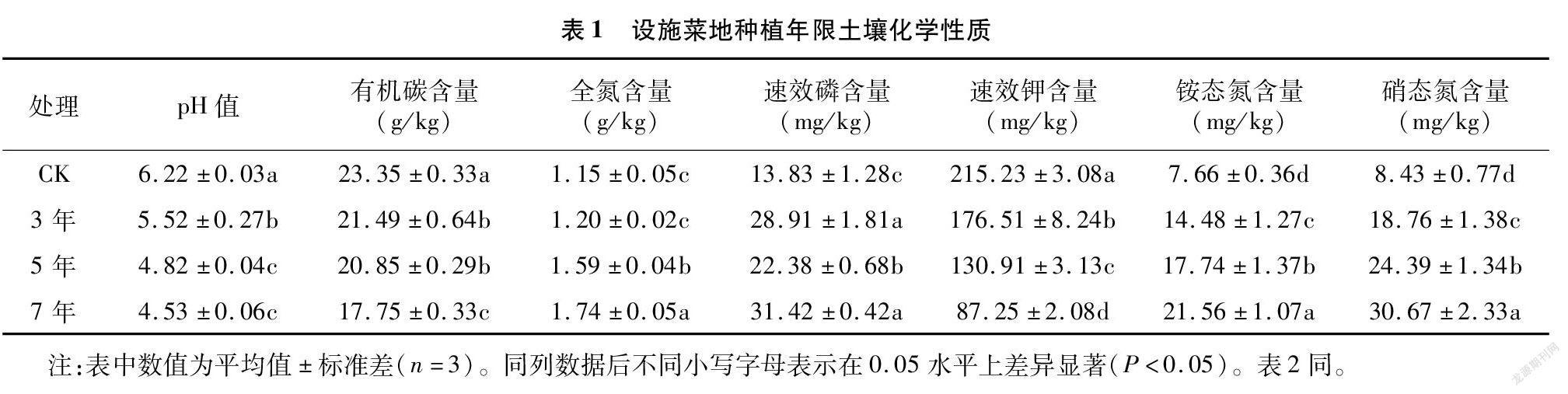
由表1可知,不同設施菜地種植年限土壤pH值及有機碳、速效鉀含量均顯著小于CK,隨種植年限延長逐漸降低。種植3、5、7 年土壤全氮、速效磷、銨態氮和硝態氮含量均高于CK。種植5、7年土壤全氮含量分別比CK顯著增加38.26%、51.30%,種植3 年和CK差異不顯著。不同處理土壤速效磷含量大小順序為7年>3年>5年>CK。土壤銨態氮和硝態氮含量隨種植年限延長而增加,大小順序為7年>5年>3 年>CK。
2.2 nosZ基因豐度
由圖1可知,不同設施菜地種植年限土壤nosZ基因拷貝數變化范圍為5.19×106~8.78×106拷貝/g。不同設施種植年限nosZ基因拷貝數均顯著小于CK(P<0.05),CK分別是設施種植3、5、7年的1.32倍、1.45倍、1.69倍。設施種植3、5、7年的nosZ基因拷貝數之間差異不顯著,隨種植年限延長逐漸降低。
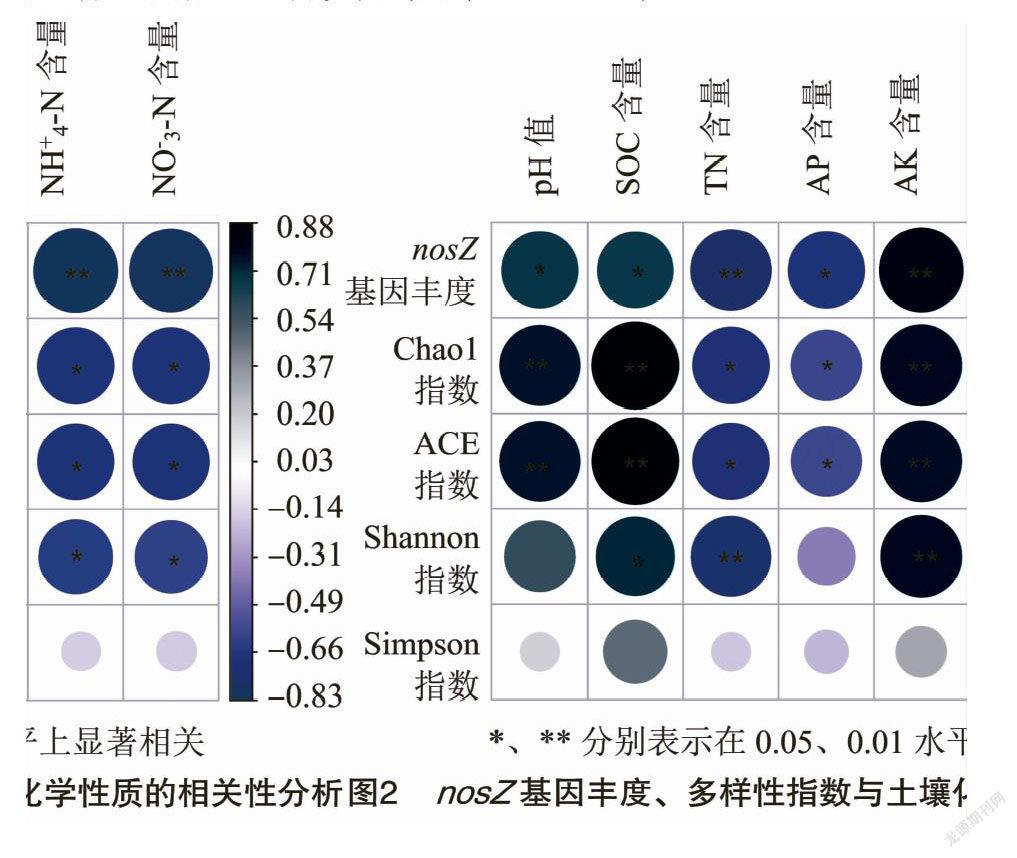
為明確nosZ基因豐度差異的影響因素,由nosZ基因豐度與土壤化學性質進行相關性分析。由圖2可知,nosZ基因豐度分別與土壤pH值和有機碳含量呈顯著正相關(P<0.05);與土壤全氮、銨態氮和硝態氮含量呈極顯著負相關(P<0.01);與速效磷含量呈顯著負相關(P<0.05);與速效鉀含量呈極顯著正相關(P<0.01)。
2.3 nosZ型反硝化微生物α多樣性指數
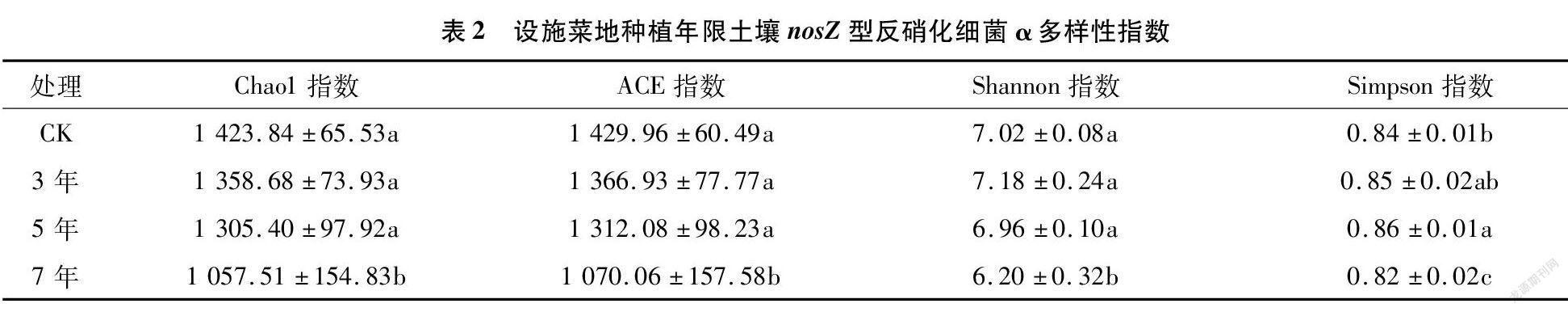
由表2可知,Chao1指數和ACE指數變化趨勢相同,范圍分別為1 057.51~1 423.84和1 070.06~1 429.96,各設施蔬菜種植年限的Chao1指數和ACE指數均小于CK,隨種植年限延長而逐漸降低。Shannon指數和Simpson指數范圍為6.20~7.02和0.82~0.86,種植7年均顯著小于其他處理(P<0.05)。Shannon指數在種植3 年時最高,大小順序為3年>CK>5 年>7年。Simpson指數在種植5年時最高,大小順序為5年>3年>CK>7年。
由相關性分析(圖2)可知,Chao1指數和ACE指數分別與土壤pH值、有機碳和速效鉀含量呈極顯著正相關(P<0.01);與全氮、速效磷、銨態氮和硝態氮含量呈顯著負相關關系(P<0.05)。Shannon指數與土壤有機碳含量呈顯著正相關(P<0.05);與全氮含量呈極顯著負相關(P<0.01);與速效鉀含量呈極顯著正相關(P<0.01);與銨態氮和硝態氮呈顯著負相關(P<0.05)。
2.4 nosZ群落組成
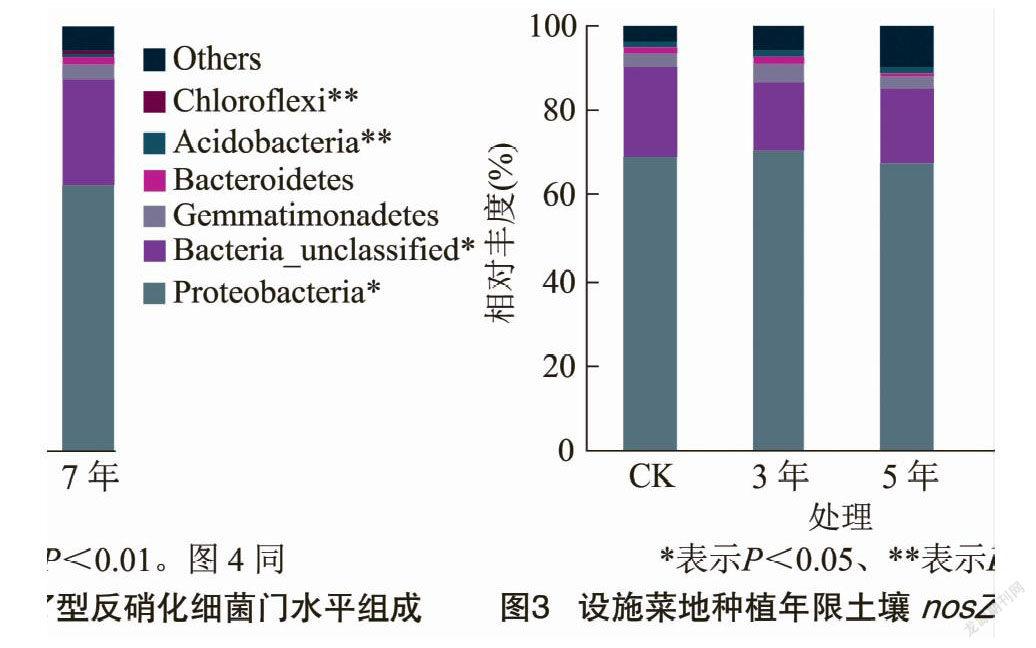
由圖3可知,通過對樣品獲得的nosZ群落OTUs進行歸類,在門水平上共獲得6個類群,分別為變形菌門(Proteobacteria)、Bacteria_unclassified、芽單胞菌門(Gemmatimonadetes)、擬桿菌門(Bacteroidetes)、酸桿菌門(Acidobacteria)和綠彎菌門(Chloroflexi)。 不同設施蔬菜種植年限土壤變形菌門、Bacteria_unclassified、酸桿菌門和綠彎菌門相對豐度差異顯著或極顯著。變形菌門、Bacteria_unclassified和芽單胞菌門為主要優勢類群,相對豐度范圍為62.27%~70.42%、16.66%~25.19%和2.88%~3.82%。種植5、7年的變形菌門相對豐度均小于CK,分別比CK降低2.69%、10.34%。Bacteria_unclassified相對豐度在種植7年中最高,顯著高于種植3年和5年。芽單胞菌門相對豐度在3年中最高,種植5年中最低,大小順序為3年>7年>CK>5年。設施菜地種植年限對變形菌門有抑制作用,隨種植年限增加抑制作用增強。
在屬水平上,可得到平均相對豐度>1%的10個類群(圖4),分別為慢生根瘤菌屬(Bradyrhizobium)、Bacteria_unclassified、無色桿菌屬(Achromobacter)、Aromatoleum、芽單胞菌屬(Gemmatimonas)、蒼白桿菌屬(Ochrobactrum)、Azoarcus、固氮螺菌屬(Azospirillum)、中慢生根瘤菌屬(Mesorhizobium)和紅假單胞菌屬(Rhodopseudomonas)。其中慢生根瘤菌屬、Bacteria_unclassified、無色桿菌屬和紅假單胞菌屬相對豐度在不同設施蔬菜種植年限中差異顯著或極顯著。慢生根瘤菌屬、Bacteria_unclassified和無色桿菌屬為主要優勢類群,相對豐度范圍為39.01%~47.88%、18.48%~27.68%和5.28%~8.57%。慢生根瘤菌屬相對豐度在不同設施種植年限均大于CK,分別是CK的1.23倍、1.12倍、1.07倍。無色桿菌屬相對豐度在種植7 年顯著小于其他處理,大小順序為5年>CK>3年>7年。Aromatoleum相對豐度隨設施蔬菜種植年限的延長逐漸增加,種植3年和5年均小于CK。
2.5 nosZ群落結構及其與土壤化學性質的關系
通過對nosZ群落進行主成分分析(圖5)可知,不同設施種植年限土壤nosZ群落結構差異明顯,第1、第2主成分軸共解釋了細菌群落結構變異的69.94%,其中第1主成分軸解釋了總變異的48.41%,第2主成分軸解釋了總變異的21.53%。種植7年分別與種植3、5年在PC1和PC2上分離都較大,說明隨設施蔬菜種植年限延長,nosZ群落結構變化較大;種植3、5年的群落相聚較近,說明群落相似度較大。
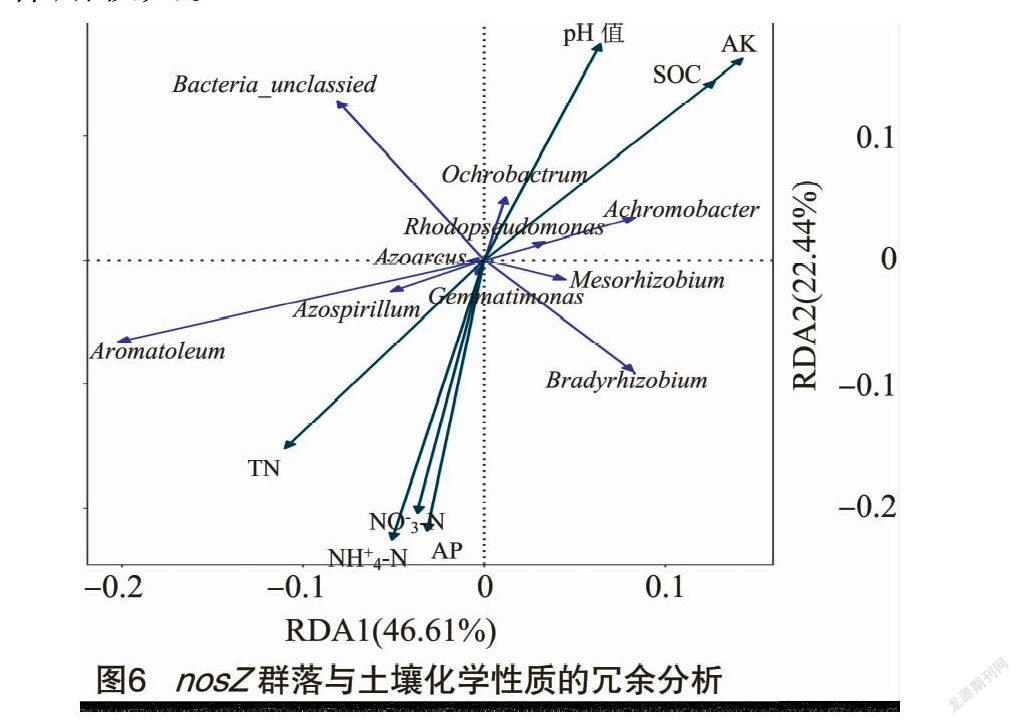
為分析土壤化學性質對nosZ群落結構的影響,對nosZ群落結構與土壤化學指標進行冗余分析。由圖6可知,第1主軸能夠解釋所有信息的46.61%,第2主軸解釋22.44%,兩者累計解釋信息量達69.05%。由此可知,前2軸很好地反映了nosZ群落組成與土壤化學性質的關系,且第1主軸作用較大。
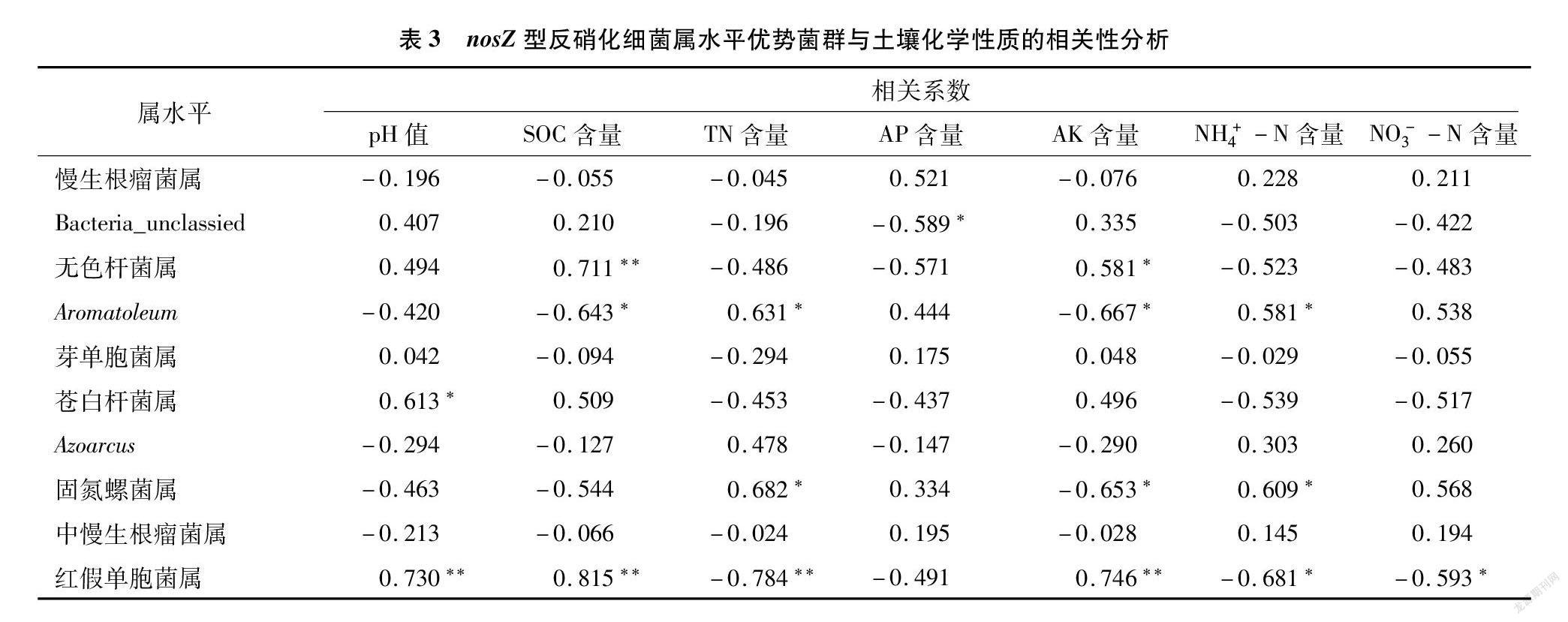
在屬水平上,進一步對nosZ群落和土壤化學性質進行相關性分析(表3)。Bacteria_unclassied與土壤速效磷含量呈顯著負相關(P<0.05)。無色桿菌屬與土壤有機碳含量呈極顯著正相關(P<0.01),與速效鉀含量呈顯著正相關(P<0.05)。Aromatoleum與土壤有機碳含量和速效鉀呈顯著負相關,與全氮、銨態氮呈顯著正相關(P<0.05),與速效鉀呈顯著負相關。蒼白桿菌屬與土壤pH值呈顯著正相關(P<0.05)。固氮螺菌屬與土壤全氮、銨態氮含量呈顯著正相關,與速效鉀含量呈顯著負相關(P<0.05)。紅假單胞菌屬與土壤pH值、有機碳和速效鉀含量呈極顯著正相關(P<0.01),與全氮含量呈極顯著負相關(P<0.01),與銨態氮和硝態氮含量呈顯著負相關(P<0.05)。
3 討論與結論
長期種植設施蔬菜對土壤化學指標有顯著影響,土壤全氮、銨態氮和硝態氮含量隨設施種植年限增加而顯著增加,同時也高于露天菜地(CK),可能由于設施栽培集約化種植,肥料持續高投入且長期連作限制植物生長,影響植物對養分的吸收,大部分養分在土壤中逐年積累[25-26]。由本研究結果可知,設施菜地土壤有機碳含量低于露天菜地(CK),隨種植年限延長逐漸降低,與前人研究結果[27-28]相反,但與Song等的研究結果[29]相似,可能與該區域很少施用有機肥及植物殘體歸還較少等因素有關。本研究中土壤pH值隨種植年限延長逐漸降低,與許多研究結果[30-31]相同,可能是由于長期過量施(氮)肥導致SO2- 4和NO- 3等不斷積累,最終引起土壤酸化增強。
反硝化作用主要由微生物驅動完成,與土壤施肥密切相關[32]。本研究中,nosZ數量隨設施種植年限增加逐漸下降,且顯著小于露天菜地(CK),可能由于設施蔬菜高水肥投入,土壤pH值降低,不利于微生物的N 2O還原酶組裝,降低N 2O還原酶活性,導致微生物對N 2O還原能力下降[33-34]。Hallin等研究認為,nosZ基因拷貝數隨施氮量增加快速下降[32]。本研究中nosZ基因豐度與土壤pH值、有機碳含量呈顯著正相關,由于反硝化微生物為化能異養型生物,有機質可作為能量來源[35]。Matlou等研究認為,土壤有機碳含量與土壤微生物群落結構關系緊密,有機碳為土壤微生物活動提供需要的底物以及能量來源[36]。在本研究,隨設施蔬菜種植年限延長,土壤有機碳含量逐漸降低,不能為反硝化微生物提供充足的能量來源。Bowden等研究認為,土壤有機碳積累是因為微生物生物量減少導致[37]。土壤pH值是反硝化微生物數量變化的主要環境因子[38]。土壤pH值隨設施蔬菜種植年限延長逐漸降低,土壤酸化會引起鐵、鋁等積累,鐵、鋁氫氧化物通過吸附土壤可溶性碳來降低微生物對碳源的利用[39];土壤酸性越強,Al3+積累越多,對土壤細菌細胞膜損害越大[40]。Bauhus等研究表明,在酸性森林土壤中,添加磷可以促進土壤反硝化[41]。本研究中,nosZ基因拷貝數與速效磷含量呈顯著相關,進一步支撐了土壤磷對反硝化微生物具有調控作用,然而關于磷如何調控反硝化微生物生長的機制仍不清楚。硝態氮可作為反硝化底物和反硝化過程的電子受體,影響反硝化微生物生長[42]。本研究中,nosZ反硝化微生物群落ɑ多樣性指數在各處理差異顯著。Chao1指數和ACE指數均是露天菜地(CK)最高,隨種植年限延長逐漸降低,可能由于設施蔬菜長期種植,土壤酸化和鹽漬化嚴重,導致土壤反硝化細菌物種豐度降低。Shannon指數和Simpson指數是種植3年較高,7年較低,隨種植年限延長土壤反硝化微生物物種多樣性降低;可能是由于設施蔬菜長期種植,導致土壤有機碳含量下降,不能為反硝化微生物生長提供豐富碳源。
nosZ型反硝化細菌中優勢類群均為變形菌門,與許多研究結果[12,43]一致。變形菌門的高低可反映土壤有機質等養分含量高低,同時在pH值較高的土壤環境中生長較好[44]。本研究中,變形菌門豐度隨種植年限延長表現出遞降趨勢,露天菜地(CK)和種植3年土壤最高,可能與土壤養分含量高及pH值較高有關,有利于變形菌門生長。屬水平上共有優勢類群為慢生根瘤菌屬,相對豐度平均占nosZ基因序列的43%。種植3、5、7 年的慢生根瘤菌屬相對豐度均大于露天菜地(CK),隨種植年限延長逐漸降低。
相關研究人員認為,反硝化微生物對施肥的反映差異性在于土壤pH值、全氮、銨態氮和硝態氮含量[32]。土壤pH值被認為是影響反硝化微生物群落結構的主要因子,pH值對反硝化微生物具有選擇效應,其變化可以影響反硝化微生物的群落結構,并進而影響它們對環境變化的響應[38]。本研究中,土壤pH值在不同處理中存在顯著差異,并且土壤pH值與nosZ相對豐度之間存在顯著相關關系,說明土壤pH值是引起反硝化微生物群落結構發生變化的主要因素。硝態氮是反硝化的底物,硝態氮含量直接影響反硝化微生物的利用程度[45]。
nosZ基因豐度、Chao1指數和ACE指數變化趨勢一致,隨種植年限延長逐漸降低。門水平上,變形菌門相對豐度占nosZ型反硝化微生物總量的62.27%~70.42%,是設施菜地土壤共有優勢類群,在種植3年土壤中最高。屬水平上,慢生根瘤菌屬和無色桿菌屬為共有優勢類群。為準確評價設施土壤反硝化作用變化規律,需要開展長期試驗,同時還需要對涉及反硝化途徑的其他功能微生物群落進行研究。
參考文獻:
[1]Hu W Y,Zhang Y X,Huang B,et al. Soil environmental quality in greenhouse vegetable production systems in eastern China:current status and management strategies[J]. Chemosphere,2017,170:183-195.
[2]榮勤雷.有機肥/秸稈替代化肥模式對設施菜田土壤團聚體微生物特性的影響[D]. 北京:中國農業科學院,2018.
[3]寧德富,孔麗瓊,湯 娜,等. 不同種植年限蔬菜地土壤養分變化規律研究[J]. 四川農業大學學報,2016,34(1):67-72.
[4]Sun J T,Pan L L,Zhan Y,et al. Contamination of phthalate esters,organochlorine pesticides and polybrominated diphenyl ethers in agricultural soils from the Yangtze River Delta of China[J]. Science of the Total Environment,2016,544:670-676.
[5]van der Heijden M G A,Wagg C.Soil microbial diversity and agro-ecosystem functioning[J]. Plant and Soil,2013,363(1/2):1-5.
[6]Yao Z Y,Xing J J,Gu H P,et al. Development of microbial community structure in vegetable-growing soils from open-field to plastic-greenhouse cultivation based on the PLFA analysis[J]. Journal of Soils and Sediments,2016,16(8):2041-2049.
[7]Li X G,Ding C F,Zhang T L,et al. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing[J]. Soil Biology and Biochemistry,2014,72:11-18.
[8]Xiong W,Li R,Ren Y,et al. Distinct roles for soil fungal and bacterial communities associated with the suppression of Vanilla Fusarium wilt disease[J]. Soil Biology and Biochemistry,2017,107:198-207.
[9]Liu X,Zhang Y,Ren X J,et al. Long-term greenhouse vegetable cultivation alters the community structures of soil ammonia oxidizers[J]. Journal of Soils and Sediments,2019,19(2):883-902.
[10]李生秀.中國旱地土壤植物氮素[M]. 北京:科學出版社,2008:3-5.
[11]Kuypers M M M,Marchant H K,Kartal B.The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology,2018,16(5):263-276.
[12]Thomson A J,Giannopoulos G,Pretty J,et al. Biological sources and sinks of nitrous oxide and strategies to mitigate emissions[J]. Philosophical Transactions of the Royal Society(B:Biological Sciences),2012,367(1593):1157-1168.
[13]楊亞東,宋潤科,馬俊永,等. 長期氮磷不同施用量對土壤細菌、硝化與反硝化微生物數量的影響[J]. 中國農業大學學報,2018,23(9):81-88.
[14]Hu H W,Chen D L,He J Z.Microbial regulation of terrestrial nitrous oxide formation:understanding the biological pathways for prediction of emission rates[J]. FEMS Microbiology Reviews,2015,39(5):729-749.
[15]Shcherbak I,Millar N,Robertson G P.Global meta-analysis of the nonlinear response of soil nitrous oxide (N 2O) emissions to fertilizer nitrogen[J]. PNAS,2014,111(25):9199-9204.
[16]Ravishankara A R,Daniel J S,Portmann R W.Nitrous oxide (N 2O):the dominant ozone-depleting substance emitted in the 21st century[J]. Science,2009,326(5949):123-125.
[17]Hallin S,Philippot L,L ffler F E,et al. Genomics and ecology of novel N 2O-reducing microorganisms[J]. Trends in Microbiology,2018,26(1):43-55.
[18]Schreiber F,Wunderlin P,Udert K M,et al. Nitric oxide and nitrous oxide turnover in natural and engineered microbial communities:biological pathways,chemical reactions,and novel technologies[J]. Frontiers in Microbiology,2012,3:372.
[19]Domeignoz-Horta L,Putz M,Spor A,et al. Non-denitrifying nitrous oxide-reducing bacteria-An effective N 2O sink in soil[J]. Soil Biology and Biochemistry,2016,103:376-379.
[20]陳秀波,朱德全,趙晨晨,等. 涼水國家自然保護區不同林型紅松林土壤nosZ型反硝化微生物群落組成和多樣性分析[J]. 林業科學,2019,55(8):106-117.
[21]Dandie C E,Burton D L,Zebarth B J,et al. Changes in bacterial denitrifier community abundance over time in an agricultural field and their relationship with denitrification activity[J]. Applied and Environmental Microbiology,2008,74(19):5997-6005.
[22]鮑士旦.土壤農化分析[M]. 3版.北京:中國農業出版社,2000:25-114.
[23]Chen Z,Hou H J,Zheng Y,et al. Influence of fertilisation regimes on a nosZ-containing denitrifying community in a rice paddy soil[J]. Journal of the Science of Food and Agriculture,2012,92(5):1064-1072.
[24]Kloos K,Mergel A,Rosch C,et al. Denitrification within the genus Azospirillum and other associative bacteria[J]. Functional Plant Biology,2001,28(9):991-998.
[25]宋蒙亞,李忠佩,吳 萌,等. 不同種植年限設施菜地土壤微生物量和群落結構的差異[J]. 中國農業科學,2015,48(18):3635-3644.
[26]王學霞,陳延華,王甲辰,等. 設施菜地種植年限對土壤理化性質和生物學特征的影響[J]. 植物營養與肥料學報,2018,24(6):1619-1629.
[27]Liu Y,Liu X Y,Feng Y F,et al. Composition of a soil organic carbon increment under different vegetable cultivation patterns:a study using three SOC pools[J]. Sustainability,2018,11(1):35.
[28]Wang Y,Xu H,Wu X,et al. Quantification of net carbon flux from plastic greenhouse vegetable cultivation:a full carbon cycle analysis[J]. Environmental Pollution,2011,159(5):1427-1434.
[29]Song Y,Xu M,Li X N,et al. Long-term plastic greenhouse cultivation changes soil microbial community structures:a case study[J]. Journal of Agricultural and Food Chemistry,2018,66(34):8941-8948.
[30]高新昊,張英鵬,劉兆輝,等. 種植年限對壽光設施大棚土壤生態環境的影響[J]. 生態學報,2015,35(5):1452-1459.
[31]Yang L Q,Huang B A,Hu W Y,et al. The impact of greenhouse vegetable farming duration and soil types on phytoavailability of heavy metals and their health risk in Eastern China[J]. Chemosphere,2014,103:121-130.
[32]Hallin S,Jones C M,Schloter M,et al. Relationship between N-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment[J]. The ISME Journal,2009,3(5):597-605.
[33]田 浩,楊柳青,曹文超,等. 設施菜田與棚外糧田土壤菌群和反硝化氣體產生的比較分析[J]. 微生物學通報,2015,42(5):835-844.
[34]Bergaust L,Mao Y J,Bakken L R,et al. Denitrification response patterns during the transition to anoxic respiration and posttranscriptional effects of suboptimal pH on nitrous oxide reductase in Paracoccus denitrificans[J]. Applied and Environmental Microbiology,2010,76(19):6387-6396.
[35]Menyailo O V,Huwe B.Activity of denitrification and dynamics of N 2O release in soils under six tree species and grassland in central Siberia[J]. Journal of Plant Nutrition and Soil Science,1999,162(5):533-538.
[36]Matlou M C,Haynes R J.Soluble organic matter and microbial biomass C and N in soils under pasture and arable management and the leaching of organic C,N and nitrate in a lysimeter study[J]. Applied Soil Ecology,2006,34(2/3):160-167.
[37]Bowden R D,Davidson E,Savage K,et al. Chronic nitrogen additions reduce total soil respiration and microbial respiration in temperate forest soils at the Harvard Forest[J]. Forest Ecology and Management,2004,196(1):43-56.
[38]Enwall K,Philippot L,Hallin S.Activity and composition of the denitrifying bacterial community respond differently to long-term fertilization[J]. Applied and Environmental Microbiology,2005,71(12):8335-8343.
[39]Tang Y Q,Zhang X Y,Li D D,et al. Impacts of nitrogen and phosphorus additions on the abundance and community structure of ammonia oxidizers and denitrifying bacteria in Chinese fir plantations[J]. Soil Biology and Biochemistry,2016,103:284-293.
[40]Yaganza E S,Rioux D,Simard M,et al. Ultrastructural alterations of Erwinia carotovora subsp. atroseptica caused by treatment with aluminum chloride and sodium metabisulfite[J]. Applied and Environmental Microbiology,2004,70(11):6800-6808.
[41]Bauhus J,Khanna P K.Carbon and nitrogen turnover in two acid forest soils of southeast Australia as affected by phosphorus addition and drying and rewetting cycles[J]. Biology and Fertility of Soils,1994,17(3):212-218.
[42]Liu C X,Dong Y H,Sun Q W,et al. Soil bacterial community response to short-term manipulation of the nitrogen deposition form and dose in a Chinese fir plantation in southern China[J]. Water,Air,& Soil Pollution,2016,227(12):1-12.
[43]彭衛福.土壤肥力對水稻氮素利用效率和氮循環相關微生物的影響[D]. 南昌:江西農業大學,2017.
[44]萬 盼,胡艷波,張弓喬,等. 甘肅小隴山油松與柴胡栽培土壤細菌群落特征[J]. 生態學報,2018,38(17):6016-6024.
[45]King D,Nedwell D B.The influence of nitrate concentration upon the end-products of nitrate dissimilation by bacteria in anaerobic salt marsh sediment[J]. FEMS Microbiology Letters,1985,31(1):23-28.

