創傷后急性呼吸窘迫綜合征患者IL-33、Ang-2、GM-CSF水平的動態變化及其臨床意義
王新剛, 王廣河, 任青松
急性呼吸窘迫綜合征(acute respiratory distress syndrome, ARDS)是指因吸入有害氣體、重癥胰腺炎、膿毒癥等非心源性致病因素引發的呼吸窘迫,具有較高的發病率。據調查顯示,重癥醫學科(intensive care unit, ICU)創傷患者ARDS發病率高達40%以上,病死率為50%,是ICU創傷患者重要的致死原因之一[1-3]。目前,臨床認為創傷誘發的全身炎癥反應綜合征是創傷后ARDS主要發病機制[4]。ARDS早期由于血管內皮細胞損傷導致血管外肺水腫增加,受累最嚴重的器官為肺臟。因此,從血管炎癥方面尋找預后標記物尤為關鍵。血清白細胞介素-33(interleukin-33, IL-33)作為近年來新發現的內源性警告分子,在黏膜中分泌產生,可激活核轉錄因子-κB信號轉導通路,促進輔助性T細胞2分泌炎癥介質,加重黏膜周圍局部炎癥[5-6]。血管生成素-2(angiopoietin-2, Ang-2)是由內皮細胞合成的血管形成因子,參與血管內皮細胞生理、病理過程[7-8]。粒細胞巨噬細胞集落刺激因子(granulocyte macrophage colony stimulating factor, GM-CSF)的表達可刺激單核細胞或巨噬細胞激活,提高相關炎癥性細胞對肺實質損傷及浸潤程度[9-10]。本研究擬探討ICU創傷后ARDS患者IL-33、Ang-2、GM-CSF 動態變化的意義,旨在為臨床診療及預后預測提供依據。
1 對象與方法
1.1 對象 選取2018年5月—2021年8月筆者醫院ICU創傷后ARDS患者108例為觀察組,診斷標準[11]:年齡≥18歲,損傷嚴重程度評分(injury severity score, ISS)>16分,治療方法一致。排除標準:合并嚴重心、肝、腎功能障礙者,存在動脈穿刺、置管禁忌證者,入院擬行手術者,無28 d隨訪記錄者。另選取同期健康體檢者60例為對照組。兩組患者的年齡、性別及體質量指數等基線資料比較,差別無統計學意義(P>0.05,表1)。本研究經筆者醫院醫學倫理委員會審核批準(倫理號:2018010336),患者或其家屬自愿簽署知情同意書。

表1 兩組患者的臨床資料比較
1.2 試劑 IL-33 ELISA試劑盒(批號:223866,上海宇淳生物科技有限公司提供雙抗體夾心酶聯免疫吸附法商品試劑盒,產品包裝:96次,靈敏度:4.7 pg/mL,檢測范圍:11.72~750 pg/mL,重復6次);Ang-2試劑盒(批號:99971,產品包裝:96次,靈敏度:10 pg/mL,檢測范圍:14.12~3 000 pg/mL,重復6次);BGM-CSF試劑盒(批號:PG340,產品包裝:96次,靈敏度:6.5 pg/mL,檢測范圍:8.5~1 200 pg/mL,重復6次);試劑盒標準品、檢測溶液A(生物素化的抗IL-33、Ang-2、GM-CSF多克隆抗體)、檢測溶液B(HRP標記的親和素)和96孔板(已包被抗IL-33、Ang-2、GM-CSF單克隆抗體)儲存于-20 ℃環境下,其他試劑保存于-4 ℃冰箱內,有效期內使用。
1.3 方法 兩組患者均于清晨空腹狀態下采集外周靜脈血5 mL,3 500 r/min離心處理,離心半徑16.5 cm,分離血清、血漿檢測IL-33、Ang-2、GM-CSF 水平,置于-70 ℃環境下待檢。在標準品中加入稀釋液稀釋,溶解后的標準品稀釋濃度達到后,繼續依次根據標準曲線進行稀釋、洗滌,96孔板上孵育、洗滌;棄去液體,甩干,不洗滌,加檢測溶液A、B工作液,37 ℃孵育1 h;棄液體,洗滌液洗板,重復5次,加底物溶液90 μL,37 ℃避光顯色20 min,加終止溶液50 μL終止反應后,5 min內酶標儀檢測450 mm光密度(optical density,OD)值。
1.4 觀察指標 (1)比較兩組患者的IL-33、Ang-2、GM-CSF水平。(2)不同預后患者入ICU 0、24、48、72 h的IL-33、Ang-2、GM-CSF水平的動態變化。(3)IL-33、Ang-2、GM-CSF水平對ICU創傷后ARDS患者預后的預測價值。(4)不同IL-33、Ang-2、GM-CSF水平ICU創傷后ARDS患者28 d生存情況。
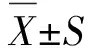
2 結 果
2.1 IL-33、Ang-2、GM-CSF水平比較 觀察組各時間點的IL-33、Ang-2、GM-CSF水平均高于對照組,差別有統計學意義(P<0.05)。隨著時間延長,觀察組的IL-33、Ang-2、GM-CSF水平明顯下降(P<0.05,表2)。

表2 兩組患者的IL-33、Ang-2、GM-CSF水平比較

2.2 不同預后患者入ICU不同時間點IL-33、Ang-2、GM-CSF水平動態變化 入ICU 0、24 h,病死患者的IL-33、Ang-2、GM-CSF水平與生存患者比較,差別無統計學意義(P>0.05);入ICU 48、72 h,病死患者的IL-33、Ang-2、GM-CSF水平高于生存患者,差別有統計學意義(P<0.05,表3)。

表3 不同預后患者的IL-33、Ang-2、GM-CSF水平動態變化比較

2.3 IL-33、Ang-2、GM-CSF水平對ICU創傷后ARDS患者預后的預測價值 繪制IL-33、Ang-2、GM-CSF水平預測ICU創傷后ARDS患者預后的ROC曲線,結果顯示,入ICU 72 h對ICU創傷后ARDS患者預后的預測價值更大,其ROC曲線AUC為0.939,最佳敏感度、特異度分別為86.84%和91.43%(表4,圖1)。

表4 IL-33、Ang-2、GM-CSF水平對ICU創傷后ARDS患者預后的預測價值

IL-33:白細胞介素-33;Ang-2:血管生成素-2;GM-CSF:粒細胞巨噬細胞集落刺激因子。A:48 h;B:72 h。圖1 入ICU 48、72 h各指標預測預后的ROC曲線Fig.1 ROC curve of prognosis predicted by various indicators after entering ICU for 48,72 h
2.4 生存曲線 ICU創傷后ARDS患者入ICU 72 h時,IL-33、Ang-2、GM-CSF的截斷值分別為284.52、255.49 和 49.98 ng/L。以各指標截斷值為界,≤截斷值為低水平患者,>截斷值為高水平患者。入ICU 72 h時,IL-33、Ang-2、GM-CSF高水平患者28 d累積生存率低于低水平患者(log-rank檢驗:χ2=23.672、10.144、17.905,P<0.001,圖2)。

IL-33:白細胞介素-33;Ang-2:血管生成素-2;GM-CSF:粒細胞巨噬細胞集落刺激因子。A:IL-33;B:Ang-2;C:GM-CSF。圖2 不同IL-33、Ang-2、GM-CSF水平患者的28 d生存曲線Fig.2 28 days survival curve of patients with different levels of IL-33, Ang-2 and GM-CSF
3 討 論
在創傷后ARDS的發病機制中,肺臟為最易受侵襲的器官。在ARDS發病早期,由于廣泛的肺泡損害,肺部毛細血管內皮細胞、肺泡上皮細胞屏障通透性增高,造成肺水腫、肺不張等,甚至可能導致其他臟器功能障礙,引發不良預后[12-14]。
本研究中,觀察組血清IL-33水平明顯高于對照組,且其水平與病情程度呈正相關。IL-33是IL細胞因子家族成員之一,最初被認為是ST2L的配體,并涉及各種過敏性、炎癥反應的因子[15]。故本研究結果充分說明IL-33參與創傷后炎癥反應,分析原因,可能是由于創傷導致ARDS后,IL-33作為一種內源性警告分子,可傳遞內源性損傷信號,進而在炎癥反應中發揮一定調節作用。IL-33一方面激活肥大細胞、白細胞,從而誘導促炎細胞因子釋放,參與炎癥反應,另一方面可激活天然淋巴細胞及輔助性T細胞,進而產生抗炎細胞因子,從而發揮控制炎癥作用。動物研究發現,IL-33可能因嚴重肺損傷引起細胞壞死,在肺部局部產生、釋放,進入氣道[16-17]。適度炎癥反應在殺滅病原微生物及清除壞死組織方面具有顯著作用,有利于創傷愈合。目前認為,創傷后ARDS患者IL-33釋放的機制為細胞損傷、壞死。本研究發現,入ICU 48、72 h,病死患者IL-33水平高于生存患者,提示入ICU 48、72 h時檢測患者的IL-33水平,有助于預測預后,考慮可能原因為IL-33過量釋放,導致抗炎反應過度及免疫麻痹,進而影響患者預后。
Ang為近年來發現的一種內皮細胞特異性促血管生成因子家族,包括Ang-1、Ang-2、Ang-3、Ang-4,通過作用于細胞膜上的酪氨酸激酶受體發揮生物學效應[18]。Ang-1具有抗凋亡、抗炎、維持血管穩定、抗血管滲漏等作用,而Ang-2作為Ang-1的天然拮抗劑,可破壞血管完整性,影響血管內皮間連接,致使血管通透性升高,引起血管滲漏[19]。臨床研究表明,ARDS患者循環中Ang-2水平較非ARDS患者明顯升高,且病情越嚴重,其水平越高[20-21]。本研究中,觀察組Ang-2水平高于對照組,與上述研究結果基本一致。創傷后ARDS患者內皮功能失活及功能失調,Ang-2水平與內皮激活標志相關,是創傷后ARDS早期內皮激活及功能失調的標志,在疾病早期即明顯升高,與病情程度有關。此外,創傷后ARDS患者Ang-2過度釋放,可對肺部中性粒細胞浸潤產生浸潤作用,導致肺損傷進一步加重,從而影響患者預后。本研究中,入ICU 48、72 h 時病死患者Ang-2水平高于生存患者,充分證實上述觀點,臨床上需加以重視。
近年來相關研究表明,炎癥介質、中性粒細胞及CK細胞等與ARDS的發生、發展密切相關[22-23]。GM-CSF是一種對骨髓細胞擴增分化具有刺激作用的CK細胞,主要來源于巨噬細胞、內皮細胞及T淋巴細胞等,具有促進骨髓單核細胞生長分化、增強內皮細胞、中性粒細胞及單核細胞活性、促進血小板活化因子合成作用;同時還可改變基因表達,誘導早期反應基因及炎性因子分泌[24]。此外,肺內炎癥情況下,GM-CSF水平明顯升高。已有研究表明,肺炎患者GM-CSF水平明顯高于健康人群[25]。本研究中,觀察組的GM-CSF水平明顯高于對照組,且與病情嚴重程度呈正相關,充分說明GM-CSF參與創傷后ARDS的發生、發展,其原因可能是:一方面由于ARDS患者體內淋巴細胞處于活化狀態,同時受疾病影響,機體細胞免疫調節紊亂,從而導致GM-CSF水平明顯升高;另一方面由于ARDS發病早期,肺毛細血管內皮和肺泡上皮細胞損傷,致使肺部損傷,大量分泌GM-CSF。本研究中,入ICU 48、72 h時病死患者的GM-CSF水平高于生存患者,可能是由于創傷后ARDS患者GM-CSF過度釋放,機體免疫失衡,肺損傷加重,影響患者預后。
創傷刺激下過度炎癥反應引起的內皮細胞損傷及相關細胞因子活化,是ARDS始動及關鍵因素,在ARDS病情發展中具有重要的意義。ICU創傷后ARDS發病過程中,IL-33激活肥大細胞、白細胞,從而誘導促炎細胞因子釋放,參與炎癥反應,其大量分泌導致機體炎癥反應過度激活,進而造成內皮功能損傷。Ang-2水平升高是內皮激活的標志,GM-CSF可增強內皮細胞,故推測三者之間存在一定聯系。值得注意的是,ROC曲線顯示,入ICU 48 h 時IL-33、Ang-2、GM-CSF預測ICU創傷后ARDS患者預后的AUC均在0.7以上,尤其是聯合預測為0.878,提示入ICU 48 h各指標對ICU創傷后ARDS患者預后具有早期預測價值。進一步研究表明,入ICU 72 h時,上述3個指標對ICU創傷后ARDS患者預后的聯合預測價值更大,充分證實上述觀點。參考ROC曲線分析結果繪制生存曲線,入ICU 72 h時,IL-33、Ang-2、GM-CSF高水平患者的28 d累積生存率高于低水平患者,提示臨床動態監測ICU創傷后ARDS患者IL-33、Ang-2、GM-CSF水平,尤其是入ICU 72 h各指標水平,有助于預測患者預后。但本研究樣本量較小,且缺乏對患者不同病情程度預后的分層研究及對其效益與風險(如費用、抽血等),還需進一步研究證實。
綜上所述,ICU創傷后ARDS患者IL-33、Ang-2、GM-CSF水平明顯升高,臨床動態監測其水平,有助于評估病情、預測預后。

