溴氰菊酯對稀有鮈鯽早期生命階段發育和內分泌干擾毒性
姜錦林,呂建偉,曹少華,劉仁彬,石佳奇,龍 濤,單正軍
溴氰菊酯對稀有鮈鯽早期生命階段發育和內分泌干擾毒性
姜錦林*,呂建偉,曹少華,劉仁彬,石佳奇,龍 濤,單正軍
(生態環境部南京環境科學研究所,國家環境保護土壤環境管理與污染控制重點實驗室,江蘇 南京 210042)
采用半靜態水體暴露方式研究了水中溴氰菊酯對稀有鮈鯽早期生命階段的發育毒性與內分泌干擾效應.結果表明,影響稀有鮈鯽胚胎孵化的LOEC(最低可觀察效應濃度)>3.0μg/L;影響稀有鮈鯽仔魚發育畸形和死亡指標的LOEC和NOEC(無可觀察效應濃度)分別為1.0和0.33μg/L.低至0.04μg/L的溴氰菊酯暴露便可顯著下調稀有鮈鯽幼魚體內雄激素受體基因(AR)表達量并上調甲狀腺激素受體基因(TRβ)表達量;0.11μg/L的溴氰菊酯暴露可以下調稀有鮈鯽幼魚體內雄激素受體基因(AR)、雌激素受體基因(ER1、ER2b)和芳香烴受體基因(AhR1a)的表達量,并上調甲狀腺激素受體基因(TRβ)表達量;0.33μg/L的溴氰菊酯可以下調稀有鮈鯽幼魚體內雄激素受體基因(AR)、雌激素受體基因(ER1、ER2b)、芳香烴受體基因(AhR1a、AhR1b、AhR2)的表達量,并誘導甲狀腺激素受體基因(TRβ)表達量的上調.上述作用濃度水平已經處于多個天然水體中溴氰菊酯的檢出濃度范圍,因此,關于水體殘留溴氰菊酯對魚類的內分泌干擾效應必須予以重視.
溴氰菊酯;稀有鮈鯽;早期生命階段;發育毒性;內分泌干擾
擬除蟲菊酯類農藥是一種高效殺蟲劑,在全球范圍內使用歷史較長,由于其疏水性較強,易富集在水生生物體內,且對水生生物的毒性較大,故對水生生態系統存在一定風險.溴氰菊酯是擬除蟲菊酯類農藥中對蟲類毒力最高的一種,在我國較為常見,被廣泛用于農林漁業病蟲害防治.鑒于其健康風險,溴氰菊酯被美國環保局確定為首要控制使用的擬除蟲菊酯類農藥之一[1],近期研究也發現溴氰菊酯及其代謝產物在人體尿液及母乳中廣泛存在,流行病學研究結果顯示,體內溴氰菊酯可能和小兒智力發育障礙,小兒孤僻癥相關,這可能和哺乳動物早期發育的神經元對溴氰菊酯暴露具有高度敏感性有關[2].一般來說,擬除蟲菊酯類農藥在哺乳動物和高等脊椎動物體內的代謝較快,可快速被清除,但在水生生物體內的代謝和排泄能力較低,毒性較高.作為最早使用擬除蟲菊酯類農藥的國家,美國很早就開始關注擬除蟲菊酯類農藥對水生態環境帶來的影響[3].
由于擬除蟲菊酯類農藥的廣泛應用,近年來世界上越來越多的水體環境中檢測到擬除蟲菊酯類農藥的存在[4–10].由于此類農藥在我國的使用量較大,水環境中殘存的農藥可能會對水生生物造成有害影響.急性研究表明,大部分擬除蟲菊酯類類農藥對枝腳類等浮游生物、蝦類和魚類的毒性等級處于高毒,且總體上,對前兩者(枝腳類和蝦類)的毒性高于后者(魚類).如溴氰菊酯對多刺裸腹溞的24h- LC50為0.133μg/L[11];溴氰菊酯和氰戊菊酯對凡納對蝦的24h-LC50分別為0.20和0.17μg/L[12].而溴氰菊酯對花鰻鱺和黔東南田魚(鯉)的96h-LC50分別為7.67[13]和5.38μg/L[14],聯苯菊酯對真鯛的24h-LC50為2.5μg/L[15].以上研究表明擬除蟲菊酯類農藥對水生態風險不可忽視.目前針對菊酯類農藥對水生生物的致毒機理和毒性效應特征研究相對較少,研究表明溴氰菊酯在48h內可通過氧化損傷途徑對克氏原螯蝦機體產生毒性作用[16];另有研究表明溴氰菊酯對中華絨螯蟹免疫系統有顯著影響[17],且對中華絨螯蟹血細胞有較強的DNA損傷作用[18].此外,諸多研究揭示溴氰菊酯處理對水生魚類具有神經、心血管和生殖毒性,且對魚類的運動有負面影響[19].
稀有鮈鯽()是一種中國特有的淡水魚類,主要生活于支流的溝渠等小水體中,分布于中國四川省漢源縣等地,具有性周期短、易于飼養、對化學物質敏感等優點,是進行化學品毒性測試和環境水樣毒性實驗的理想材料[20,21].本研究選擇稀有鮈鯽作為供試生物,研究溴氰菊酯暴露對稀有鮈鯽早期生命階段的發育毒性和內分泌相關核受體基因表達干擾效應,以期為豐富溴氰菊酯的水生生物毒性效應特征和毒性機制研究,及其更完善的水生態風險評估打下基礎.
1 材料與方法
1.1 儀器與試劑
儀器:繁殖盒(北京愛生科技發展有限公司);1L玻璃魚缸(配蓋,三合祖平玻璃儀器廠);人工氣候箱(上海新苗醫療器械制造有限公司);體視顯微鏡(Leica,S8APO);手持式組織勻漿機;離心機(Sigma 2-16PK);核酸蛋白質測定儀(Beckman-DU800); PCR儀(Bio-Rad DNAEngine);熒光定量PCR儀(Bio-Rad CFX96TMReal-Time System).
試劑:98.2%溴氰菊酯原藥,購自江蘇農博生物科技有限公司;二甲基亞砜(DMSO),購自上海凌峰化學試劑有限公司;RNA提取試劑盒RNAprep Pure Micro Kit(TIANGEN,Beijing,China);反轉錄試劑盒ReverTra Ace qPCR PT Kit(TOYOBO,Tokyo,Japan);實時熒光定量PCR試劑盒ChamQ Universal SYBR qPCR Master Mix (Vazyme,Q711-02).
1.2 受試材料
供試魚種為稀有鮈鯽(Gobiocypris rarus),品種為封閉群IHB.種魚購自中國科學院水生生物研究所,引入批號為稀有鮈鯽20180728,從該批次的養殖群體中選擇健康、體表無損傷、體質健壯的成魚為親魚,飼養在實驗室內循環養殖系統中14d,溫度(25±2)°C,每天14h光照,溶解氧大于空氣飽和濃度的60%,每日定時投喂豐年蟲2次(08:00、16:00).
將雌雄親魚以1:1比例配對,每日觀察雌雄魚的行為,當觀察到雄魚追逐雌魚時,將雌雄魚撈出,人工受精方式獲取受精卵.試驗開始前在顯微鏡下隨機抽樣觀察,確認本批受精卵處于單細胞期.
試驗用水為曝氣處理24h以上的除氯自來水,水溫為(25±1)°C,pH值控制在6.5~7.5,光/暗比為14h/10h,溶解氧360%,水質硬度為145.0mg/L(以CaCO3計).
1.3 暴露實驗方法
1.3.1 試驗藥液配制 準確稱取0.0509g 98.2%溴氰菊酯原藥,加10.0mL DMSO,用試驗用水溶解并定容至500mL,得到濃度為100.0mg/L溴氰菊酯貯備溶液.使用時將貯備溶液分別稀釋為1.0mg/L和100.0μg/L的稀釋溶液,再進一步稀釋為各暴露組溶液.吸取100.0μL DMSO,用試驗用水稀釋定容至1.0L,得到濃度為0.1mL/L的溶劑對照組.受試物溶液每隔72h更新一次,受試物溶液體積1L.
1.3.2 魚類早期生命階段毒性試驗 根據稀有鮈鯽幼魚(受精卵孵出后1月齡)急性毒性預試驗結果,將早期生命階段毒性試驗試驗處理組濃度分別設置為0.04,0.11,0.33,1.0,3.0μg/L,同時設置不含受試物的空白對照組和一組二甲基亞砜(DMSO)溶劑對照組.受試溶液穩定性測試結果表明,在半靜態試驗條件(換水頻率為72h)下,試驗過程中受試物濃度的變化小于初始測試濃度的±20%,符合半靜態試驗質控要求,因此試驗采用半靜態試驗法.
試驗期間,受試溶液體積為1L,容器內溶液的負荷率不超過5g/L.每一濃度處理組和對照組90粒卵,分為3個平行.魚卵受精后開始試驗,在胚盤開始分裂前將胚胎浸在試驗溶液中.試驗期限:孵育期3d,孵出后28d,共計31d.光暗比為14h:10h,溫度24.2~ 25.8°C,溶解氧81.8%~96.8%.親魚飼喂豐年蝦,剛出生仔魚飼喂草履蟲,幼魚飼喂孵出48h的鹵蟲幼體.第一次仔魚飼喂在產卵后第6d開始.在每次更換試驗液時清理試驗容器.試驗期間,記錄胚胎孵化情況,每24h觀察記錄胚胎及幼魚畸形、死亡情況,并清理死亡胚胎和幼魚.
1.4 熒光定量PCR實驗方法
暴露31d后,用液氮速凍各處理濃度組和對照組稀有鮈鯽幼魚并提取魚體總RNA.按照RNA提取試劑盒說明書提取暴露31d后幼魚的總RNA,用核酸蛋白質儀測定RNA的濃度和純化質量,再按照反轉錄試劑盒說明書對RNA進行反轉錄,得到互補DNA(cDNA).最后按照實時熒光定量PCR試劑盒說明書在冰上配制20μL反應體系,反應程序:95°C預變性30s;95°C 10s,60°C 30s,共40個循環;融解曲線采集程序使用儀器默認的采集程序.所用基因引物序列如表1.

表1 實時熒光定量PCR引物序列
1.5 數據處理
相對基因表達量采用2-ΔΔCt法進行計算,其中ΔΔCt由公式(1)計算得到:
ΔΔCt=(Cttarget-Ctactin)·t-(Cttarget-Ctactin)·0(1)
式中:Ct表示循環閾值;Cttarget表示目標基因的Ct值;Ctactin表示內參基因的Ct值;t代表任意時間點;0表示經β-actin基因校正后1倍量的目標基因表達.
在滿足正態分布和方差齊性的前提條件下,采用單因素方差分析法(One-way ANOVO)和最小顯著性檢驗法(LSD)分析處理組和對照組之間的差異顯著性(<0.05為差異顯著,用*表示),否則采用非參數檢驗來檢驗組間差異的顯著性,結果以平均值±標準誤(SE)表示.用Origin 9.1軟件作圖.
2 結果與分析
2.1 溴氰菊酯對稀有鮈鯽胚胎孵化和仔魚發育影響
稀有鮈鯽胚胎孵出48~72h后逐漸孵化,到96h孵化全部完成,各濃度處理組孵化率與對照組的孵化率不存在顯著性差異,所以0.04~3.0μg/L的溴氰菊酯對稀有鮈鯽的孵化無顯著影響.如圖1所示,3.0μg/L濃度組4~5d時,孵化出的仔魚開始出現畸形,可以觀察到的畸形終點指標包括仔魚軀體彎曲和體軸彎曲等;1.0μg/L濃度組6~7d時,孵化出的仔魚開始出現畸形,可以觀察到的畸形終點指標包括卵黃囊水腫和尾部彎曲(144h),以及心包水腫(168h)等;其余濃度組基本未出現仔魚畸形的情況.從第10d開始,畸形的仔魚開始死亡,故統計了4~9d各濃度組的畸形率變化情況,結果見圖2.與對照組相比,1.0和3.0μg/L濃度組的稀有鮈鯽畸形率隨暴露時間延長而顯著升高,而暴露在其它幾組較低的濃度組的仔魚相比對照組則無顯著差異.
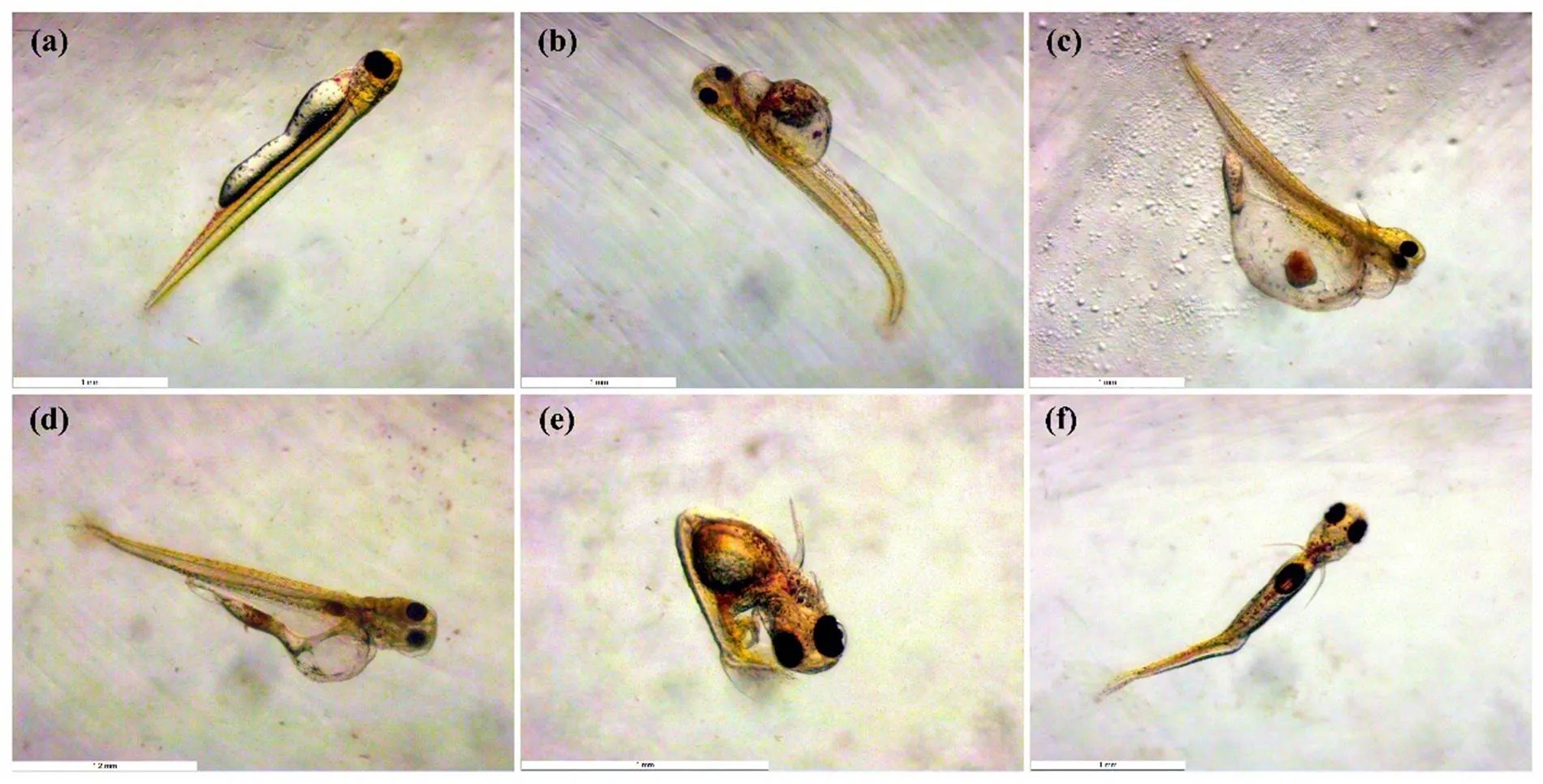
圖1 溴氰菊酯暴露對稀有鮈鯽仔魚的致畸效應
A為正常仔魚(CK,144h);B為卵黃囊水腫、尾部彎曲(1.0μg/L,144h);C為卵黃囊水腫(1.0μg/L,168h);D為心包水腫(1.0μg/L,168h);E為軀體彎曲(3.0μg/L,144h);F為體軸彎曲(3.0μg/L,144h)
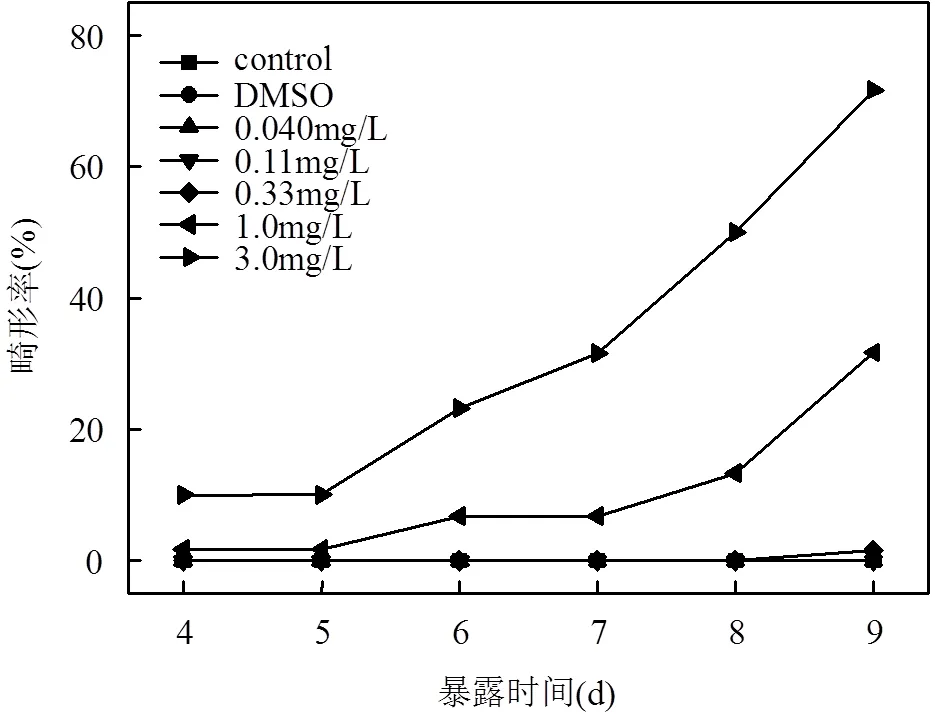
圖2 溴氰菊酯對稀有鮈鯽畸形率的影響
2.2 溴氰菊酯對稀有鮈鯽幼魚死亡率影響
1.0與3.0μg/L濃度組的稀有鮈鯽在暴露第9d時出現數量較多的畸形,死亡率結果如圖3所示,從第10d開始,畸形的仔魚開始死亡,到第13d時,1.0與3.0μg/L濃度組的稀有鮈鯽仔魚基本全部死亡.試驗結束后,對31d各暴露組稀有鮈鯽死亡率做了統計,結果顯示,除1.0和3.0μg/L濃度組外,暴露在其它幾組較低濃度組的仔魚死亡率相比對照組無顯著性差異.綜合發育與死亡終點指標,溴氰菊酯對稀有鮈鯽的LOEC(最低可觀察效應濃度)為1.0μg/L,NOEC (無可觀察效應濃度)為0.33μg/L.
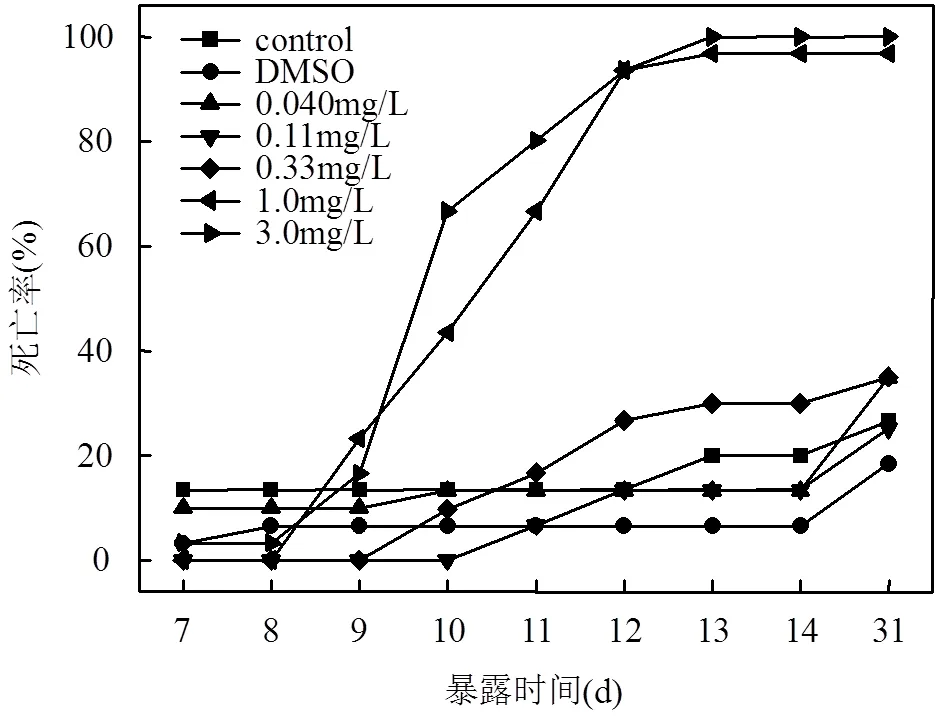
圖3 溴氰菊酯暴露對稀有鮈鯽仔魚死亡率影響
2.3 溴氰菊酯對稀有鮈鯽幼魚性激素受體基因表達的影響
選取雄激素受體(AR)和雌激素受體(ERs)作為溴氰菊酯對稀有鮈鯽幼魚發育過程中的生殖內分泌干擾機制的研究對象.如圖4所示,在經溴氰菊酯暴露31d后,各濃度組稀有鮈鯽幼魚體內AR基因的相對表達量與對照組相比均顯著下降,分別為對照組的0.77倍、0.65倍、0.37倍(數值分別對應0.04, 0.11,0.33μg/L濃度組).測定溴氰菊酯對稀有鮈鯽幼魚發育過程中體內ERs表達情況,結果表明,0.11, 0.33μg/ L濃度組稀有鮈鯽幼魚體內ER1、ER2b基因的相對表達量與對照組相比均顯著下降,分別為0.69、0.42倍(0.11μg/L組別)和0.74、0.50倍(0.33μg/ L組別),而0.04μg/L濃度組稀有鮈鯽幼魚體內ER1、ER2b基因的相對表達量與對照組相比無顯著差異.各濃度組溴氰菊酯對ER2a基因的相對表達量無顯著影響.
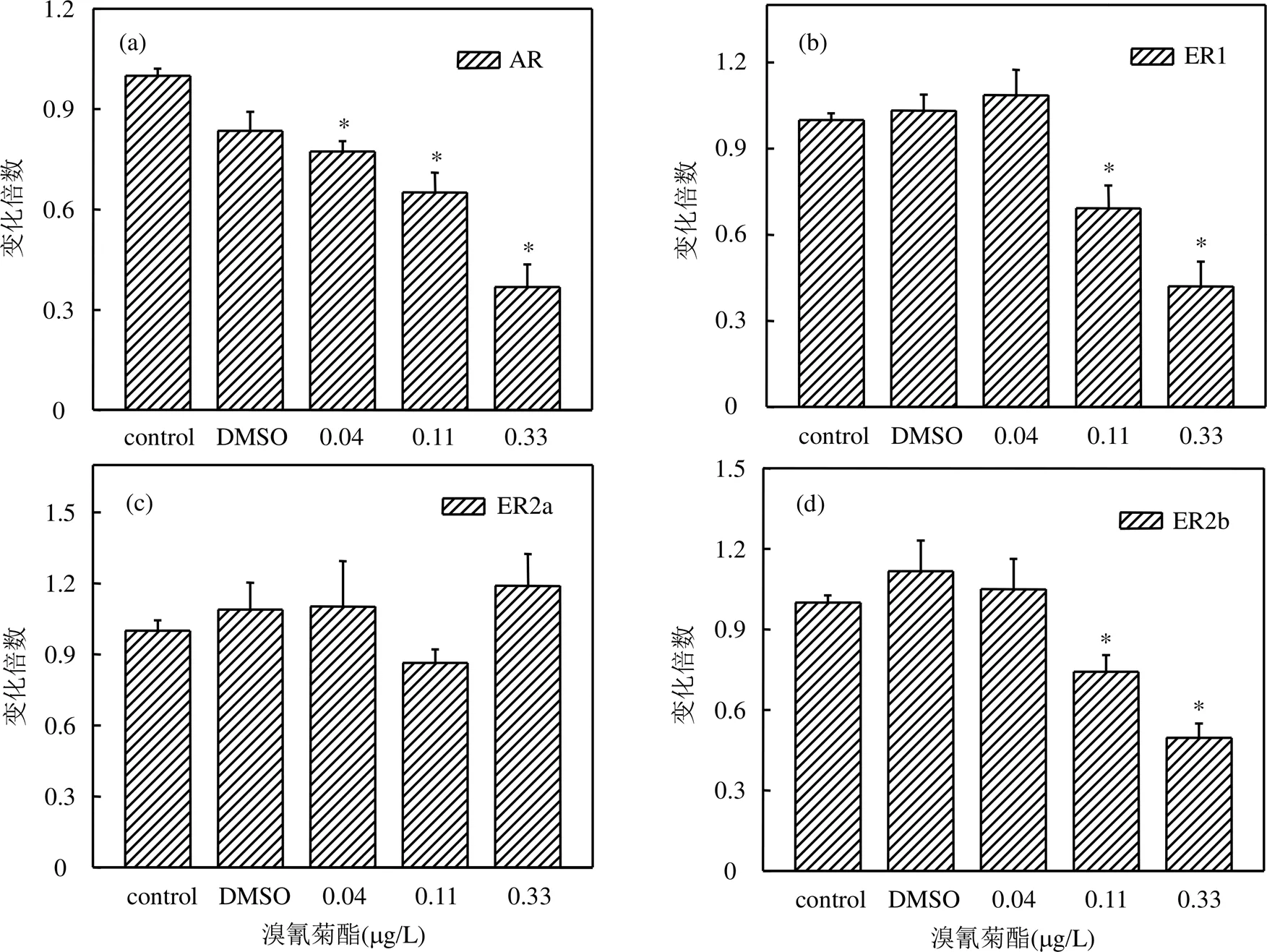
圖4 溴氰菊酯對稀有鮈鯽幼魚性激素受體基因表達影響
2.4 溴氰菊酯對稀有鮈鯽幼魚甲狀腺激素受體基因表達的影響
通過溴氰菊酯暴露后稀有鮈鯽幼魚體內甲狀腺激素受體TRα和TRβ基因的表達情況,分析溴氰菊酯對稀有鮈鯽幼魚甲狀腺干擾效應.如圖5所示,在經溴氰菊酯暴露31d后,各濃度組稀有鮈鯽幼魚體內TRβ基因的相對表達量與對照組相比均顯著上升,分別為對照組的2.66倍、3.07倍、4.41倍(數值分別對應0.04,0.11,0.33μg/L濃度組),而各濃度組溴氰菊酯對TRα基因的相對表達量無顯著影響.

圖5 溴氰菊酯對稀有鮈鯽幼魚甲狀腺激素受體基因表達影響
2.5 溴氰菊酯對稀有鮈鯽幼魚芳香烴受體基因表達的影響
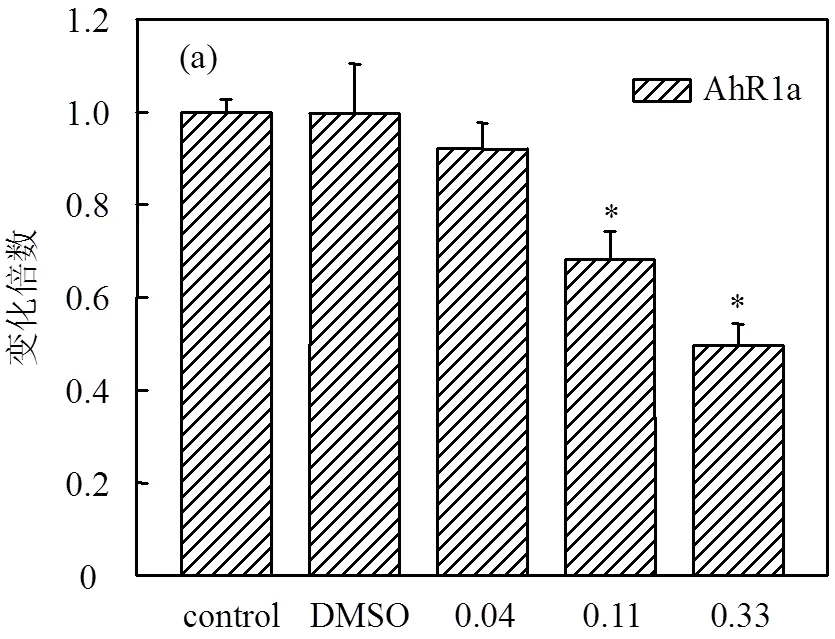
通過溴氰菊酯暴露后稀有鮈鯽幼魚發育過程中體內芳香烴受體基因AhRs表達情況,分析稀有鮈鯽暴露溴氰菊酯后芳香烴受體介導毒性反應的影響.如圖6所示,0.11和0.33μg/L濃度組稀有鮈鯽幼魚體內AhR1a基因的相對表達量與對照組相比均顯著下降,下降程度分別為0.68倍和0.50倍;而0.04μg/L濃度組稀有鮈鯽幼魚體內AhR1a基因的相對表達量與對照組相比無顯著差異.0.33μg/L濃度組稀有鮈鯽幼魚體內AhR1b基因和AhR2基因的相對表達量與對照組相比均顯著下降,分別為0.44倍和0.59倍,而0.04和0.11μg/L濃度組稀有鮈鯽幼魚體內AhR1b、AhR2基因的相對表達量與對照組相比均無顯著差異.
3 討論
擬除蟲菊酯類農藥是繼有機氯、有機磷農藥和氨基甲酸酯之后的第三代農藥,具有高效廣譜,對哺乳動物低毒和低殘留的優點,在農業中得到了廣泛的應用,且其使用量逐年增加.其中,溴氰菊酯是最常見的擬除蟲菊酯類農藥品種.擬除蟲菊酯類農藥進入水環境的方式有3種,一種是施于農田的農藥通過沉降及地表徑流等方式進入水體環境中[22];一種是由于農藥的不恰當使用,如在魚類養殖時使用擬除蟲菊酯類農藥進行清塘工作,使其直接進入養殖水體中;還有一種是活性成分隨人類使用的蚊香、驅蚊水殘渣隨生活污水進入水體.近年來,由于擬除蟲菊酯農藥的廣泛應用,世界上越來越多的水體環境中檢測到擬除蟲菊酯類農藥的存在[4–6].此外,國內九龍江口[7]、官廳水庫[8]、梁灘河流域[9]和珠江三角河網[10]等水體環境中也均有擬除蟲菊酯類農藥的檢出,其中溴氰菊酯檢出濃度范圍為ND~106.3ng/L.由于溴氰菊酯等農藥對水生生物具有較高的毒性,水環境中殘存的溴氰菊酯可能會對魚類造成不利影響.已有研究表明,斑馬魚幼魚在溴氰菊酯脅迫下出現體長縮短、頭眼面積減小和孵化率增加等現象,其頭部、身體、心臟和尾部區域產生不同程度的凋亡,溴氰菊酯顯著誘導血管內皮生長因子flk1和fli-1以及心肌發育相關基因myl7呈劑量依賴性下降,增加了斑馬魚幼魚的趨觸性行為,引起了類似焦慮的行為[23].暴露在溴氰菊酯中的鰱魚出現不同程度的行為失調,肝、鰓、腦、肌肉組織中總蛋白含量顯著降低,全身皮質醇和血糖水平顯著升高[24].最近的研究還發現,20和40μg/L的溴氰菊酯處理顯著阻礙了斑馬魚胚胎魚鰾前體細胞和組織層的形成,因此損害了斑馬魚魚鰾的發育[19].目前對環境濃度范圍該類農藥是否能引起魚類的發育和內分泌干擾毒性方面的研究還相對較少.本研究將處于早期生命階段的稀有鮈鯽胚胎暴露于0.04~3.0μg/L的溴氰菊酯溶液中,發現考察濃度范圍內溴氰菊酯對稀有鮈鯽胚胎的孵化無顯著影響(LOEC>3.0μg/L),但暴露于1.0和3.0μg/L的溴氰菊酯溶液7~9d后,大量仔魚出現畸形癥狀,暴露31d后的幼魚死亡率分別為96.7%和100%,綜合來看,影響稀有鮈鯽仔魚發育畸形和死亡指標的LOEC和NOEC分別為1.0和0.33μg/L.由此可見0.33~1.0μg/L濃度水平的溴氰菊酯水環境賦存濃度可能會對水生魚類幼體造成畸形和死亡風險.從內分泌干擾終點指標(性激素受體基因表達和甲狀腺激素受體基因表達)來看,低至0.04μg/L的溴氰菊酯濃度已經對稀有鮈鯽幼魚內分泌指標造成了干擾,而該濃度水平已處在當下諸多天然水體的檢出濃度范圍,這需引起重視.
性激素受體包括雄激素受體(AR)和雌激素受體(ERs),本研究選取這兩類受體基因作為溴氰菊酯對稀有鮈鯽幼魚發育過程中的生殖內分泌干擾效應的研究對象.AR和ERs通常在魚類的性腺和腦中表達,屬于核受體超家族成員之一[25].現有研究表明,一些化合物會影響性激素核受體的表達,從而對水生生物造成類雌激素效應.例如,有機氯農藥會與靶細胞上的雌激素結合,對內源性雌激素造成影響[26].擬除蟲菊酯類農藥對生殖內分泌的干擾機制可能包括對性激素合成和代謝干擾、類雌激素效應、抗雄激素效應等.現有的擬除蟲菊酯類農藥干擾類雌激素和抗雄激素活性的研究表明,對于雄激素受體基因,高效氯氟氰菊酯、氰戊菊酯和氯菊酯暴露均會抑制斑馬魚幼魚體內AR的表達,表現出一定的抗雄激素效應;對于雌激素受體基因,高效氯氟氰菊酯暴露會上調斑馬魚幼魚體內ER1的表達,下調ER2a的表達,氰戊菊酯暴露會上調ER1的表達,氯菊酯暴露會上調ER2a、ER2b的表達[27].類似的,本研究從基因水平上對比分析溴氰菊酯對稀有鮈鯽幼魚發育中性激素受體基因的影響,也發現溴氰菊酯對雄激素受體基因和雌激素受體基因均存在抑制作用,且對AR基因表達的抑制作用要高于ERs基因(表現在抑制ER1、ER2b基因的表達).
甲狀腺激素受體基因(TR)屬于核受體超家族,主要包含TRα和TRβ兩種基因,對于機體的正常分化發育和維持調控體內代謝平衡等多個方面具有重要作用.其中,TRα在機體中的主要功能是調節機體生長發育、維持甲狀腺功能;TRβ在機體中的主要功能是增加T3的敏感性,維持甲狀腺激素TH對促甲狀腺素TSH的負反饋[28–30].甲狀腺激素能影響魚類胚胎向幼魚的轉變,所以,魚類的生長發育離不開甲狀腺激素的作用.多個研究證明內分泌干擾物可以干擾魚類體內甲狀腺系統的循環調節,影響甲狀腺的功能,如添加型阻燃劑六溴環十二烷對斑馬魚體內T3和T4具有明顯抑制作用,隨著其暴露濃度的增加,T3和T4的含量水平呈現下降趨勢[31];納米氧化銅會損傷甲狀腺濾泡結構,改變上皮細胞形態,誘導甲狀腺激素T3和T4上升,造成代謝酶編碼基因ugt1ab表達的下調[32];多氯聯苯暴露會引起褐牙鲆幼魚甲狀腺濾泡細胞出現明顯的增生以及膠質缺損現象,并造成血漿甲狀腺激素水平顯著下降[33].本研究結果表明,0.04μg/L的溴氰菊酯暴露便會通過干擾稀有鮈鯽幼魚TRβ基因的表達,對稀有鮈鯽幼魚的甲狀腺系統產生干擾效應.本研究從基因層面上豐富了溴氰菊酯對稀有鮈鯽體內甲狀腺干擾作用機制的研究,然而,擬除蟲菊酯對甲狀腺系統的具體調控機制還有待進一步補充研究.
芳香烴受體基因(AhRs)作為一種配體誘導的轉錄因子,可以協助維持免疫系統的正常運行. AhRs能誘導CYP1A1和CYP1A2表達,參與輻射、感染、炎癥和氧化應激等應激刺激,介導多種細胞毒性反應和重要的生物學過程,如信號轉導、細胞分化、細胞凋亡、腫瘤演進、生長發育和再生等[34-35].外源污染物會影響哺乳動物芳香烴受體基因的表達,根據已有的擬除蟲菊酯類農藥的研究,聯苯菊酯和功夫菊酯暴露均會影響大鼠CYP1A的表達,從而影響其氧化代謝功能[36].已有研究表明,某些外源性污染物也會影響魚類芳香烴受體的表達,對魚類的氧化代謝造成干擾,如低劑量三唑錫對雌性斑馬魚暴露處理后可抑制卵巢芳香化酶基因的表達,而高劑量組則促進了芳香化酶基因的表達,此外,各濃度組三唑錫均顯著抑制雄性斑馬魚精巢芳香化酶基因的表達[37];類二噁英多氯聯苯(PCB126)能明顯誘導斑馬魚胚胎EROD活性及CYP1A基因mRNA相對表達量,呈現出明顯的劑量-效應關系[38].CYP對氯菊酯的代謝具有保護作用[39],而氯氰菊酯可以介導斑馬魚幼魚和成魚體內CYP酶的轉錄水平和催化活性[40].本研究結果表明,0.11μg/L的溴氰菊酯暴露便開始干擾稀有鮈鯽幼魚AhRs基因的表達,從而影響體內CYP的表達,對稀有鮈鯽幼魚的代謝水平產生影響.
4 結論
4.1 考察濃度范圍內的溴氰菊酯暴露對稀有鮈鯽胚胎的孵化無顯著影響(LOEC>3.0μg/L),但1.0和3.0μg/L的溴氰菊酯暴露7~9d可以誘導稀有鮈鯽仔魚發育出現顯著的畸形,包括軀體彎曲、體軸彎曲和卵黃囊水腫等癥狀.綜合早期生命階段稀有鮈鯽的發育和死亡毒性終點,溴氰菊酯對其LOEC=1.0μg/L, NOEC=0.33μg/L.
4.2 低至0.04μg/L的溴氰菊酯暴露31d可以影響稀有鮈鯽幼魚性激素受體基因表達和甲狀腺激素受體基因表達,從而干擾魚類生殖系統和甲狀腺系統.其中,溴氰菊酯對其雄激素受體基因和雌激素受體基因均存在抑制作用,且對AR基因表達的抑制作用要高于ERs基因;溴氰菊酯通過干擾稀有鮈鯽幼魚TRβ基因的表達對其甲狀腺系統產生干擾效應.
4.3 0.11~0.33μg/L的溴氰菊酯暴露通過下調稀有鮈鯽幼魚芳香烴受體基因(AhR1a、AhR1b、AhR2)表達量,從而影響體內CYP的表達,對稀有鮈鯽幼魚的代謝水平產生影響.
[1] Sharma D, Ansari B. Effect of the synthetic pyrethroid Deltamethrin and the neem-based pesticide Achook on the reproductive ability of zebrafish, Danio rerio (Cyprinidae) [J]. Archives of Polish Fisheries, 2010,18(3):157-161.
[2] Zheng J, Yu Y, Feng W, et al. Influence of nanomolar deltamethrin on the hallmarks of primary cultured cortical neuronal network and the role of ryanodine receptors [J]. Environmental Health Perspectives, 2019,127(6):067003.
[3] 韓耀宗,朱國念,廖曉蘭,等.擬除蟲菊酯農藥的毒性研究綜述[J]. 世界農藥, 2008,30(3):34-35.
Han Y Z, Zhu G N, Liao X L, et al. Review on toxicity of pyrethroid pesticides [J]. World Pesticides, 2008,30(3):34-35.
[4] Weston D P, Lydy R J. Urban and agricultural sources of pyrethroid insecticides to the Sacramento-San Joaquin Delta of California [J]. Environmental Science & Technology, 2010,44(5):1833-1840.
[5] Vryzas Z, Alexoudis C, Vassiliou G, et al. Determination and aquatic risk assessment of pesticide residues in riparian drainage canals in northeastern Greece [J]. Ecotoxicology and Environmental Safety, 2011,74(2):174-181.
[6] Feo M L, Ginebreda A, Eljarrat E, et al. Presence of pyrethroid pesticides in water and sediments of Ebro River Delta [J]. Journal of Hydrology, 2010,393(3/4):156-162
[7] 黃群騰.水環境中36種農藥殘留的同時分析方法及其應用[D]. 廈門:廈門大學, 2008.
Huang Q T. Simultaneously determination method for 36 pesticides in aquatic environment and its application [D]. Xiamen: Xiamen University, 2008.
[8] Xue N, Xu X, Jin Z. Screening 31endocrine-disrupting pesticides in water and surface sediment samples from Beijing Guanting reservoir [J]. Chemosphere, 2005,61(11):1594-1606.
[9] 龔得春.梁灘河流域擬除蟲菊酯農藥多介質殘留和環境行為研究[D]. 重慶:重慶大學, 2013.
Gong D C. Pyrethroids pesticides residues and thier behavior in a multimedium environment of Liangtan River basin [D]. Chongqing: Chongqing Universtiy, 2013.
[10] 趙李娜.珠三角河網水環境中7種擬除蟲菊酯類農藥殘留及風險評價研究[D]. 上海:上海海洋大學, 2014.
Zhao L N. Residue and risk assessment of 7kinds of pyrethroids in water environment in the Pearl River Delta [D]. Shanghai: Shanghai Ocean University, 2014.
[11] 修瑞琴,高世榮,許永香.大型溞生物測試法對農藥溴氰菊酯的毒性評價[J]. 衛生毒理學雜志, 1990,(3):15-17,68.
Xiu R Q, Gao S R, Xu Y X. Studies on toxicity of new pesticide deltamethrin water flea Daphnia Magna Straus [J]. Journal of Health Toxicology, 1990,(3):15-17,68.
[12] 周冬仁,盛鵬程,孫博弈,等.氰戊菊酯與溴氰菊酯對凡納對蝦的急性毒性 [J]. 貴州農業科學, 2018,46(7):103-105.
Zhou D R, Sheng P C, Sun B Y, et al. Acute toxicity of fenvalerate and deltamethrin to Penaeus vannamei [J]. Guizhou Agricultural Sciences, 2018,46(7):103-105.
[13] 林 崗,張 倩,饒小珍.吡喹酮、甲苯咪唑、溴氰菊酯對花鰻鱺的急性毒性 [J]. 海洋漁業, 2011,33(4):467-471.
Lin G, Zhang Q, Rao X Z. Acute toxicity of praziquantel, mebendazole and deitamethrin on marbled eel[J]. Marine Fisheries, 2011,33(4):467-471.
[14] 孟立霞,張文華,潘 娟,等.甲氰菊酯和溴氰菊酯對黔東南田魚(鯉)的急性毒性與安全評價[J]. 安徽農業科學, 2011,39(17):10301- 10302.
Meng L X, Zhang W H, Pan J, et al. Acute toxicity and safety evaluation of fenpropathrin and deltamethrin on field fish of Southeast Guizhou [J]. Journal of Anhui Agricultural Sciences, 2011,39(17): 10301-10302.
[15] 鄭盛華,楊妙峰,鄭惠東,等.聯苯菊酯和醚菊酯對真鯛的急性毒性和安全性評價 [J]. 安徽農業科學, 2017,45(29):86-88.
Zheng S H, Yang M F, Zheng H D, et al. Acute toxicity and safety evaluation of bifenthrin and ethofenprox on Pagrosomus major [J]. Journal of Anhui Agricultural Sciences, 2017,45(29):86-88.
[16] 魏 華,吳 楠,沈 竑,等.溴氰菊酯對克氏原螯蝦的氧化脅迫效應[J]. 水產學報, 2010,34(5):733-739.
Wei H, Wu N, Shen H, et al. Oxidative stress of deltamethrin to the liver of crayfish () [J]. Journal of Fishries of China, 2010,34(5):733-739.
[17] 洪宇航.溴氰菊酯對中華絨螯蟹主要免疫指標的影響[J]. 廣東農業科學, 2017,44(3):151-157.
Hong Y H. Effects of deltamethrin on main immune parameters of Chinese mitten crab,[J]. Guangdong Agricultural Sciences, 2017,44(3):151-157.
[18] 洪宇航,黃 毅.溴氰菊酯對中華絨螯蟹血細胞DNA的損傷[J]. 水產科學, 2018,37(4):544-549.
Hong Y H, Huang Y. Effects of deltamethrin on DNA damage in hemocytes of Chinese mitten handed crab,[J]. Fisheries Science, 2018,37(4):544-549.
[19] Wu Y Q, Li W H, Yuan M R, et al. The synthetic pyrethroid deltamethrin impairs zebrafish () swim bladder development [J]. Science of the Total Environment, 2020,701:134870.
[20] 熊 力,馬永鵬,毛思予,等.五氯酚對稀有鮈鯽胚胎毒性效應研究[J]. 中國環境科學, 2012,32(2):337-344.
Xiong L, Ma Y P, Mao S Y, et al. Toxic effects of pentachlorophenol on the Chinese rare minnow embryos [J]. China Environmental Science, 2012,32(2):337-344.
[21] Zhu B, Liu T Q, Hu X G, et al. Developmental toxicity of 3,4- dichloroaniline on rare minnow () embryos and larvae [J]. Chemosphere, 2013,90:1132-1139.
[22] 趙之德,李海濤,梁 濤.聯苯菊酯等3種殺蟲劑在茶園茶葉、土壤及降雨徑流中的殘留[J]. 中國生態農業學報(中英文), 2019,27(8): 1265-1274.
Zhao Z D, Li H T, Liang T. Residues of three insecticides in tea leaves, soil and rainwater runoff [J]. Chinese Journal of Eco-Agriculture, 2019,27(8):1265-1274.
[23] Li M, Liu X Y, Feng X Z. Cardiovascular toxicity and anxiety-like behavior induced bydeltamethrin in zebrafish () larvae [J]. Chemosphere, 2019,219:155-164.
[24] Ullah S, Li Z Q,UI Arifeen M Z, et al. Multiple biomarkers based appraisal of deltamethrin induced toxicity in silver carp () [J]. Chemosphere, 2019,214:519-533.
[25] Du M, Lin L, Yan C, et al. Enantiomer-specific bioaccumulation and depuration of hexabromocyclododecanes in zebrafish () [J]. Journal of Hazardous Materials, 2013,248-249C(1):167-171.
[26] Filby A L, Ortiz-Zarragoitia M, Tyler C R. The vas:: egfp transgenic zebrafish: a practical model for studies on the molecular mechanisms by which environmental estrogens affect gonadal sex differentiation [J]. Environmental Toxicology and Chemistry, 2014,33(3):602-605.
[27] 杜 潔.擬除蟲菊酯對斑馬魚內分泌平衡及氧化代謝的擾動效應[D]. 杭州:浙江工業大學, 2016.
Du J. Disturbance Effect of pyrethroids on endocrine and xxidative metabolism in zebrafish () [D]. Hangzhou: Zhejiang University of Technology, 2016.
[28] 張 沛,溫海深,遲美麗,等.花鱸三種甲狀腺激素受體(TRs)基因克隆及表達分析[J]. 海洋湖沼通報, 2018,(5):91-99.
Zhang P, Wen H S, Chi M L, et al. Cloning and tissue expression analysis of three thyroid hormones receptor genes of spotted seabass () [J]. Transactions of Oceanology and Limnology, 2018,(5):91-99.
[29] Tang X, Liu X, Zhang Y, et al. Molecular cloning, tissue distribution and expression profiles of thyroid hormone receptors during embryogenesis in orange-spotted grouper () [J]. General & Comparative Endocrinology, 2008,159(2):117-124.
[30] Jugan M L, Levi Y, Blondeau J-P. Endocrine disruptors and thyroid hormone physiology [J]. Biochemical Pharmacology, 2010,79(7): 939-947.
[31] 劉小燕,劉 珊,張麗娟,等.六溴環十二烷對斑馬魚的甲狀腺激素干擾效應研究[J]. 農業環境科學學報, 2017,36(11):2192-2198.
Liu X Y, Liu S, Zhang L J, et al. Thyroid hormone-disrupting effects of hexabromocyclododecane in zebrafish () [J]. Journal of Agro-Environment Science, 2017,36(11):2192-2198.
[32] 王黎曌,薛永來,高 璐,等.納米氧化銅對斑馬魚甲狀腺系統的干擾效應[J]. 江蘇農業科學, 2019,47(14):202-205.
Wang L Z, Xue Y L, Gao L, et al. Interference effect of copper oxide nanoparticles on thyroid system of zebrafish [J]. Jiangsu Agricultural Sciences, 2019,47(14):202-205.
[33] 董怡飛,田 華,王 蔚,等.多氯聯苯對褐牙鲆仔魚變態及幼魚甲狀腺系統的干擾作用[C]//2016年中國水產學會學術年會論文集, 2016,214-214.
Dong Y F, Tian H, Wang W, et al. Inhibition of larvae metamorphosis and disruption of juvenile fish thyroid system by polychlorinated biphenyls in Japanese flounder () [C]. Proceedings of the 2016 Chinese Fisheries Society Annual Conference, 2016:214-214.
[34] 杜 潔,張 怡,洪盼盼,等.擬除蟲菊酯對斑馬魚氧化代謝相關基因表達影響[J]. 浙江工業大學學報, 2016,(3):334-339.
Du J, Zhang Y, Hong P P, et al. Effects of pyrethroids on the expression of oxidative metabolism related nuclear receptor genes in zebrafish [J]. Journal of Zhejiang University of Technology, 2016, (3):334-339.
[35] 薄 軍,吳世軍,李裕紅,等.苯并[a]芘(BaP)對真鯛細胞色素P450和芳香烴受體基因表達的影響[J]. 中山大學學報(自然科學版), 2010,(3):98-102.
Bao J, Wu S J, Li Y H, et al. The effects of benzo[a]pyrene(BaP) exposure on the CYP1A1mRNA and AhR2mRNA expression of red seabream () [J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2010,(3):98-102.
[36] Abdou R, Sasaki K, Khalil W, et al. Effects of several pyrethroids on hepatic cytochrome P450 activities in rats [J]. Journal of Veterinary Medical Science, 2010,72(4):425-433.
[37] 馬有寧.三唑錫對斑馬魚生殖內分泌干擾作用及分子機制研究[D]. 杭州:浙江大學, 2016.
Ma Y N. Endocrine disruption by azocyclotin and its potential mechanism in zebrafish () [D]. Hangzhou: Zhejiang University, 2016.
Liu H. Studies on developmental toxicology of dioxin--like PCB126 in zebrafish embryos [D]. Zhanjiang: Guangdong Ocean University, 2012.
[39] Clark B W, Giulio R T D. Fundulus heteroclitus adapted to PAHs are cross-resistant to multiple insecticides [J]. Ecotoxicology, 2012,21(2): 465-474.
[40] Yang Y, Ye X, He B, et al. Cadmium potentiates toxicity of cypermethrin in zebrafish [J]. Environmental Toxicology and Chemistry, 2016,35(2):435-445.
Developmental toxicity and endocrine disrupting effects of deltamethrin on rare minnow () during early life stage.
JIANG Jin-lin*, LYU Jian-wei, CAO Shao-hua, LIU Ren-bin, SHI Jia-qi, LONG Tao, SHAN Zheng-jun
(Key Laboratory of Soil Environmental Management and Pollution Control, Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment, Nanjing 210042, China)., 2022,42(5):2395~2403
The developmental toxicity and endocrine disrupting effects of decamethrin on rare minnow () during early life stage were studied using semi-static water exposure method. The LOEC (lowest observed effect concentration) of decamethrin to the incubation of rare minnow embryo was above 3.0μg/L. The LOEC and NOEC (no observed effect concentration) of decamethrin to the developmental malformations and death indicators were 1.0 and 0.33μg/L, respectively. Exposure to the lowest concentration of decamethrin (0.04μg/L) could significantly down-regulate the expression of androgen receptor gene (AR) and up-regulate the expression of thyroid homone receptor gene (TRβ) in rare minnow larvae. Exposure to 0.11μg/L decamethrin down-regulated the expressions of AR, estrogen receptor genes (ER1, ER2b) and aromatic hydrocarbon receptor gene (AhR1a) in rare minnow larvae, and up-regulated the expressions of TRβ. Exposure to 0.33μg/Ldecamethrin inhibited the expressions of AR, estrogen receptor genes (ER1, ER2b) and aromatic hydrocarbon receptor genes (AhR1a, AhR1b, AhR2), as well as induced the expression of TRβ in rare minnow larvae. Given that these concentration levels have been in the range of detectable decamethrin concentrations in multiple natural water bodies, more attention should be paid to the endocrine disrupting effects of decamethrin on fish.
decamethrin;rare minnow;early life stage;developmental toxicity;endocrine disruption
X171,Q89
A
1000-6923(2022)05-2395-09
姜錦林(1984-),男,浙江溫州人,研究員,博士,主要從事污染生態毒理學和風險評估研究.發表論文40余篇.
2021-10-18
中央級公益性科研院所基本科研業務費資助項目(GYZX220202);國家水體污染控制與治理科技重大專項(2017ZX07602)
* 責任作者, 研究員, jjl@nies.org

