催化氧化除氨氮/錳濾料活性恢復方式優化研究
程 亞,張永志,鄭佳慧,李宇洋,黃廷林
催化氧化除氨氮/錳濾料活性恢復方式優化研究
程 亞,張永志,鄭佳慧,李宇洋,黃廷林*
(西安建筑科技大學環境與市政工程學院,陜西省環境工程重點實驗室,西北水資源與環境生態教育部重點實驗室,陜西 西安 710055)
以催化氧化除氨氮/錳失活濾料為研究對象,考察了3種不同恢復方式(自然恢復,投加堿度,再次掛膜)對濾料催化氧化氨氮、錳效能的影響.結果表明,自然恢復(1#)濾柱,投加堿度(2#)濾柱,再次掛膜(3#)濾柱分別于4,2,3d后氨氮去除率達到90%以上;逐漸提高氨氮濃度,3#再次掛膜濾柱出水氨氮濃度波動最大,1#自然恢復濾柱恢復期間出水亞硝氮積累時間最長且峰值最高.3根濾柱催化氧化去除錳活性恢復速度均較快.1#自然恢復濾柱和2#堿度恢復濾柱均能在2d內將錳完全去除.3#掛膜濾柱是在停止投加高錳酸鉀后5d內實現將進水錳完全去除.氨氮和錳的相互影響實驗結果表明,3根濾柱中投加堿度(2#)濾柱表現最優.盡管氨氮抑制錳的去除,但是投加堿度濾柱隨著進水氨氮濃度的升高出水錳濃度始終低于0.1mg/L;錳對氨氮的去除影響不顯著.XRD分析結果表明,受其表面負載新生成氧化膜的影響,高錳酸鉀重新掛膜濾柱的濾料樣品的結晶度較差.綜合考慮氨氮和錳的活性恢復效率以及掛膜過程中藥品的投加,提出采用自然恢復方式最適.
活性恢復;失活濾料;除氨氮/錳;催化氧化;地下水處理
當前我國地下水的氨氮、錳污染問題日益突出[1-3].由于地下水流動緩慢,更新周期長,一旦受到污染,僅僅依靠其自身完成全部凈化修復幾乎不可能[4-5].且由氨氮、錳造成的地下水污染危害嚴重[6–8].為滿足國家飲用水水質標準和供水保證率不斷提高的要求,防范并應對地下水水質污染的風險,去除氨氮和錳已成為我國水處理行業迫在眉睫的問題[9].
目前,傳統飲用水處理技術難以經濟有效地解決氨氮、錳污染問題[9–11].尤其是當地下水受到氨氮和錳等多重污染時,常規的地下水處理工藝很難將受到多重污染的地下水源水處理達標.當前國內外給水廠常用的除錳方法有化學氧化法[12-13]和生物法[14],常用的去除氨氮的方法有物理化學法[15-16]和微生物法[17].微生物法去除氨氮和錳對環境適應能力差,出水污染物易超標[18].化學氧化去除氨氮和錳的藥劑投加量難以掌握,易生成有毒副產物.而利用沸石的吸附法也存在吸附容量有限的問題.
鐵錳復合氧化物濾料催化氧化除氨氮和錳作為一種新興且卓有成效的新型濾料,可用作自來水廠多種濾池的過濾材料,實現飲用水中氨氮、錳的同步高效去除.鐵錳復合氧化物濾料經氧化還原沉淀法生產完成后,在石英砂濾料表面沉積形成了一種主要成分為O、C、Mn、Fe、Ca、Si的鐵錳復合氧化物,能夠持續、高效的去除水中的氨氮和錳[19-20].但在大規模推廣應用過程中發現,不同儲存方式的鐵錳復合氧化物濾料經過長時間儲存運輸后,濾料的初期催化性能及催化活性恢復會受到不同程度的影響.干式儲存和濕式儲存是目前常用的兩種儲存方法.前期研究了不同儲存條件與不同儲存時間下對氨氮和錳去除性能的影響,結果表明濕式存儲下的濾料較干式存儲方式更易恢復催化活性[21].
前期實驗缺乏對鐵錳復合氧化物濾料催化氧化去除氨氮、錳活性恢復方法系統性研究,也缺少在實際應用過程中可操作條件下的濾料活性恢復研究.因此,本研究針對濕式存放的失活濾料,采用3種恢復方式(自然恢復,投加堿度,再次掛膜)開展了活性恢復方式的優化研究,重點比較了3種恢復方式下濾料催化氧化氨氮、錳效能的變化,以及濾料微觀結構特征的差異,從而確定最佳的恢復方式,為后續工程實踐提供理論依據.
1 材料與方法
1.1 濾料來源
采用氧化還原沉淀法生產的成熟鐵錳復合氧化物濾料[22],生產完成后采用濕式儲存法儲存,即不進行干燥,直接將濕濾料密封保存.本研究中3根濾柱所使用的濾料均是使用該種方法保存40d的濾料.
1.2 實驗裝置
中試系統中濾柱材質為有機玻璃,內徑為 100mm,濾料填充高度為1.2m,由粒徑為 0.75~ 1.2mm 的石英砂填充.如圖1所示.濾柱沿程有6個取樣口,分別位于濾料上表面由上到下 0, 10, 20, 40, 70, 100cm處.

圖1 中試系統流程
1.3 實驗水質
本實驗采用西安市某地下水廠進水,其水質參數見表1.

表1 水廠地下水水質參數
1.4 實驗方法
實驗過程中采用3組完全相同濾柱系統,分別為濾柱1#、2#、3#,具體運行方式如下:1#為自然恢復濾柱,持續投加氨氮以及錳進行運行恢復;2#濾柱為投加堿度恢復濾柱,除投加氨氮和錳外,還持續投加碳酸氫鈉,將堿度提高100mg/L(以CaCO3計)進行恢復;3#濾柱為再次掛膜濾柱,投加氨氮、氯化錳(0.3mg/L Mn2+)和高錳酸鉀(按與氯化錳完全反應的90%投加),反應生成氧化物隨原水進入濾柱,經過濾后,被截留從而沉積在濾料的表面,從而實現再次掛膜,運行21d停止掛膜.在運行的前10d,保持3根濾柱進水氨氮濃度均為0.5mg/L,1#、2#錳濃度均為0.3mg/L,3#濾柱在投加高錳酸鉀掛膜階段,進水均檢測不到錳.后期依據去除效果,逐漸提高濾柱進水氨氮(0.5~2.5mg/L)、錳濃度(0.3~2.5mg/L),濾柱采取下向流方式運行,濾速為4m/h,空床接觸時間為15min.
1.5 分析項目及方法
濾柱運行期間,對濾柱進出水三氮(氨氮、硝氮、亞硝氮)和錳進行檢測.檢測不同掛膜時間濾柱沿程氨氮、錳濃度的變化,通過SEM、XRD等微觀表征方法表征不同恢復方式下氧化膜表面形態及晶體結構.
2 結果與討論
2.1 三種恢復方式下濾料去除氨氮和錳效果比較
不同恢復方式下,濾柱進出水三氮(氨氮、硝氮、亞硝氮)隨運行時間的變化規律如圖2(a),(b),(c)所示.由圖2(a)可知,在0~10d,氨氮進水為0.5mg/L, 1#自然恢復濾柱氨氮去除率在4d內由35.5%升高至90%;2#堿度恢復濾柱去除率在2d內由50%升高至90%;3#重新掛膜濾柱去除率在3d內由49%升高至90%,恢復速度呈現:2#堿度恢復>3#重新掛膜>1#自然恢復.
而后,在逐漸提高氨氮濃度的過程中發現,3#重新掛膜濾柱的出水氨氮濃度波動最大,意味著該恢復方式濾柱活性較差.通過對硝氮(圖2(b))、亞硝氮(圖2(c))的檢測結果發現,在10~20d期間3根濾柱均出現了出水亞硝氮升高現象,且1#自然恢復濾柱亞硝氮的積累時間最長以及峰值均最明顯,但是在10~20d期間3根濾柱亞硝氮濃度迅速降低,硝氮濃度迅速升高,氨氮大部分轉化為了硝氮.這與鐵錳復合氧化物催化氧化氨氮的機理(①NH4+吸附;②鐵錳復合氧化物催化氧化NH4+;③生成產物,如NO3-)相一致[22].
進一步比較不同運行時間(5,10,20d) 3根濾柱沿程去除氨氮的效果變化,結果如圖2(d)所示.由盡管在運行第5d時, 3根濾柱的去除率均達到了100%,但3根濾柱沿程的氨氮去除能力卻呈現出一定的差異,濾柱沿程去除能力呈現:1#自然恢復>2#堿度恢復>3#重新掛膜.
運行到第10d,濾柱進水氨氮濃度提高至1mg/L, 3根濾柱沿程去除氨氮能力出現顯著差異,1#自然恢復濾柱性能最優,且該濾柱在此階段活性得到明顯的提升;到第20d氨氮濃度提高至1.5mg/L,此時3根濾柱沿程除氨氮能力基本一致,意味著2#堿度濾柱和3#重新掛膜濾柱在此期間去除氨氮能力得到了明顯提高.濾柱沿程去除效率越高,說明濾柱去除氨氮活性恢復越好.因此,總體上看濾柱氨氮去除能力恢復速率:1#自然恢復濾柱>2#堿度濾柱>3#重新掛膜.

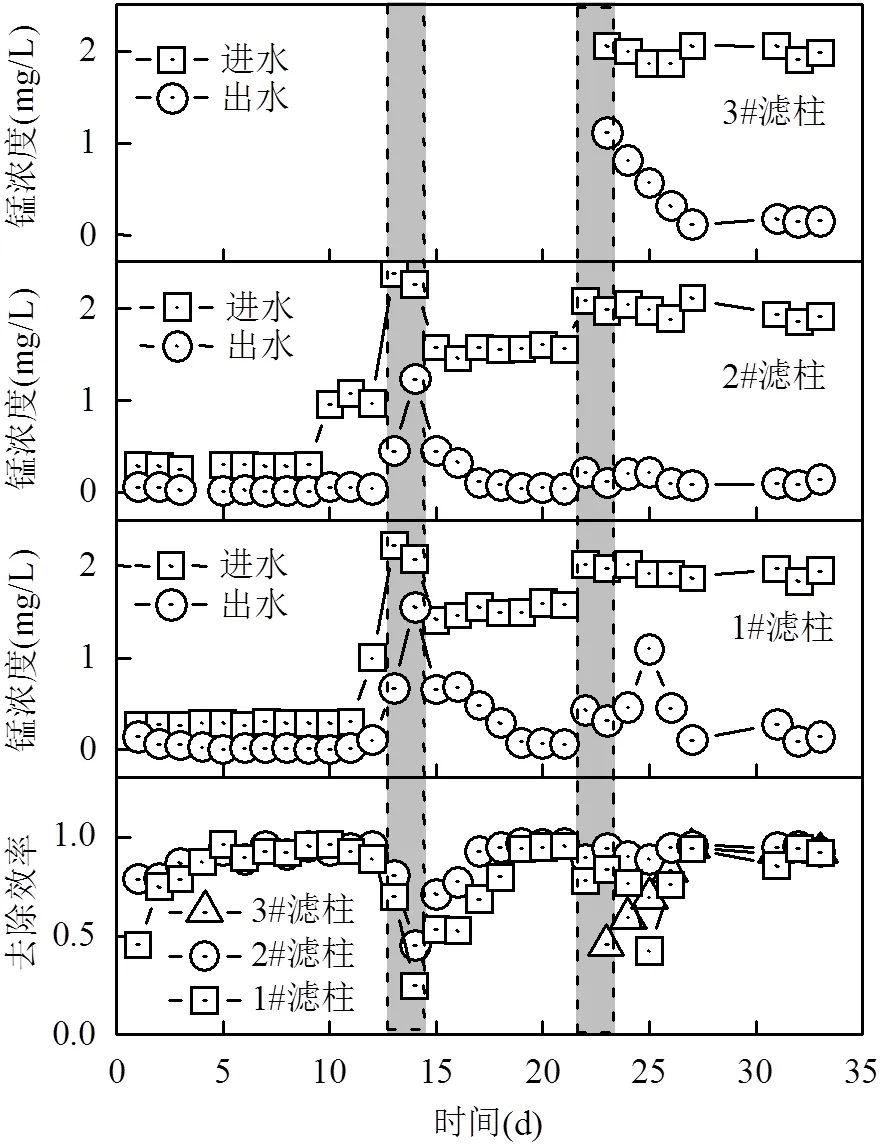
圖3 濾柱進出水錳隨運行時間變化
不同恢復方式下,濾柱進出水錳隨運行時間的變化規律如圖3所示.由圖3可知,在0~10d,錳進水濃度為0.3mg/L,1#自然恢復濾柱和2#堿度恢復濾柱均能在2d內將錳完全去除.后續運行過程中,進水錳濃度逐漸提高至1.5mg/L后,1#自然恢復濾柱和2#濾柱在5d內出水錳濃度就能穩定在0.1mg/L以下.在第21d, 3根濾柱進水錳濃度提升至2.0mg/L,2#濾柱出水錳仍能保持<0.1mg/L,而1#濾柱出水錳濃度卻顯著波動,直至第27d出水錳濃度才穩定.因此除錳活性恢復速率2#濾柱>1#濾柱.
3#掛膜濾柱由于需要掛膜21d,是在停止投加高錳酸鉀后5d后才實現將進水錳完全去除,因此3#掛膜濾柱除錳的活性恢復速度最慢. 3種不同恢復方式下,1#和2#濾柱除錳能力恢復速度均較快,3#掛膜濾柱除錳恢復速度最慢.
2.2 氨氮和錳的相互影響實驗
保持進水錳濃度為1mg/L,改變氨氮的進水濃度分別為0, 1.0和2.0mg/L,比較3根濾柱沿程去除錳的效能變化,結果如圖4(a)所示.由實驗結果可知,隨著進水氨氮濃度的提高, 3根濾柱沿程去除錳的能力均出現了顯著的下降,表明氨氮的存在抑制了活性濾料對錳的去除能力.但是,仔細比較發現, 3根濾柱中投加堿度恢復濾柱表現最優,說明堿度的提高顯著促進了鐵錳復合氧化物濾料的活性,這與前期實驗的研究結果相一致[23].盡管2#濾柱沿程去除能力出現一定能力下降,但是濾柱出水錳濃度始終低于0.1mg/L,而其他濾柱當進水氨氮濃度提高時,出水錳均出現了超標現象,表明此時自然恢復濾柱和重新掛膜濾柱的去除錳活性較差.當進水氨氮濃度為1mg/L時,隨著錳濃度的提高,濾柱沿程去除氨氮的效能不變.結合錳催化氧化去除的機理推測,Mn2+與鐵錳復合氧化物上的活性位點結合后被催化氧化生成新的錳氧化物[24],其上有新的活性位點供氨氮反應,因此錳對氨氮的去除沒有影響.而氨氮與鐵錳復合氧化物上的活性位點結合后,不能提供新的活性位點,因此氨氮的存在抑制了活性濾料對錳的去除能力.

2.3 元素組成與形態分析
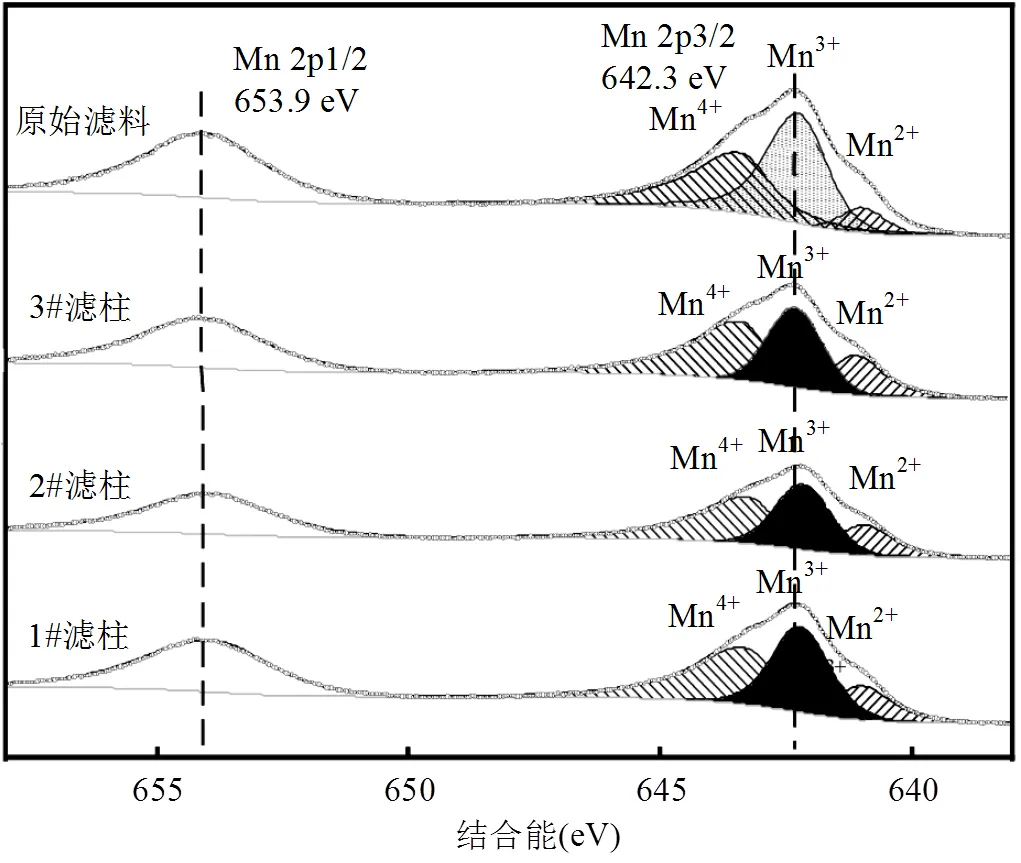
圖5 恢復運行10d后濾料表面錳氧化物Mn2p的XPS光譜
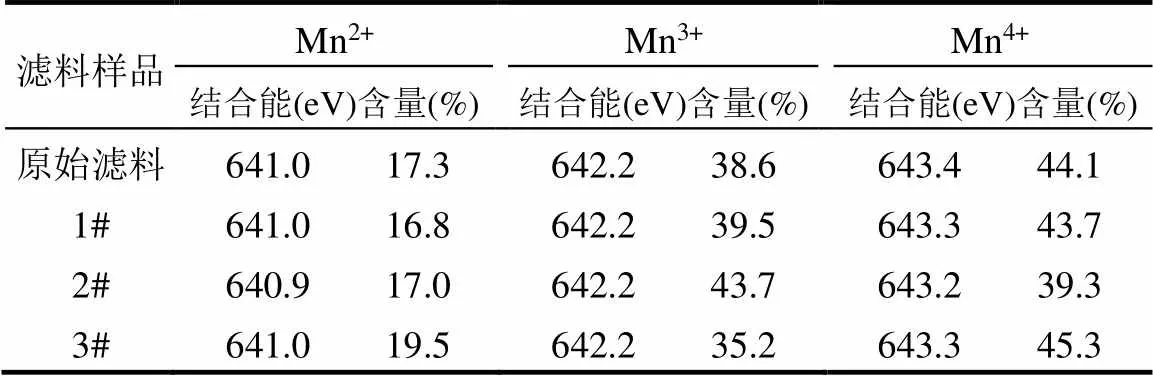
表2 濾料表面氧化物中各價態錳元素含量
采用XPS對原始濾料、自然恢復濾料、堿度恢復濾料以及重新掛膜濾料表面的錳元素價態及含量進行分析.圖5為原始濾料及3根濾柱中樣品的Mn2p光譜,光譜在大約642.3和653.9eV處存在2個主峰,分別對應Mn 2p3/2和Mn 2p1/2峰.4種樣品的Mn 2p3/2峰可以擬合為3個特征峰,分別對應于Mn4+、Mn3+和Mn2+[25-26].表2列出了各價態錳相應的原子比.值得注意的是,1#濾柱樣品中各價態錳的比例與原始濾料相似.2#濾柱樣品的Mn3+含量較高(43.7%),說明堿度恢復有利于Mn3+的生成,這可能證明Mn3+在鐵錳復合氧化物濾料催化氧化氨氮的過程中發揮了關鍵的作用,這與先前的研究結果相一致[24,27].3#濾柱樣品中Mn2+的比例(19.5%)比原始濾料(17.3%)略高,Mn3+和Mn4+比例也相對低,可能是由于3#濾柱重新掛膜后新生成的氧化物中Mn2+較多.
通過濾料表面元素組成可知(表3), 3種不同恢復方式恢復后的濾料表面組成較原始濾料無明顯的變化.表明濾料活性的恢復與元素的組成無顯著關聯.

表3 濾料表面元素組成(%)

圖6 濾料表面形態比較
采用SEM對濾料的表面形態進行分析,結果如圖5所示,原始濾料表面粗糙,由不規則且大小不均勻的顆粒堆積而成(圖6(a));重新掛膜后濾料表面形態未發生明顯變化(圖6(b)),意味著高錳酸鹽重新掛膜生成的氧化物與原始氧化膜無顯著差異;而經堿度恢復濾料表面形態出現了變化,盡管該濾料表面仍粗糙不平,但是顆粒狀較初始濾料不明顯(圖6(c)),這可能是由于投加的堿度與表面氧化膜相互作用影響;經自然恢復濾料表面趨于光滑(圖6(d)).上述研究結果表明,不同恢復條件下運行濾料表面復合錳氧化物形態呈現不同的變化特征.
2.4 XRD分析
為了表征濾料的晶體結構,對3根濾柱不同運行時間的樣品進行了XRD檢測,結果如圖7所示.圖7(a)為恢復10d的3濾柱(R1,R2,R3)中氧化物樣品的XRD譜圖比較,這些XRD譜圖與水鈉錳礦的譜圖較為一致,且表現為低強度的擴散峰[28].但是本文發現,經高錳酸鉀重新掛膜濾柱樣品的譜圖明顯比其他2根濾柱樣品及原始濾料的結晶度更差,這主要是由于高錳酸鉀掛膜新生成了結晶性差的氧化膜負載在濾料表面,而非晶態的結構有利于錳氧化物對污染物的去除[29].此外,還比較了不同運行時間(10,20和35d) 3根濾柱濾料樣品氧化膜晶體結構的特征,結果如圖7(b)、(c)、(d)所示.結果表明,自然恢復濾柱以及堿度恢復濾柱隨運行時間,結晶度基本保持不變,而高錳酸鉀重新掛膜濾柱的濾料樣品的結晶度也沒有發生顯著增強,主要是由于本研究中該濾柱運行至24d停止掛膜,其低結晶度主要受其表面負載新生成氧化膜的影響.由于新生成的氧化膜催化活性有限,因此,采取重新掛膜恢復濾料催化活性的方式在3種濾料恢復方式中表現一般.

結合XPS的分析結果,3#重新掛膜濾柱結晶度更差的原因可能與Mn3+比例的降低,Mn2+的含量較高有關.Mn3+比例的降低也不利于氨氮的催化氧化.而1#和2#濾柱樣品結晶度與原始濾料相差不大的原因可能是1#和2#濾柱樣品中Mn4+、Mn3+和Mn2+的比例相似,Mn3+的比例也相對較高,晶體結構保持較好.綜合比較發現,濾料表面氧化物中Mn3+和Mn2+的比例可能與氧化物的結晶度有所關聯.活性錳氧化物中Mn3+比例越高,Mn2+的比例越低,活性錳氧化物結晶度就越高,有利于催化氧化活性保持;反之,活性錳氧化物中Mn3+比例越低,Mn2+的比例越高,活性錳氧化物結晶度就越差,不利于活性錳氧化物催化氧化活性的保持.
3 結論
3.1 三種不同恢復方式下,濾柱催化氧化去除氨氮活性恢復速度呈現2#堿度恢復>3#重新掛膜>1#自然恢復的濾柱,其中3#重新掛膜濾柱應對高負荷污染出水濃度波動最大,1#自然恢復濾柱恢復期間出水亞硝氮積累時間最長且峰值最高.
3.2 三種不同恢復方式下,1#自然恢復的濾柱和2#堿度恢復濾柱催化氧化去除錳活性恢復速度均較快. 3#掛膜濾柱由于重新掛膜除錳活性恢復速度最慢.
3.3 氨氮和錳的相互影響結果表明,進水氨氮抑制錳的去除, 3根濾柱中投加堿度恢復濾柱表現最優.隨著進水氨氮濃度的升高出水錳濃度始終低于0.1mg/L;錳對氨氮的去除影響不顯著.
3.4 XPS和XRD分析結果表明堿度恢復有利于Mn3+的生成,Mn3+在鐵錳復合氧化物濾料催化氧化氨氮的過程中發揮了關鍵的作用,這有助于氨氮的去除.重新掛膜恢復不利于Mn3+的生成,且Mn2+比例會升高,氧化物的結晶度也會降低,不利于氨氮的去除.
3.5 SEM和XRD分析結果表明,不同恢復條件下運行濾料表面復合錳氧化物形態呈現不同的變化特征.自然恢復濾柱以及堿度恢復濾柱隨運行時間,結晶度基本保持不變,而高錳酸鉀重新掛膜濾柱的濾料樣品的結晶度較差.
[1] 李圣品,李文鵬,殷秀蘭,等.全國地下水質分布及變化特征 [J]. 水文地質工程地質, 2019,46(6):1–8.
Li S P, Li W P, Yin X L, et al. Distribution and evolution characteristics of national groundwater quality from 2013 to 2017 [J]. Hydrogeology & Engineering Geology, 2019,46(6):1–8.
[2] 余 東,周金龍,陳勁松,等.新疆喀什地區高鐵錳地下水空間分布特征及成因分析 [J]. 環境化學, 2020,39(11):3235–3245.
Yu D, Zhou J L, Chen J S, et al. Spatial distribution characteristics and genesis of groundwater with high iron and manganese content in Kashi Prefecture, Xinjiang [J]. Environmental Chemistry, 2020,39(11):3235– 3245.
[3] Wang H, Yang Q, Ma H, et al. Chemical compositions evolution of groundwater and its pollution characterization due to agricultural activities in Yinchuan Plain, northwest China [J]. Environmental Research, 2021,200:111449.
[4] 董姝娟.北京城近郊地下水三氮數值模擬及其自凈能力評價 [D]. 中國地質大學(北京), 2010.
Dong S J. Nitrogen numerical simulation in Beijing urban groundwater and monitored naturalattenuation about groundwater [D]. China University of Geosciences (Beijing), 2010.
[5] 危潤初,肖長來,梁秀娟.吉林市城區地下水污染時空演化 [J]. 中國環境科學, 2014,34(2):417–423.
Wei R C, Xiao C L, Liang X J. Spatio-temporal evolution of groundwater pollution in the urban areas of Jilin City [J]. China Environmental Science, 2014,34(2):417–423.
[6] Hoaghia M-A, Andrei M L, Cadar O, et al. Health risk assessment associated with nitrogen compounds contaminated drinking water in Medias Region [J]. Studia Universitatis Babes-Bolyai Chemia, Cluj-Napoca: Univ Babes-Bolyai, 2016,61(3):451–460.
[7] Grandjean P, Landrigan P J. Neurobehavioural effects of developmental toxicity [J]. Lancet Neurology, 2014,13(3):330–338.
[8] Farina M, Avila D S, da Rocha J B T, et al. Metals, oxidative stress and neurodegeneration: a focus on iron, manganese and mercury [J]. Neurochemistry International, 2013,62(5):575–594.
[9] Abu Hasan H, Abdullah S R S, Kamarudin S K, et al. Simultaneous NH4+-N and Mn2+removal from drinking water using a biological aerated filter system: Effects of different aeration rates [J]. Separation and Purification Technology, Amsterdam: Elsevier, 2013,118:547– 556.
[10] Qin W, Li W G, Zhang D Y, et al. Ammonium removal of drinking water at low temperature by activated carbon filter biologically enhanced with heterotrophic nitrifying bacteria [J]. Environmental Science and Pollution Research, Heidelberg: Springer Heidelberg, 2016,23(5):4650–4659.
[11] Tobiason J E, Bazilio A, Goodwill J, et al. Manganese Removal from Drinking Water Sources [J]. Current Pollution Reports, Heidelberg: Springer Heidelberg, 2016,2(3):168–177.
[12] 張曉健,林朋飛,陳 超,等.自來水廠應急除錳凈水技術研究 [J]. 給水排水, 2013,49(12):27–31.
Zhang X J, Lin P F, Chen C, et al. Study on emergency manganese removal technologies for water treatment plant [J]. Water & Wastewater Engineering, 2013,49(12):27–31.
[13] 徐滿天,唐玉朝.源水化學氧化與排泥水生物氧化除錳技術研究 [D]. 合肥:安徽建筑大學, 2017.
Xu M T, Tang Y C. Study on manganese removal technology of chemical oxidation in row water and bacteria oxidation in sludge water [D]. Hefei: Anhui Jianzhu University, 2017.
[14] Diaz-Alarcón J A, Alfonso-Pérez M P, Vergara-Gómez I, et al. Removal of iron and manganese in groundwater through magnetotactic bacteria [J]. Journal of Environmental Management, 2019,249:109381.
[15] 劉文龍,錢仁淵,包宗宏.吹脫法處理高濃度氨氮廢水 [J]. 南京工業大學學報(自然科學版), 2008,(4):56–59.
Liu W L, Qian R Y, Bao Z H. Treatment of high concentration ammonia-nitrogen wastewater by air stripping [J]. Journal of Nanjing Tech University (Natural Science Edition), 2008,(4):56–59.
[16] 何彩慶,陳云嫩,殷若愚,等.離子交換/吸附法凈化氨氮廢水的研究進展 [J]. 應用化工, 2021,50(2):481–485.
He C Q, Chen Y N, Yin R Y, et al. Removal of ammonium from water and wastewater using the adsorption and ion exchange method: a review [J]. Applied Chemical Industry, 2021,50(2):481–485.
[17] 王劉煜,李 冬,曾輝平,等.生物濾池同步凈化低溫高鐵錳氨氮地下水[J]. 中國環境科學, 2019,39(8):3300-3307.
Wang L Y, Li D, Zeng H P, et al. Simultaneous purification of high-iron, manganese and ammonia nitrogen from low temperature groundwater in biological filter [J]. China Environmental Science, 2019,39(8):3300-3307.
[18] Sathishkumar K, Murugan K, Benelli G, et al. Bioreduction of hexavalent chromium by Pseudomonas stutzeri L1and Acinetobacter baumannii L2 [J]. Annals of Microbiology, 2017,67(1):91–98.
[19] 曹 昕.鐵錳復合氧化物催化氧化去除地下水中氨氮研究 [D]. 西安建筑科技大學, 2015.
Cao X. The study on catalytic oxidation of ammonia in groundwater by co-oxides of iron and manganese [D]. Xi'an University of Architecture & Technology, 2015.
[20] 白筱莉,黃廷林,張瑞峰,等.鐵錳復合氧化膜同步去除地表水中氨氮和錳 [J]. 中國環境科學, 2017,37(12):4534–4540.
Bai X L, Huang T L, Zhang R F, et al. The simultaneous removal of ammonium and manganese from surface water by iron-manganese co-oxides film [J]. China Environmental Science, 2017,37(12):4534– 4540.
[21] Cheng Y, Xiong W Y, Huang T L. Mechanistic insights into effect of storage conditions of Fe-Mn co-oxide filter media on their catalytic properties in ammonium-nitrogen and manganese oxidative removal [J]. Separation and Purification Technology, Amsterdam: Elsevier, 2021,259:118102.
[22] Cheng Y, Huang T L, Sun Y, et al. Catalytic oxidation removal of ammonium from groundwater by manganese oxides filter: Performance and mechanisms [J]. Chemical Engineering Journal, 2017, 322:82–89.
[23] Cheng Y, Zhang S S, Huang T L, et al. Effect of alkalinity on catalytic activity of iron–manganese co-oxide in removing ammonium and manganese: Performance and mechanism [J]. International Journal of Environmental Research and Public Health, 2020:14.
[24] Cheng Y, Xiong W Y, Huang T L. Catalytic oxidation removal of manganese from groundwater by iron–manganese co-oxide filter films under anaerobic conditions [J]. Science of The Total Environment, 2020,737:139525.
[25] Liang X, Hart C, Pang Q, et al. A highly efficient polysulfide mediator for lithium–sulfur batteries [J]. Nature Communications, 2015,6(1): 5682.
[26] Ilton E S, Post J E, Heaney P J, et al. XPS determination of Mn oxidation states in Mn (hydr)oxides [J]. Applied Surface Science, 2016,366:475–485.
[27] Madison A S, Tebo B M, Mucci A, et al. Abundant porewater Mn(III) is a major component of the sedimentary redox system [J]. Science, American Association for the Advancement of Science, 2013.
[28] Bruins J H, Petrusevski B, Slokar Y M, et al. Biological and physico-chemical formation of Birnessite during the ripening of manganese removal filters [J]. Water Research, 2015,69:154–161.
[29] Yang H, Yan Z, Du X, et al. Removal of manganese from groundwater in the ripened sand filtration: Biological oxidation versus chemical auto-catalytic oxidation [J]. Chemical Engineering Journal, 2020,382: 123033.
Optimization of recovery method for catalytic ammonium/manganese oxidation by active filter media.
CHENG Ya, ZHANG Yong-zhi, ZHENG Jia-hui, LI Yu-yang, HUANG Ting-lin*
(Shaanxi Key Laboratory of Environmental Engineering, Key Laboratory of Northwest Water Resource, Ministry of Education, School of Environmental and Municipal Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, China)., 2022,42(5):2112~2119
Taking deactivated filter media as the research object, the effects of three different recovery methods (natural recovery, adding basicity, and re-hanging film) on the catalytic oxidation efficiency of the filter media for ammonium (NH4+-N) and manganese (Mn2+) removal were investigated. The experimental results showed that the NH4+-N removal rate of natural recovery (1#) filter column, adding basicity (2#) filter column and re-hanging film (3#) filter column was above 90% after running for 4d, 2d and 3d, respectively. When the influent NH4+-N concentration increased gradually, the effluent NH4+-N concentration of 3# filter column fluctuated the most, while the effluent nitrite accumulation time of 1# filter column was the longest and the peak value was the highest. The recovery rate of Mn2+removal activity of all three filter columns was fast. Both 1# and 2# filter columns could completely remove Mn2+in 2 days and 3# filter column could completely remove the influent Mn2+within 5days after stopping adding potassium permanganate. The experimental results of the interaction between NH4+-N and Mn2+showed that 2# filter column performed the best among the three filter columns. Although NH4+-N inhibited the removal of Mn2+, with the increase of influent NH4+-N concentration, the effluent Mn2+concentration of the 2# filter column was always lower than 0.1mg/L. Mn2+had no significant effect on NH4+-N removal. The results of XRD analysis showed that the crystallinity of the filter media samples in 3# filter column was poor due to the influence of the new formed oxide film on its surface. Considering the recovery efficiency of NH4+-N and Mn2+as well as the addition of chemical agents, the natural recovery method is the most suitable recovery method.
activity recovery;deactivated filter media;ammonium/manganese removal;catalytic oxidation;groundwater treatment
X523
A
1000-6923(2022)05-2112-08
程 亞(1990-),女,山東濟寧人,副教授,博士,主要研究方向為微污染水源水處理.發表論文10余篇.
2021-09-22
國家自然科學基金資助項目(52000145,51778521);國家重點研發計劃項目(2019YFD1100101)
* 責任作者, 教授, huangtinglin@xauat.edu.cn

