楊凌糖絲菌Hhs.015拮抗蘋果樹(shù)腐爛病菌轉(zhuǎn)錄組分析及抗菌機(jī)制探究
王建勛,康 鳳,孫 玲,顏 霞,黃麗麗
(1.西北農(nóng)林科技大學(xué) 生命科學(xué)學(xué)院,陜西楊凌 712100;2.國(guó)家旱區(qū)作物逆境生物學(xué)國(guó)家重點(diǎn)實(shí)驗(yàn)室,陜西楊凌 712100; 3.西北農(nóng)林科技大學(xué) 植物保護(hù)學(xué)院,陜西楊凌 712100)
蘋果是中國(guó)重要的經(jīng)濟(jì)作物,由蘋果樹(shù)腐爛病菌Valsamali引起的蘋果樹(shù)腐爛病嚴(yán)重制約了中國(guó)蘋果產(chǎn)業(yè)的發(fā)展[1-3]。目前對(duì)于蘋果樹(shù)腐爛病主要依賴化學(xué)藥劑防治,但是化學(xué)藥劑殘留給環(huán)境和人類帶來(lái)了巨大的危害[4]。因此,利用環(huán)保型和可持續(xù)的生物菌劑保護(hù)果園免受蘋果樹(shù)腐爛病菌的侵害勢(shì)在必行[5]。目前為止,已有一些用于防治Valsamali的有益微生物被發(fā)現(xiàn),但防治僅處于初步階段[5-7]。
放線菌是一類革蘭氏陽(yáng)性細(xì)菌,可以產(chǎn)生大量的代謝物和抗生素,能夠?qū)χ参锊≡鸬揭种频淖饔肹8]。放線菌通過(guò)降解目標(biāo)真菌細(xì)胞壁、產(chǎn)生抗真菌化合物來(lái)阻止病原菌的侵染[9-10]。楊凌糖絲菌(SaccharothrixyanglingeniesHhs.015,Hhs.015)是從黃瓜根部分離出來(lái)的一株稀有放線菌[11],該菌在田間試驗(yàn)顯示出對(duì)番茄葉霉病和蘋果樹(shù)腐爛病具有良好的防治效果[12-13]。有研究從Hhs.015發(fā)酵液中提取了活性物質(zhì)異黃酮和戊霉素,以及2個(gè)戊烯大環(huán)類脂類物質(zhì)WH01和WH02[14-15]。轉(zhuǎn)錄組是指特定組織或細(xì)胞在某個(gè)時(shí)間或某個(gè)狀態(tài)下轉(zhuǎn)錄出來(lái)的所有RNA的總和,主要包括mRNA和編碼RNA。轉(zhuǎn)錄組可以研究生物在不同環(huán)境、宿主等情況下的基因表達(dá)變化,闡述宿主或環(huán)境對(duì)生物的影響[16]。Kang等通過(guò)轉(zhuǎn)錄組分析,揭示了生防菌芽孢桿菌CC09在小麥體內(nèi)抗病的分子機(jī)制[17]。Kr?ber等[18]利用轉(zhuǎn)錄組分析,發(fā)現(xiàn)生防菌BacillusamyloliquefaciensFZB42生物膜形成過(guò)程中,抗菌肽LCI基因和多種次級(jí)代謝物高效表達(dá),揭示了生物膜的形成對(duì)解淀粉芽孢桿菌發(fā)揮生防作用的重要作用。
放線菌作為生防菌已被廣泛研究,但是對(duì)于稀有放線菌屬糖絲菌的抗菌機(jī)制研究相對(duì)較少。本研究對(duì)楊凌糖絲菌Hhs.015拮抗蘋果樹(shù)腐爛病菌Valsamali的過(guò)程進(jìn)行轉(zhuǎn)錄組分析,試圖探究Hhs.015在抗真菌過(guò)程中的分子機(jī)制,對(duì)闡明楊凌糖絲菌Hhs.015拮抗蘋果樹(shù)腐爛病菌的分子機(jī)理奠定一定的基礎(chǔ)。
1 材料與方法
1.1 材 料
1.1.1 供試菌株 楊凌糖絲菌Hhs.015和蘋果樹(shù)腐爛病菌Valsamali均來(lái)自西北農(nóng)林科技大學(xué)植物保護(hù)學(xué)院果樹(shù)病害病原生物學(xué)及綜合防治實(shí)驗(yàn)室。
1.1.2 主要培養(yǎng)基 馬鈴薯葡萄糖瓊脂培養(yǎng)基(PDA):200 g去皮馬鈴薯,切成小塊加水煮沸30 min,然后用4層紗布過(guò)濾,在濾液中加入20 g葡萄糖和15 g瓊脂粉,定容至1 L,高壓滅菌后 備用。
黃豆培養(yǎng)基:稱取20 g黃豆,用粉碎機(jī)打碎后煮沸30 min,4層紗布過(guò)濾,然后在濾液中加入10 g葡萄糖,5 g可溶性淀粉,2 g蛋白胨,2 g酵母膏,2 g NaCl,1 g CaCO3,0.5 g MgSO4·7H2O,0.5 g KH2PO4,15 g瓊脂粉,定容至1 L,高溫滅菌備用。所用試劑均為國(guó)產(chǎn)分析純。
1.2 楊凌糖絲菌Hhs.015樣品制備
將保存的楊凌糖絲菌Hhs.015采用劃線法在黃豆培養(yǎng)基上進(jìn)行活化培養(yǎng),培養(yǎng)溫度為 28 ℃。Valsamali則利用直徑為10 mm的打孔器打取菌餅在PDA培養(yǎng)基上進(jìn)行活化,培養(yǎng)溫度為25 ℃。將活化好的Hhs.015直線轉(zhuǎn)接至新鮮黃豆培養(yǎng)基中央28 ℃培養(yǎng)3 d,然后將活化好的Valsamali用無(wú)菌手術(shù)刀切成2~3 mm的長(zhǎng)條置于Hhs.015兩側(cè),共培養(yǎng)3 d(圖1),以空白PDA為對(duì)照,設(shè)置3個(gè)生物學(xué)重復(fù)。
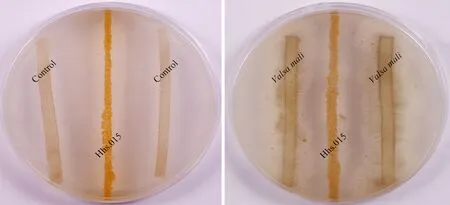
圖1 Hhs.015拮抗Valsa mali試驗(yàn)Fig.1 Hhs.015 antagonizes Valsa mali
1.3 楊凌糖絲菌RNA的提取、建庫(kù)、數(shù)據(jù)質(zhì)控
使用無(wú)菌牙簽分別收集Valsamali拮抗培養(yǎng)和空白PDA處理的Hhs.015菌體,用錫箔紙包裹后立即置于液氮中,利用裝有干冰的冰盒將收集的樣品送至北京諾禾致源生物公司提取RNA、質(zhì)檢、建庫(kù)以及轉(zhuǎn)錄組測(cè)序。
將質(zhì)量合格的RNA用來(lái)構(gòu)建文庫(kù),使用Qubit2.0進(jìn)行初步定量,再用qRT-PCR對(duì)文庫(kù)有效濃度進(jìn)行準(zhǔn)確定量,以保證文庫(kù)質(zhì)量。庫(kù)檢合格后,把不同文庫(kù)按照有效濃度及目標(biāo)下機(jī)數(shù)據(jù)量的需求pooling后進(jìn)行Illumina測(cè)序。為了保證數(shù)據(jù)分析的質(zhì)量及可靠性,對(duì)原始數(shù)據(jù)進(jìn)行過(guò)濾。同時(shí)對(duì)Clean data進(jìn)行Q20、Q30和GC含量計(jì)算,后續(xù)所有分析均是基于Clean data進(jìn)行的高質(zhì)量分析。使用R語(yǔ)言對(duì)樣品間基因表達(dá)水平相關(guān)性進(jìn)行Pearson相關(guān)系數(shù)計(jì)算,以評(píng)估RNA-seq的整體質(zhì)量。相關(guān)系數(shù)越接近1,表明樣品之間表達(dá)模式的相似度越高[19]。
1.4 差異表達(dá)基因(DEGs)分析
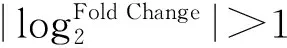
1.5 差異表達(dá)基因GO、KEGG注釋
為了明確差異表達(dá)基因的生物學(xué)功能,闡明Hhs.015的抗菌機(jī)制。將差異表達(dá)基因進(jìn)行Gene Ontology(GO)和Kyoto Encyclopedia of Genes and Genomes(KEGG)富集分析。即以Hhs.015基因組中所有基因的GO和KEGG注釋為背景,使用超幾何分布檢驗(yàn)對(duì)DEG進(jìn)行GO和KEGG途徑富集分析。GO數(shù)據(jù)庫(kù)分為三大類:細(xì)胞學(xué)組件(Cellular Component,CC),分子功能(Molecular Function,MF),生物學(xué)途徑(Biological Process,BP)。通過(guò)R包軟件GOseq實(shí)現(xiàn)差異表達(dá)基因的GO富集分析[21],以校正后P<0.05的GO term作為差異表達(dá)基因顯著富集,并繪制成散點(diǎn)圖。
KEGG是一個(gè)重要的通路數(shù)據(jù)庫(kù),可以系統(tǒng)的分析基因功能和基因組信息,是生物代謝分析及代謝網(wǎng)絡(luò)研究的重要工具[22]。通過(guò)KOBAS v2.0軟件分析差異表達(dá)基因KEGG富集分析,結(jié)合GraphPad Prism軟件繪制柱狀圖。
1.6 差異表達(dá)基因COG注釋
Cluster of Orthologous Groups of Proteins(COG),是由NCBI創(chuàng)建并維護(hù)的蛋白數(shù)據(jù)庫(kù),通過(guò)比對(duì)可以將某個(gè)蛋白序列注釋到某一個(gè)COG中,從而推測(cè)該序列的功能。將差異表達(dá)基因進(jìn)行COG注釋,可明確差異表達(dá)基因所調(diào)節(jié)的生物學(xué)功能,從而分析Hhs.015在拮抗Valsamali過(guò)程中的差異基因功能分布。
1.7 DEGs中分泌蛋白及碳水化合物活性酶 分析
將差異表達(dá)基因利用SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/)和TMHMM Server v2.0(http://www.cbs.dtu.dk/services/TMHMM/)在線工具預(yù)測(cè)其中的分泌蛋白。
Carbohydrate-Active enzymes Database是碳水化合物酶相關(guān)的專業(yè)數(shù)據(jù)庫(kù)[23],包括能催化碳水化合物降解、修飾、以及生物合成的相關(guān)酶系家族。包含五個(gè)主要分類:糖苷水解酶(Glycoside Hydrolases, GHs)、糖基轉(zhuǎn)移酶(Glycol Transferases, GTs)、多糖裂解酶(Polysaccharide Lyases, PLs)、糖酯酶(Carbohydrate Esterases, CEs)和氧化還原酶(Auxiliary Activities, AAs)。此外,還包含與碳水化合物結(jié)合結(jié)構(gòu)域(Carbohydrate-Binding Modules,CBMs)。使用Diamond軟件,將差異表達(dá)基因與CAZy數(shù)據(jù)庫(kù)進(jìn)行比對(duì),再結(jié)合分泌蛋白得到注釋結(jié)果。
1.8 抗菌過(guò)程的次級(jí)代謝產(chǎn)物基因簇分析
利用antiSMASH(5.2.0)(https://antismash.secondarymetabolites.org/)預(yù)測(cè)Hhs.015中的次級(jí)代謝產(chǎn)物,并分析差異表達(dá)基因在次級(jí)代謝產(chǎn)物中的分布,明確Hhs.015在拮抗Valsamali過(guò)程中關(guān)鍵的次級(jí)代謝產(chǎn)物。
1.9 qRT-PCR驗(yàn)證DEGs
為了充分證實(shí)測(cè)序結(jié)果的可靠性,選取13個(gè)基因進(jìn)行qRT-PCR驗(yàn)證,并以rpoA[24]作為內(nèi)參基因。使用軟件Primer Premier 5.0設(shè)計(jì)定量引物(表1),以RevertAid RT逆轉(zhuǎn)錄試劑盒反轉(zhuǎn)錄得到cDNA作為模板,使用RealStar Green Mixture 進(jìn)行實(shí)時(shí)熒光定量PCR檢測(cè)。總體系為20 μL:cDNA 1 μL、Primer F/R 1 μL、RealStar Green Mixture 10 μL、ddH2O 7 μL。使用Roche lightcycler 96進(jìn)行反應(yīng),反應(yīng)程序?yàn)椋?5 ℃,10 min;45個(gè)循環(huán)(95 ℃,15 s;60 ℃,30 s;72 ℃,30 s);溶解:95 ℃,15 s ;65 ℃,60 s;97 ℃,1 s。每組試驗(yàn)設(shè)置3個(gè)生物學(xué)重復(fù),使用2-ΔΔCt法計(jì)算基因的相對(duì)表達(dá)量[25]。
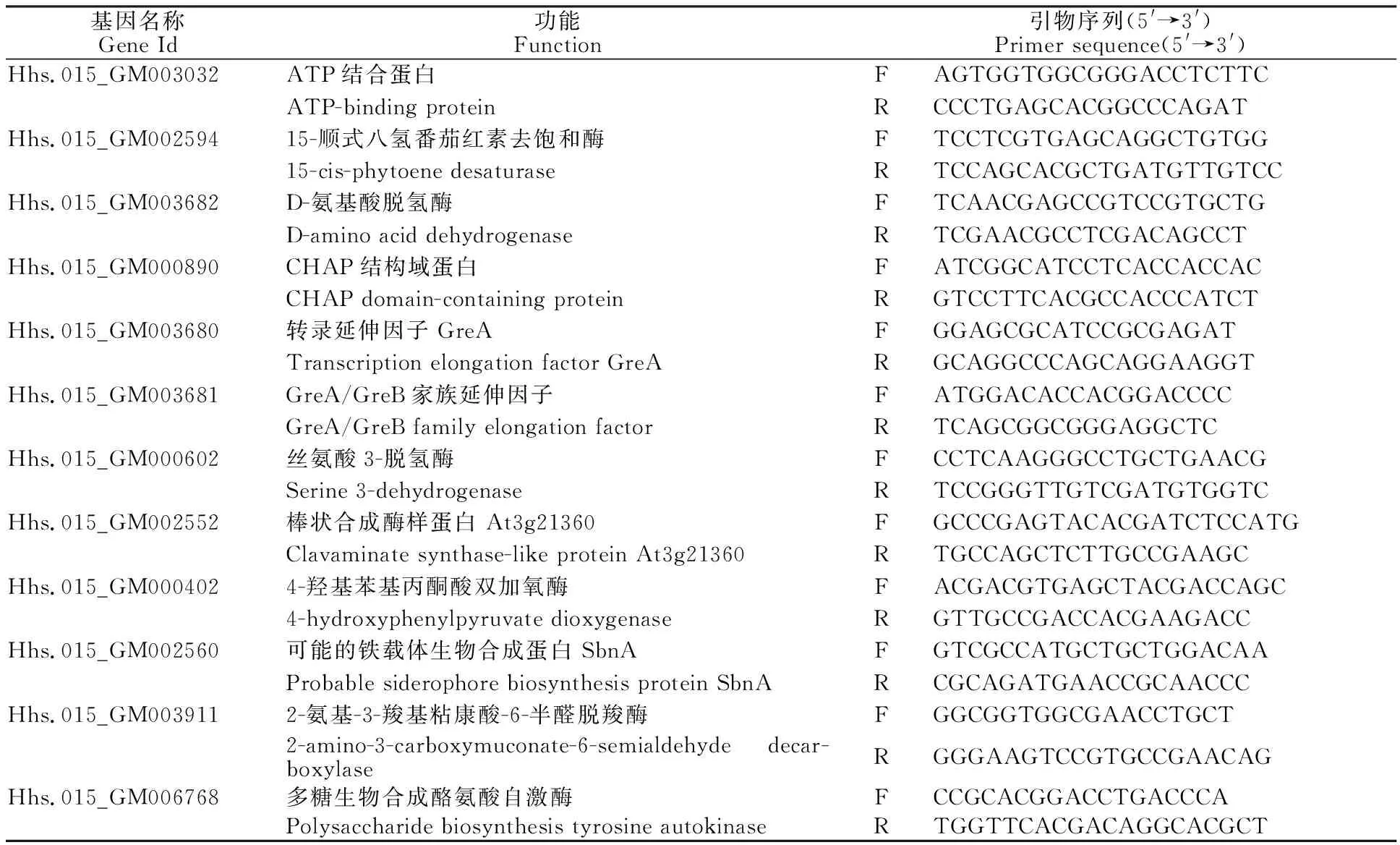
表1 qRT-PCR檢測(cè)基因及引物序列Table 1 Gene and primer sequence detected by qRT-PCR
2 結(jié)果與分析
2.1 測(cè)序數(shù)據(jù)質(zhì)控分析
通過(guò)測(cè)序獲得raw reads總數(shù)為108 587 756條,過(guò)濾后的clean reads總數(shù)為107 410 364條,clean reads的堿基總數(shù)為16.15 Gb(表 2)。樣品誤差率小于0.03%,Q20>97.50%,Q30> 92.88%,GC含量為70.56%~70.79%。從樣本相關(guān)性熱圖(圖2)可以看出,樣本間相關(guān)性較好,取樣合理。因此,本次測(cè)序數(shù)據(jù)質(zhì)量?jī)?yōu)良,可以用于后續(xù)分析研究。
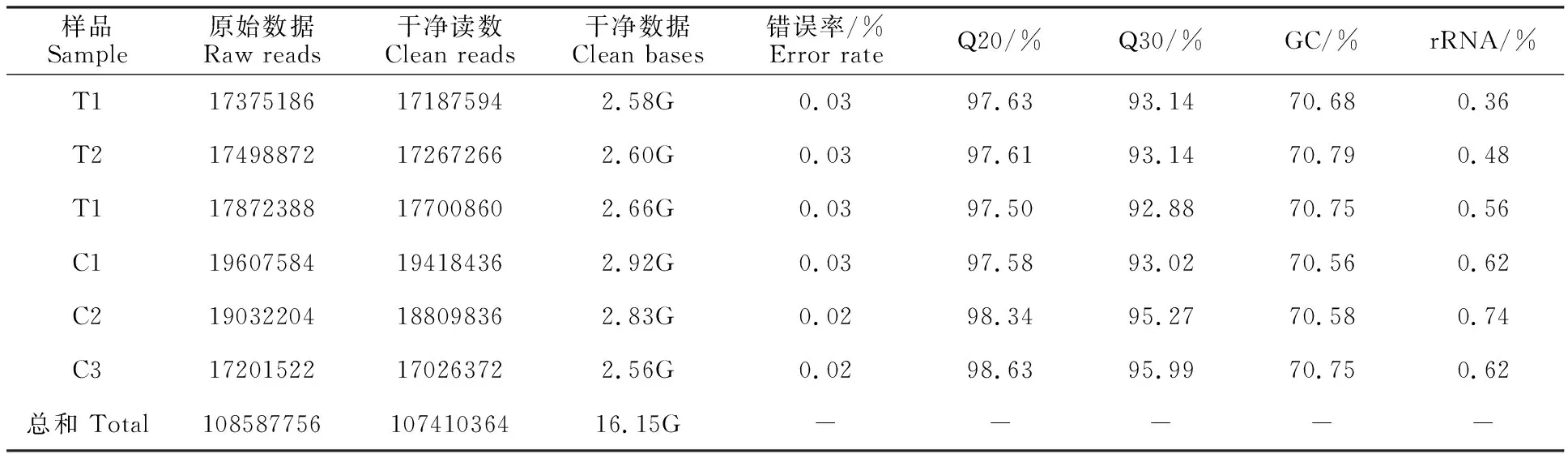
表2 測(cè)序結(jié)果與映射比率統(tǒng)計(jì)Table 2 Statistics of sequencing production and mapping ratio
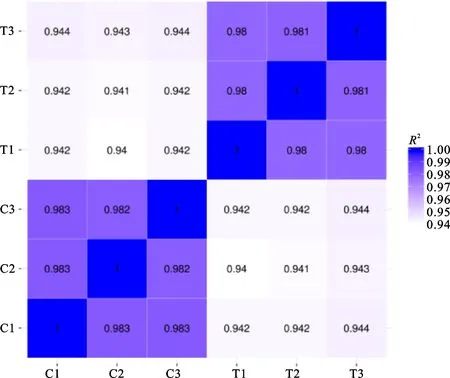
橫縱坐標(biāo)為各樣本相關(guān)系數(shù)的平方
2.2 差異表達(dá)基因分析
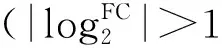
圖3 差異表達(dá)基因火山圖Fig.3 Volcano map of different expression genes
2.3 GO和KEGG富集分析
將GO分析的Term繪制成散點(diǎn)圖(圖 4),可以看到上調(diào)表達(dá)基因主要集中在輔因子結(jié)合、水解酶活性、反轉(zhuǎn)運(yùn)蛋白活性、碳水化合物代謝等途徑。下調(diào)表達(dá)基因主要集中在陽(yáng)離子結(jié)合、草酸和羧酸代謝、類異戊二烯生物合成和代謝過(guò)程、脂質(zhì)生物合成過(guò)程、谷氨酰胺家族氨基酸代謝過(guò)程、脂質(zhì)代謝等過(guò)程。氧化還原過(guò)程及酶活性所涉及的基因一部分上調(diào)一部分下調(diào)。雖然最終表現(xiàn)為Hhs.015成功抑制了Valsamali的生長(zhǎng),但是在此過(guò)程中Hhs.015的代謝過(guò)程受到了Valsamali極大的影響。
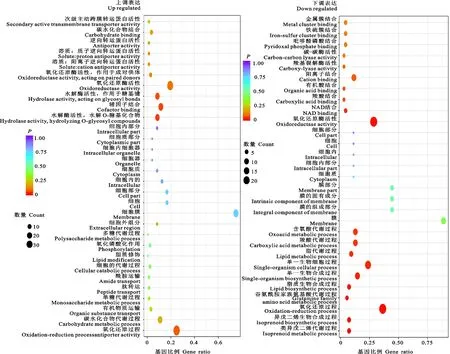
圖4 差異基因GO顯著性富集分析Fig.4 Enrichment analysis of GO in differentially expressed genes
KEGG富集分析發(fā)現(xiàn)(圖5),ABC轉(zhuǎn)運(yùn)蛋白、次生代謝產(chǎn)物的生物合成、氨基酸的生物合成、代謝途徑、抗生素的生物合成、核糖體等通路基因顯著性上調(diào)表達(dá)。同時(shí),ABC轉(zhuǎn)運(yùn)蛋白、淀粉和蔗糖代謝、次生代謝產(chǎn)物的生物合成、代謝途徑等通路基因部分下調(diào)表達(dá)。可以看到,Hhs.015的淀粉和蔗糖代謝相關(guān)基因下調(diào)表達(dá),阻礙了能量的供應(yīng),但是通過(guò)增強(qiáng)部分氨基酸代謝補(bǔ)充一部分能量的供應(yīng),滿足Hhs.015生長(zhǎng)的基本需求。

圖5 差異基因KEGG分析Fig.5 KEGG analysis of differentially expressed genes
2.4 COG注釋差異基因功能分析
將差異表達(dá)基因進(jìn)行COG(Cluster of Orthologous Groups of proteins)注釋,533個(gè)差異基因共有360個(gè)注釋到COG數(shù)據(jù)庫(kù),包含241個(gè)上調(diào)表達(dá)基因,119個(gè)下調(diào)表達(dá)基因(圖6)。在上調(diào)表達(dá)基因中“[Q]次級(jí)代謝產(chǎn)物生物合成,運(yùn)輸和分解代謝(42)”“[G]碳水化合物運(yùn)輸和代謝(42)”“[R]僅通用功能預(yù)測(cè)(35)”“[E]氨基酸運(yùn)輸和代謝(33)”“[I]脂質(zhì)轉(zhuǎn)運(yùn)和新陳代謝(19)”這5類最多,占到70.95%。而類別“[E]氨基酸運(yùn)輸和代謝(16)”“ [T]信號(hào)轉(zhuǎn)導(dǎo)機(jī)制(16)”“[R]僅通用功能預(yù)測(cè)(14)”“[K]轉(zhuǎn)錄(11)”“[M]細(xì)胞壁、膜包膜生物發(fā)生(10)”在下調(diào)表達(dá)基因中所占比例較高,達(dá)到56.30%。
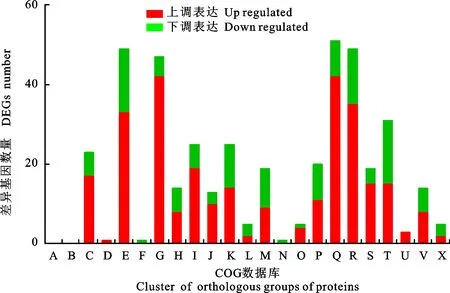
圖6 差異表達(dá)基因的COG注釋分析Fig.6 Statistics of COG annotation for DEGs
可以進(jìn)一步發(fā)現(xiàn),在面對(duì)Valsamali的脅迫時(shí),Hhs.015次級(jí)代謝產(chǎn)物合成、運(yùn)輸基因高效表達(dá),起到關(guān)鍵的抗菌作用。同時(shí)碳水化合物、氨基酸和脂類的代謝增強(qiáng),為Hhs.015的生長(zhǎng)及次級(jí)代謝物的合成提供必要的能量。部分信號(hào)轉(zhuǎn)導(dǎo)機(jī)制基因顯著性下調(diào),Valsamali分泌的物質(zhì)破壞了Hhs.015信號(hào)的傳遞,還破壞了Hhs.015細(xì)胞壁、細(xì)胞膜的合成。
基因Hhs.015_007438,在[G]、[E]、[P]、[R]中均有注釋,且為顯著性上調(diào)表達(dá),進(jìn)一步分析發(fā)現(xiàn),Hhs.015_007438是一個(gè)MFS(major facilitator superfamily)轉(zhuǎn)運(yùn)蛋白家族基因,還有另外2個(gè)顯著性上調(diào)的MFS家族基因,Hhs.015_000830和Hhs.015_002439。
2.5 分泌蛋白及碳水化合物活性酶差異表達(dá)基因分析
差異表達(dá)基因結(jié)合分泌蛋白分析發(fā)現(xiàn)有16個(gè)上調(diào)表達(dá)的分泌蛋白編碼基因,10個(gè)下調(diào)表達(dá)基因(表 3)。在上調(diào)表達(dá)的分泌蛋白中,包含α-甘露糖苷酶、ErfK/YbiS/YcfS/YnhG家族蛋白、鐵配合物轉(zhuǎn)運(yùn)系統(tǒng)底物結(jié)合蛋白、ABC轉(zhuǎn)運(yùn)蛋白底物結(jié)合蛋白、α-葡萄糖苷酶等等。在下調(diào)表達(dá)分泌蛋白中,只有一個(gè)含有SH3結(jié)構(gòu)域的蛋白,其他均為未知功能的假想蛋白。
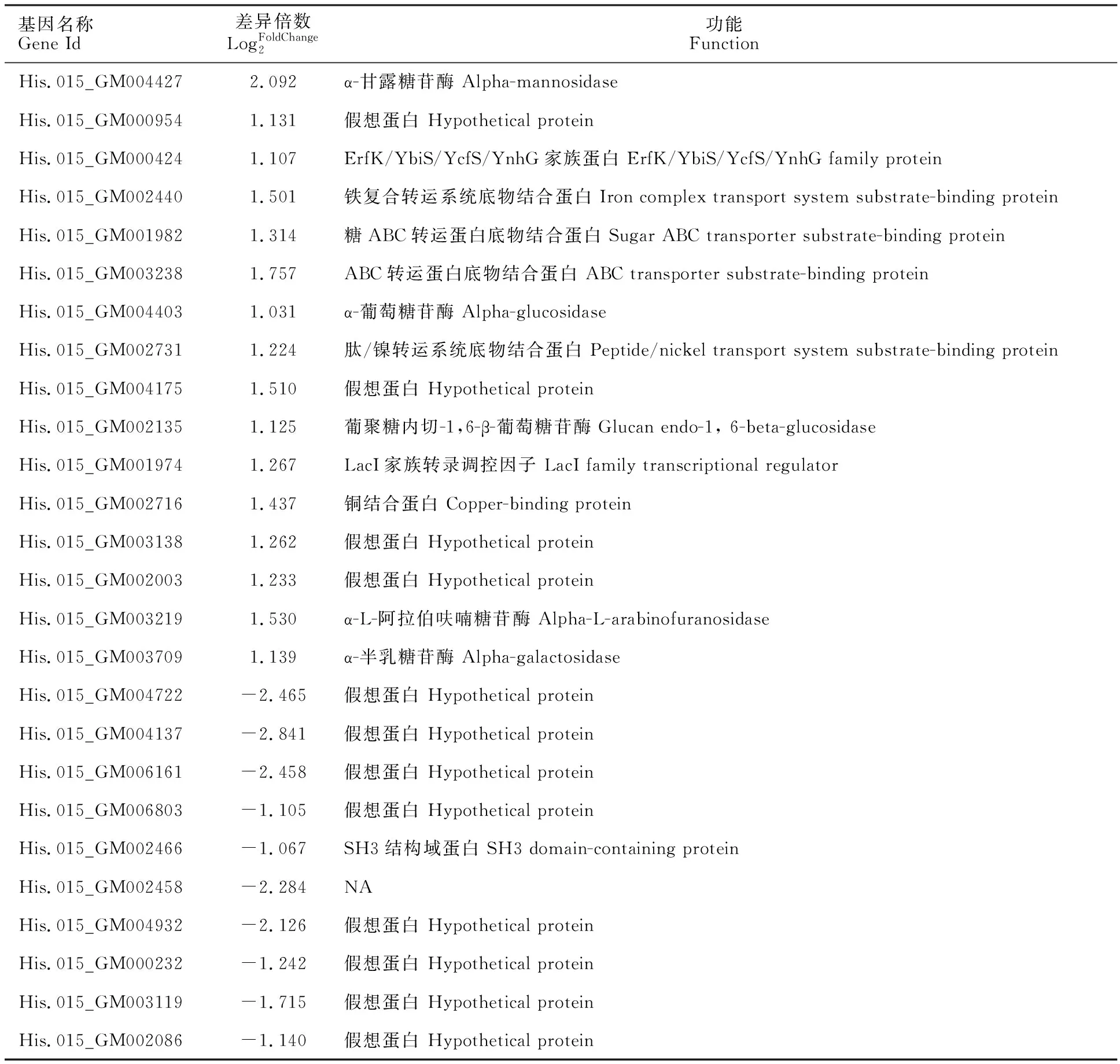
表3 差異表達(dá)基因中的分泌蛋白及功能Table 3 Secretory proteins and functions in differentially expressed genes
結(jié)合碳水化合物酶數(shù)據(jù)庫(kù)分析發(fā)現(xiàn),差異表達(dá)基因中,有36個(gè)基因具有碳水化合物注釋,27個(gè)基因上調(diào)表達(dá),9個(gè)基因下調(diào)表達(dá)(圖7)。分泌型的碳水化合物活性酶全部上調(diào)表達(dá),主要集中在碳水化合物結(jié)合結(jié)構(gòu)域和糖苷水解酶類。在非分泌型的碳水化合物活性酶中大部分為上調(diào)表達(dá),同樣也主要集中在碳水化合物結(jié)合結(jié)構(gòu)域和糖苷水解酶類,部分還有氧化還原酶。下調(diào)表達(dá)的基因主要是糖基轉(zhuǎn)移酶,還有部分碳水化合物結(jié)合結(jié)構(gòu)域和糖苷水解酶類。
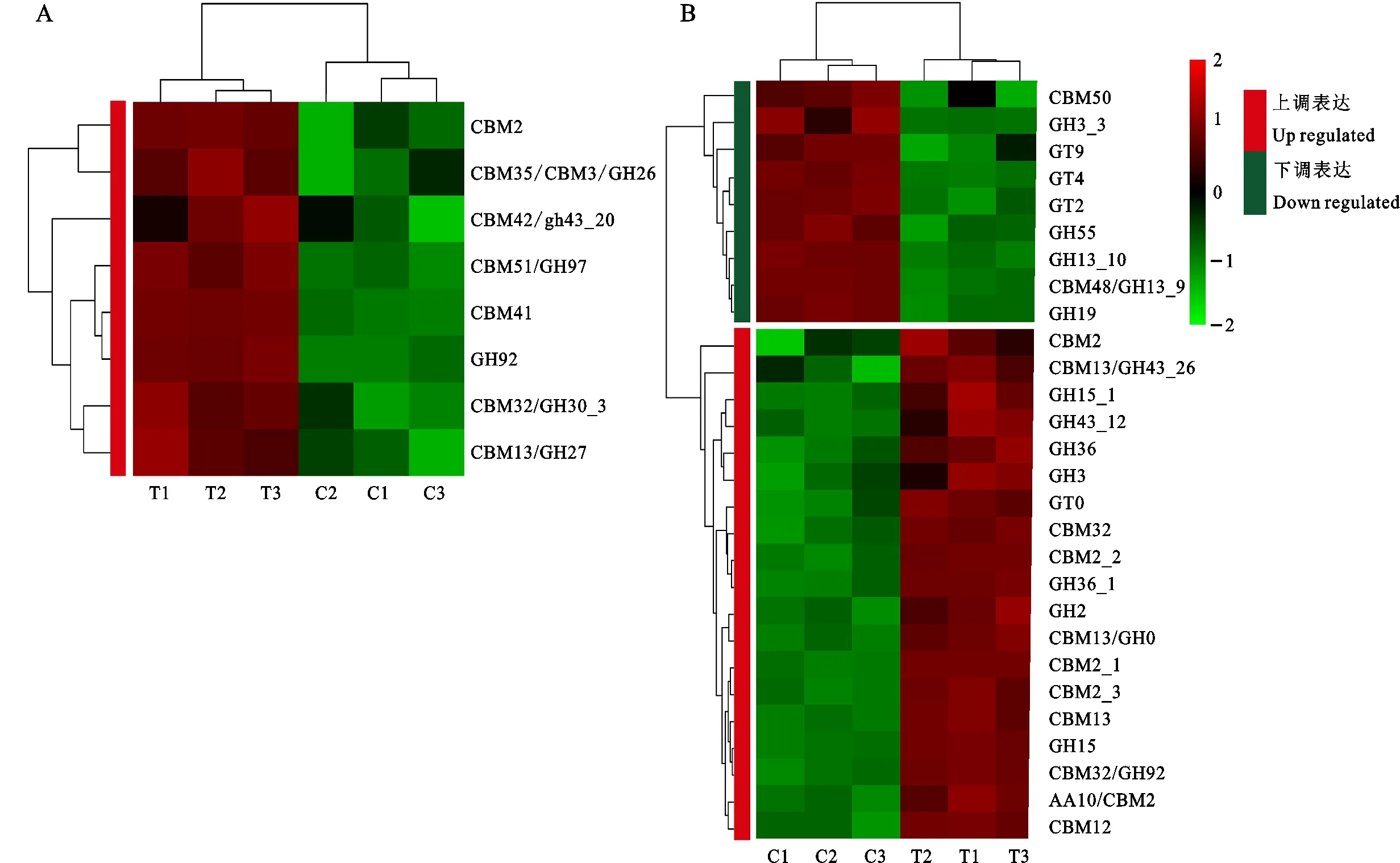
圖7 分泌型碳水化合物活性酶(A)及非分泌性碳水化合物活性酶(B)的表達(dá)情況Fig.7 Secreted carbohydrate active enzyme(A) and non-secreted carbohydrate active enzyme(B) expression
2.6 抗菌關(guān)鍵次級(jí)代謝產(chǎn)物分析
差異表達(dá)基因結(jié)合次級(jí)代謝基因簇分析表明,在Hhs.015的28個(gè)次級(jí)代謝物基因簇中,七個(gè)基因簇在抗菌過(guò)程中上調(diào)表達(dá)的基因較多,分別是基因簇9、10、12、13、17、18、19,上調(diào)表達(dá)的基因個(gè)數(shù)分別為27、10、14、8、11、8、25(圖8)。
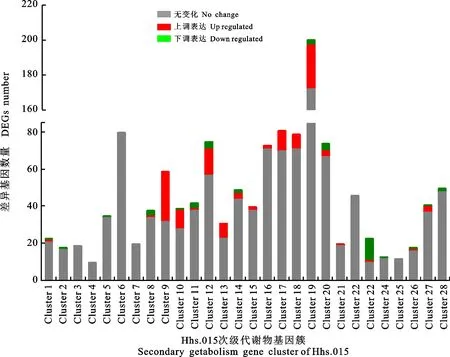
圖8 Hhs.015次級(jí)代謝物中的差異表達(dá)基因Fig.8 Different expression genes in Hhs.015 secondary metabolites
AntiSMASH[26]分析表明(表 4),基因簇18與噴他霉素的相似性達(dá)到80%,該基因簇在拮抗Valsamali過(guò)程中有8個(gè)基因上調(diào)表達(dá)。噴他霉素屬于多烯大環(huán)內(nèi)酯類抗生素,具有較強(qiáng)的抗真菌特性,前期已經(jīng)從Hhs.015中分離鑒定到pentaene macrolides,對(duì)Valsamali具有較好的抗性[14]。基因簇19與已知的macrotermycins具有96%的相似性,在拮抗過(guò)程中達(dá)到25個(gè)基因上調(diào)表達(dá)。曾有研究表明Macrotermycins A和C對(duì)人致病性金黃色葡萄球菌具有抗菌活性,它們還對(duì)白蟻真菌園的真菌寄生蟲(chóng)具有選擇性的抗真菌活性[27]。然而剩下的Cluster 9、10、12、13、17與已知的物質(zhì)相似性都比較低,表明Hhs.015在抗真菌過(guò)程中還有許多新物質(zhì)在發(fā)揮作用,可見(jiàn)Hhs.015具有一定的天然抗生素開(kāi)發(fā)潛力。
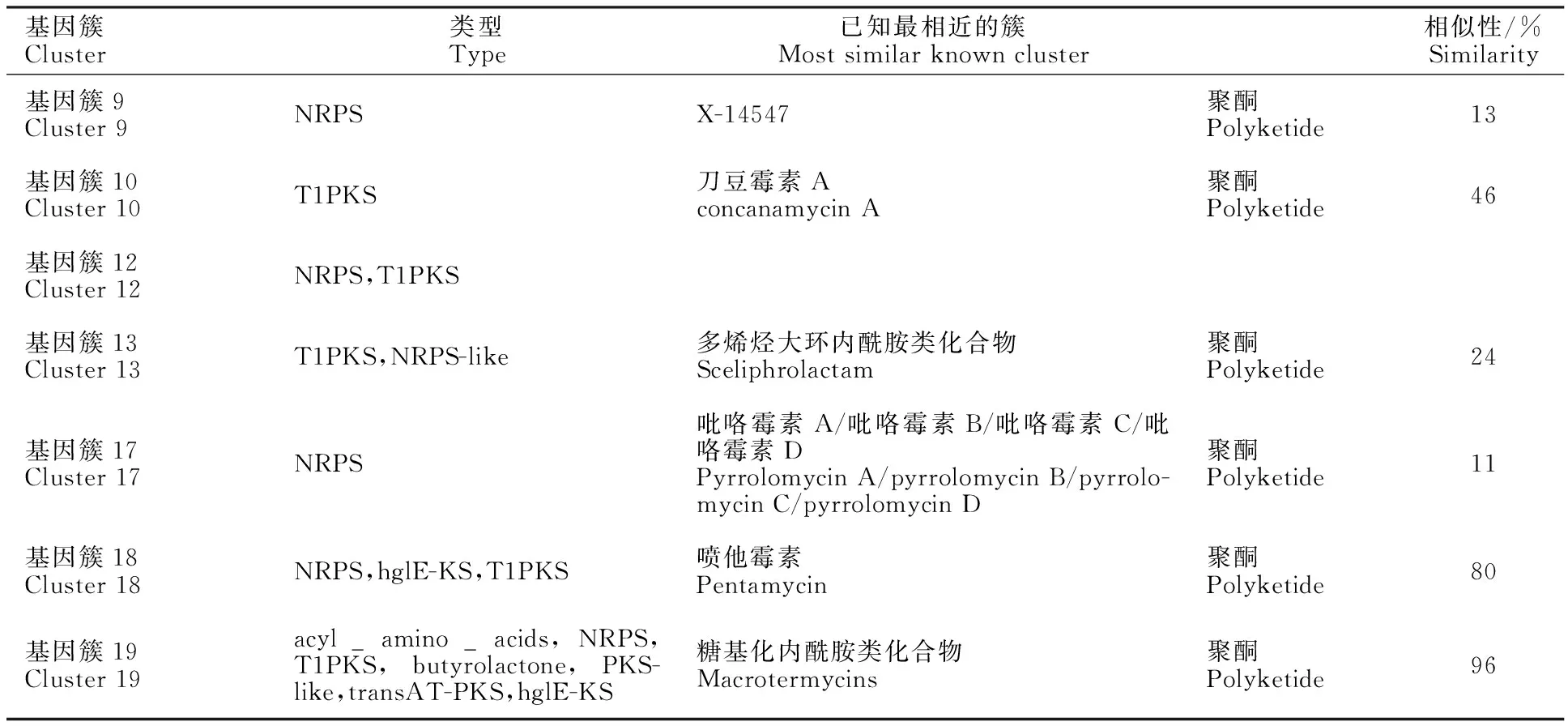
表4 上調(diào)表達(dá)基因集中的次級(jí)代謝物基因簇Table 4 Up-regulated gene in secondary metabolite gene cluster
2.7 qRT-PCR分析
從Hhs.015的差異表達(dá)基因中選擇13個(gè)基因,利用qRT-PCR驗(yàn)證測(cè)序數(shù)據(jù)的可靠性。圖9表明qRT-PCR檢測(cè)結(jié)果與測(cè)序數(shù)據(jù)所分析的差異表達(dá)基因趨勢(shì)一致。這13個(gè)基因包括4-羥苯基丙酮酸雙加氧酶、絲氨酸3-脫氫酶、轉(zhuǎn)錄延伸因子GreA、包含CHAP域的蛋白、ATP結(jié)合蛋白、多糖生物合成酪氨酸自身激酶等等。
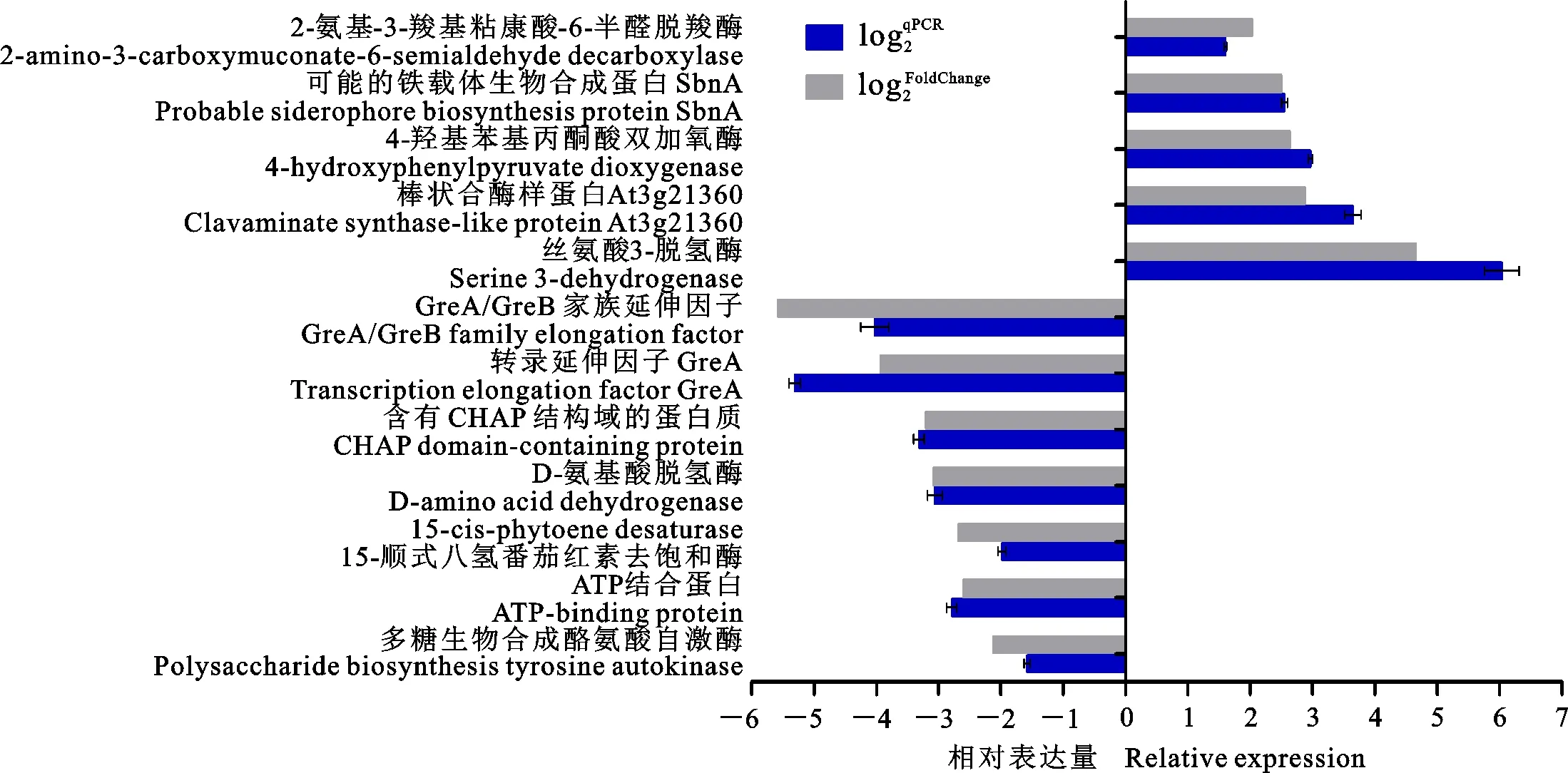
圖9 qRT-PCR分析部分差異表達(dá)基因Fig.9 qRT-PCR analysis of some differentially expressed genes
3 討論與結(jié)論
轉(zhuǎn)錄組分析在抗菌物質(zhì)對(duì)微生物的抗性機(jī)制研究方面取得了不少成果,比如高夢(mèng)莎研究發(fā)現(xiàn)殺菌劑臭氧通過(guò)破壞副溶血弧菌細(xì)胞膜的通透性、抑制活性氧清除酶的活性等過(guò)程殺死副溶血弧菌[28]。高亮等[29]研究殼聚糖處理辣椒疫霉后,通過(guò)抑制辣椒疫霉細(xì)胞膜、運(yùn)動(dòng)及糖代謝相關(guān)功能,從而起到了抑制辣椒疫霉生長(zhǎng)的作用。本研究發(fā)現(xiàn)楊凌糖絲菌Hhs.015在拮抗Valsamali的過(guò)程中,Hhs.015的能量供應(yīng)受到一定的阻礙,但是通過(guò)增強(qiáng)部分碳水化合物、氨基酸、脂類等物質(zhì)代謝補(bǔ)充一部分能量的供應(yīng),為Hhs.015的生長(zhǎng)及次級(jí)代謝物的合成提供必要的能量。Hhs.015的信號(hào)傳遞、細(xì)胞壁和細(xì)胞膜的合成等功能也受到Valsamali的抑制。與此同時(shí),Hhs.015自身抗菌物質(zhì)的合成和運(yùn)輸加強(qiáng),比如一些次級(jí)代謝產(chǎn)物。ABC轉(zhuǎn)運(yùn)蛋白家族和MFS超家族幾乎占據(jù)了生物所有轉(zhuǎn)運(yùn)蛋白的一半[30]。MFS轉(zhuǎn)運(yùn)蛋白具有營(yíng)養(yǎng)吸收,代謝產(chǎn)物、有害物質(zhì)排出等功能[31-33],對(duì)于Hhs.015產(chǎn)生的抗生素運(yùn)輸和毒性物質(zhì)排出具有重要作用。在拮抗過(guò)程中,ABC和MFS轉(zhuǎn)運(yùn)蛋白顯著性上調(diào)表達(dá)是為了更好的適應(yīng)環(huán)境而產(chǎn)生的一種自我保護(hù)機(jī)制,這對(duì)于提高產(chǎn)Hhs.015自身抗毒性物質(zhì)和抗生素的運(yùn)輸具有重要意義。
Hhs.015在受到Valsamali的脅迫時(shí),分泌型和非分泌型的碳水化合物結(jié)合結(jié)構(gòu)域和糖苷水解酶類絕大部分上調(diào)表達(dá)。碳水化合物結(jié)合結(jié)構(gòu)域可以提高酶的催化效率,為Hhs.015的生長(zhǎng)以及抗生素的合成提供必要的能量。真菌細(xì)胞壁中多糖成分占到干質(zhì)量的80%[34],碳水化合物結(jié)合結(jié)構(gòu)域可以特異性結(jié)合多糖底物,包括纖維素、幾丁質(zhì)、淀粉、糖原類等物質(zhì),糖苷水解酶的大量上調(diào)表達(dá)破壞了Valsamali細(xì)胞壁的合成,降低了Valsamali的毒性,同時(shí)能夠高效的抑制Valsamali的生長(zhǎng)[35]。還預(yù)測(cè)到在拮抗過(guò)程中有5種次級(jí)代謝物基因簇的基因大量上調(diào)表達(dá),并且這5種次級(jí)代謝物與已知的物質(zhì)相似性較低。糖絲菌屬為稀有放線菌,近幾年也不斷的從糖絲菌屬中發(fā)現(xiàn)了新的抗菌物質(zhì),比如Tianchimycin[36]、cyanogriside I 和cyanogriside J[37],說(shuō)明在Hhs.015抗真菌過(guò)程中可能還有新的物質(zhì)在發(fā)揮著重要作用。
本研究通過(guò)轉(zhuǎn)錄組分析,揭示了楊凌糖絲菌Hhs.015拮抗Valsamali過(guò)程中發(fā)揮主要作用的通路表達(dá)情況,還預(yù)測(cè)到5種新的次級(jí)代謝物基因簇的基因在抗菌過(guò)程中大量上調(diào)表達(dá)。今后可以分離獲得相關(guān)基因簇的次級(jí)代謝產(chǎn)物,有望獲得高效的抗菌物質(zhì),為防治病原真菌提供新的材料。

