腹瀉驢駒糞源大腸桿菌的分離鑒定及毒力與耐藥性分析
劉璐瑤,肖海俠,茍忻月,張毅,艾柯代·吐魯洪,鄭佳玉,程雪梅,郭慶勇,佟盼盼,蘇戰強
(新疆農業大學動物醫學學院,新疆 烏魯木齊 830052)
我國是傳統養驢大國,隨著驢役用地位的降低,新疆驢的存欄數已由2013年的90.3萬頭急劇下降到2018年的14.8萬頭,6年間存欄數量累計下降83.6%[1]。腹瀉是引起驢駒死亡的常見病因之一[2]。0~6月齡驢駒腹瀉發生現象較普遍,其中大腸桿菌是引起驢駒腹瀉的主要致病菌之一,以體溫升高、劇烈腹瀉、脫水、嚴重時引發敗血癥為主要臨床癥狀[3],導致驢駒生長發育緩慢、生產性能降低,對養殖業造成嚴重的經濟損失。
驢駒腹瀉的發病率和病死率在不斷升高,給驢駒疾病的臨床治療帶來了極大困難[4]。2020年,新疆和田地區某規模化養驢場爆發了驢駒腹瀉病,本試驗旨在探究引起驢駒腹瀉的病原及其臨床耐藥情況,從而為其生產管理和疾病防控提供參考。
1 材料與方法
1.1 試驗材料
1.1.1 病料采集 2020年5月,無菌采集新疆和田某驢場腹瀉驢駒的糞便樣本,低溫保存,及時進行細菌學分析。
1.1.2 主要試劑及儀器 主要試劑:腦心浸出液肉湯(brain heart infusion broth,BHI)、Mueller-Hinton瓊脂(以下簡稱MH)、麥康凱培養基(以下簡稱MH),購自北京鼎國昌盛生物技術有限責任公司;細菌微量生化鑒定管,購自青島高科技工業園海博生物技術有限公司;藥敏紙片,購自杭州濱和微生物試劑有限公司;PCR反應相關試劑(2×TaqPCR Green Mix、ddH2O),購自上海生工生物工程技術服務有限公司。
主要儀器:自動高壓滅菌器(HVE-50)、離心機(Eppendorf AG 22331 Hamburg)、振蕩培養箱(ST-F160AC)、SW-CJ-2F雙人超凈臺,購自上海博訊實業有限公司醫療設備廠;TProfessional PCR儀,購自Biometra公司;凝膠成像系統,購自UniversalHoodll BioRad公司。
1.1.3 試驗動物 健康昆明系小白鼠,18~25 g/只,購自新疆醫科大學醫學動物中心。
1.2 試驗方法
1.2.1 大腸桿菌的分離與培養 將腹瀉樣本接種于BHI培養基中,37℃恒溫培養箱中培養18~24 h。使用接種環蘸取菌液接種于麥康凱培養基,于37℃恒溫培養箱培養18~24 h,挑取不同形態、大小、顏色的單個菌落,革蘭氏染色鏡檢;隨后分別接種于麥康凱培養基和伊紅美藍培養基,37℃恒溫培養箱培養18~24 h,革蘭氏染色鏡檢。純化3~4代后,使用50%甘油保菌,并置于-20℃保存備用。
1.2.2 16S rDNA鑒定 提取純化后的菌株DNA,用16SrDNA引物進行擴增[5](表1)。擴增產物于1%瓊脂糖凝膠在1×TAE電泳液中電泳30 min,凝膠成像系統觀察結果。PCR產物送至鼎國生物工程技術服務有限公司測序,所得序列在BLAST上進行同源性比對。
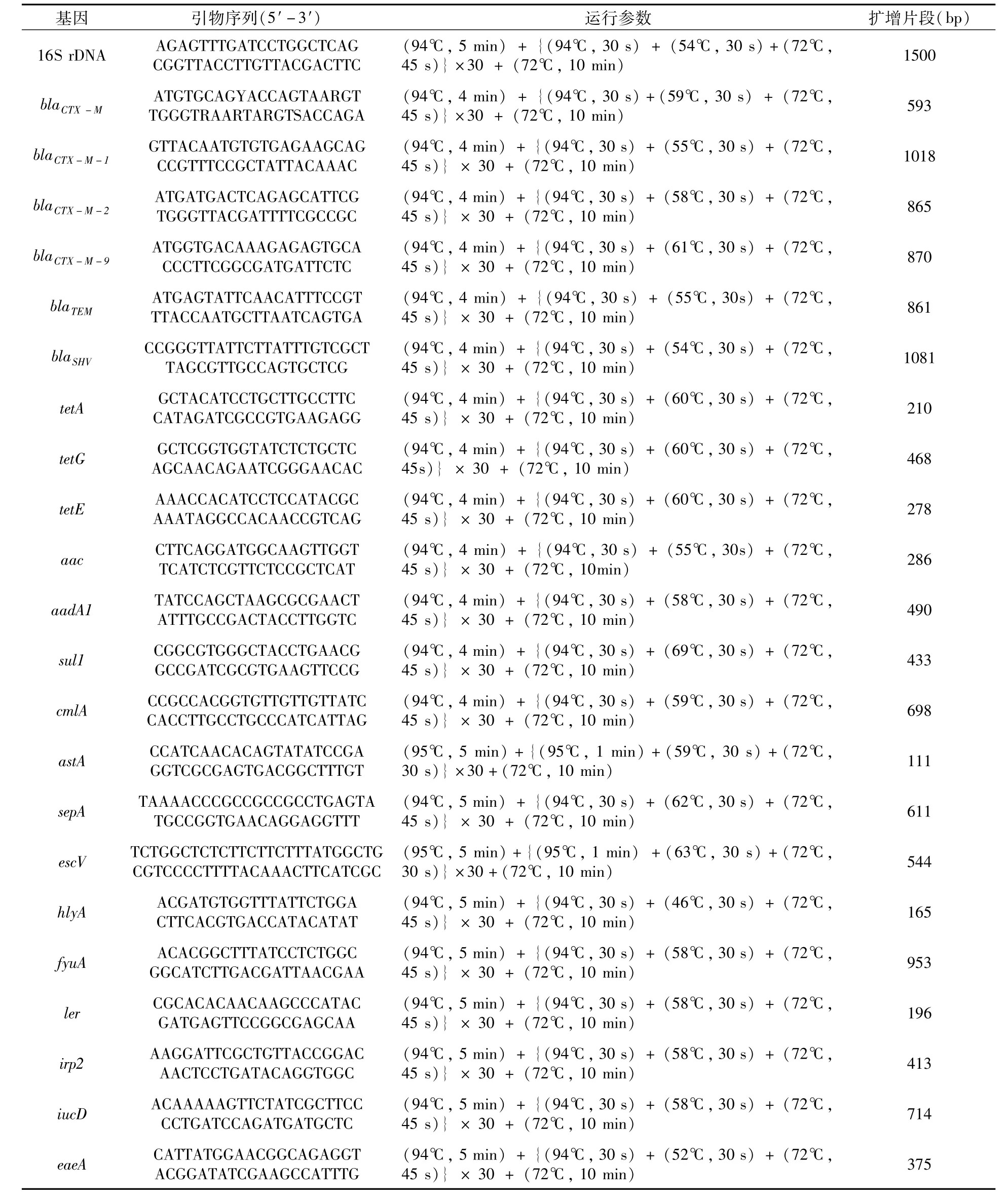
表1 引物序列
1.2.3 生化鑒定 將純化后菌株接種于微量生化鑒定管中,于37℃恒溫培養箱中培養18~24 h,參照《伯杰細菌鑒定手冊》[5]進行結果比較。
1.2.4 藥敏試驗 選取24種常用臨床抗菌藥物,采用Kirby-Bauer紙片擴散法進行。用MH液體培養基稀釋菌液到0.5麥氏濁度,用滅菌棉拭子蘸取菌液均勻涂布在MH培養基表面,靜置3~5 min后用鑷子夾取藥敏片放置在培養基上,靜置15 min后于37℃恒溫培養箱倒置培養24 h。大腸桿菌ATCC 25922作質控菌株,藥敏結果根據美國臨床實驗室國家標準化委員會(NCCLS)制定的標準判定[6]。
1.2.5 耐藥基因和毒力基因檢測 根據相關報道[7-14]引物序列(表1),合成β-內酰胺類藥物的耐 藥 基 因(blaCTX-M、blaCTX-M-1、blaCTX-M-2、blaCTX-M-9、blaTEM和blaSHV)、四環素類藥物的耐藥基因(tetA、tetG和tetE)、氨基糖苷類藥物的耐藥基因(aac和aadA1)、磺胺類藥物的耐藥基因(sul1)和氯霉素類的耐藥基因(cmlA)。根據參考文獻[15-20]中報道的引物序列(表1),合成毒力基因astA、sepA、escV、hlyA、fyuA、ler、irp2、iucD和eaeA。PCR擴增體系(25μL):2×TaqPCR Green Mix 12.5μL,上、下游引物各1μL,DNA模板1 μL,ddH2O補至25μL。擴增后使用1%瓊脂糖凝膠電泳檢測,凝膠成像系統觀察結果。
1.2.6 致病性試驗 將分離菌株接種于BHI培養基,37℃搖床培養18~24 h;用BHI將菌液稀釋至1×108cfu/mL。取昆明小白鼠40只,每5只為一組,隨機分為8組,禁食不禁水12 h后,試驗組腹腔注射菌液0.3 mL/只(A~C組),對照組小鼠注射等量生理鹽水,觀察小鼠在72 h內精神狀態、食欲、發病和死亡情況。
2 結果與分析
2.1 細菌的分離與鑒定
將采集的3份腹瀉驢駒的糞便樣本接種于麥康凱培養基上,共篩選出3株菌,在平板上形態均為紅色、中等大小、表面光滑、邊緣整齊的桃紅色菌落。鏡檢結果顯示,分離菌均呈現單個、著色均勻以及紫紅色兩端鈍圓、無芽孢、無莢膜短桿菌,為革蘭氏陰性菌。經生化鑒定顯示,硫化氫、苯丙氨酸與尿素為陰性,蛋白胨水(靛基質)呈陽性,均能發酵葡萄糖、賴氨酸、鳥氨酸、乳糖與衛矛醇,在西蒙氏枸櫞酸鹽上有個別菌株為陽性,所有生化反應完全符合大腸桿菌的特性。對所得菌株進行16SrDNA PCR檢測,在1500 bp處出現清晰明亮的目的條帶(圖1),將測序結果進行BLAST同源性比對,結合分離菌株在平板生長特點以及生化鑒定結果,最終確定3株分離菌為大腸桿菌。
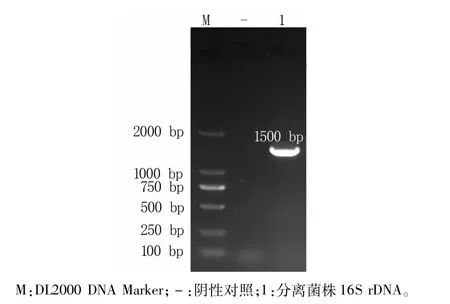
圖1 16SrDNA PCR擴增圖譜
2.2 藥敏試驗結果
藥敏試驗結果(表2)顯示,3株大腸桿菌均對頭孢噻吩、頭孢唑林、氨芐西林、哌拉西林、苯唑西林、青霉素G、四環素、鏈霉素、卡那霉素、慶大霉素、復方新諾明、氯霉素和氟苯尼考表現出100%耐藥,僅對頭孢吡肟、頭孢西丁表現為高度敏感。
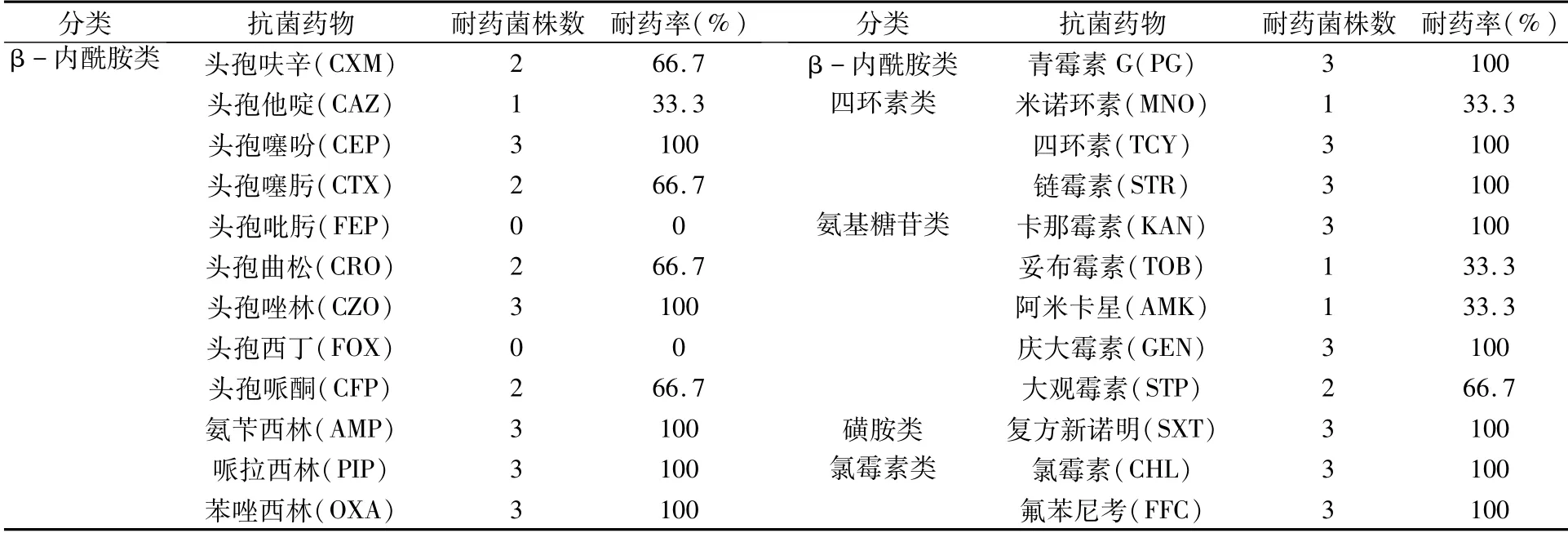
表2 3株大腸桿菌藥敏試驗結果
對菌株的耐藥組合進行歸類,3株大腸桿菌分別對16、18、19種抗生素耐藥(圖2),提示此驢場的抗菌藥物使用不規范,抗菌藥物過度使用。
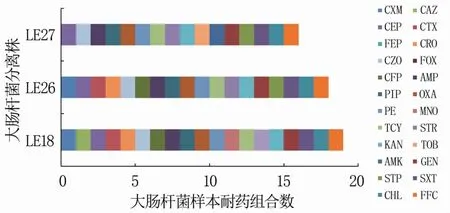
圖2 大腸桿菌分離株對24種藥物的耐藥組合情況
2.3 耐藥基因的PCR檢測
對3株驢駒糞源大腸桿菌進行耐藥基因檢測,結果(圖3)表明,13種耐藥基因共檢測出7種,分別為blaCTX-M-1(100%)、blaTEM(100%)、tetG(100%)、blaSHV(100%)、aadA1(66.7%)、sul1(66.7%)和cmlA(66.7%),未檢測出blaCTX-M、blaCTX-M-2、blaCTX-M-9、tetA、tetE和aac基因。

圖3 耐藥基因擴增圖譜
2.4 大腸桿菌毒力基因的PCR檢測
由圖4可知,9種毒力基因共檢出fyuA(66.7%)、irp2(100%)、iucD(100%)3種,目的條帶大小分別為953、413、714 bp;其他基因均未檢測出。

圖4 毒力基因擴增圖譜
2.5 致病性試驗結果
將純化后的菌液分別腹腔注射小鼠后,試驗組小鼠出現精神萎靡、扎堆、飲食欲下降、被毛粗亂、尿液顏色發黃等現象。A組和B組均死亡4只,C組死亡3只,對照組無小鼠死亡現象;對死亡小鼠進行剖檢,可見胃腸道內充盈黃色膿性液體且腸壁變薄、部分腸管出現臌氣、肝臟出血、脾臟邊緣暗紫色。無菌采集死亡小鼠肝臟等病料,進行革蘭氏染色鏡檢,形態顏色等與大腸桿菌一致,表明從腹瀉驢駒糞便中分離的大腸桿菌均為致病性大腸桿菌。
3 討論與結論
驢養殖業是中央發布的精準脫貧的新興特色產業,由于自然環境和地域經濟等狀況的約束,發病率和死亡率逐年增長,其中驢駒腹瀉病嚴重者可引起驢駒脫水死亡。引起驢駒腹瀉的原因是多因素的。有研究者證明輪狀病毒與霉菌均可引起此癥狀,同時消化不良也可能會引起驢駒腹瀉[21];由大腸桿菌導致的幼駒腹瀉病死亡率為10%~20%[22]。
大腸桿菌是重要的條件致病菌,一般通過糞便的排出從而污染圈舍、飼料、水槽及飲水、運動場地,是驢養殖業的一個重大隱患[23]。有研究證實大腸桿菌可依靠其快速定殖能力迅速侵襲新生幼駒胃腸道系統,表現為持續性劇烈腹瀉,嚴重者表現為出血性腸炎,長期腹瀉易導致機體脫水、電解質紊亂及敗血癥[24]。本試驗從分離出的3株大腸桿菌中共檢出3種毒力基因,分別為fyuA(66.7%)、irp2(100%)、iucD(100%)基因,其中fyuA和irp2的檢出率與黑龍江地區[25]的差異較大。iucD的檢出率遠高于山東地區[26](57%),說明大腸桿菌攜帶的毒力因子分布可能存在地域性差異。小鼠攻毒試驗表明,所有分離株均具有致病性,表明新疆部分地區驢源大腸桿菌的致病性較強。
大腸桿菌的耐藥性隨著人們對抗生素的過度使用呈線性增長,出現了多重耐藥和交叉耐藥的現象,使臨床治療效果越來越差[27]。新疆石河子、沙灣等地區[28]導致犢牛腹瀉的大腸桿菌對頭孢西丁、阿米卡星具有較高敏感性,本試驗中分離株對頭孢他啶、頭孢吡肟、頭孢西丁、米諾環素、妥布霉素和阿米卡星的敏感性較高,說明同一地區、不同動物的糞源大腸桿菌的耐藥較一致。山西省某驢場大腸桿菌僅對青霉素G和多黏菌素B耐藥[29],本試驗分離株對頭孢噻吩、頭孢唑林、氨芐西林、哌拉西林、苯唑西林、青霉素G、四環素、鏈霉素、卡那霉素、慶大霉素、復方新諾明、氯霉素和氟苯尼考共13種臨床常用抗生素高度耐藥,其中1株分離菌對19種抗生素耐藥,說明該驢場大腸桿菌的耐藥性極強,抗菌藥物的不合理使用導致大腸桿菌選擇性地對多種抗生素產生耐藥性[30]。
通過對3株驢駒腹瀉糞源大腸桿菌進行耐藥基因檢測,該驢場的耐藥基因攜帶情況與耐藥表型基本一致。3株大腸桿菌的β-內酰胺類藥物基因(blaCTX-M-1、blaTEM、blaSHV)攜 帶 率 均 為100%,與在廣西地區[31]的檢出率一致。四環素類藥物耐藥基因tetG的檢出率高達100%,與在江西地區[32]檢測結果一致。氨基糖苷類藥物基因(aadA1)、磺胺類藥物基因(sul1)和氯霉素類基因(cmlA)的攜帶率為66.7%,河北地區[33]、貴州地區[34]和四川地區[32]的基因檢出率高于本研究。由此推測,攜帶耐藥基因可能會導致細菌耐藥,臨床上在對驢駒腹瀉病進行治療時,需嚴格控制抗菌藥物使用,先進行藥敏試驗,選擇敏感性較高的抗菌藥物,合理用藥,防止出現廣譜耐藥的“超級細菌”[35]。

