谷氨酸興奮毒性及其調節劑的研究進展
李春艷,趙洪慶,楊 蕙,王葉情,劉 燦,孟 盼,王宇紅
(湖南中醫藥大學科技創新中心,湖南 長沙 410208)
谷氨酸是中樞神經系統中最豐富的神經遞質,也是一種興奮性神經遞質。谷氨酸受體在神經傳遞、神經元興奮性,遞質釋放和長期突觸可塑性中起重要作用。谷氨酸的興奮毒性主要通過過度刺激NMDAR導致的鈣超載而引起。此外,谷氨酸除參與正常的生理、中樞神經系統功能調節,其興奮毒性與多種神經精神疾病相關。接下來,我們首先對谷氨酸及其受體作一介紹。其次,闡述谷氨酸的興奮毒性及其介導的神經元死亡機制。隨后,闡述神經系統疾病如阿爾茨海默病、帕金森病、抑郁癥和癲癇中谷氨酸興奮毒性的簡要潛在機制。最后,綜述目前針對谷氨酸興奮毒性研究的藥物,并對本文進行了總結和展望。
1 谷氨酸及其受體
谷氨酸能突觸被稱為三重突觸,其包括突觸前神經元、突觸后神經元和星形膠質細胞。谷氨酸受體有兩種類型代謝型和離子型。其中,代謝型谷氨酸受體(metabotropic glutamate receptor,mGluRs)存在于突觸前和突觸后神經元上,Ⅰ組為mGluR1和mGluR5,是Gq偶聯的并在突觸后表達,刺激可使突觸后神經元去極化;Ⅱ組為mGluR2和mGluR3,Ⅲ組為mGluR4、mGluR6、mGluR7和mGluR8。第Ⅱ、Ⅲ組mGluRs是Gi/o偶聯的抑制性自身受體,在突觸前和突觸后都有表達,抑制突觸前谷氨酸釋放或突觸后的興奮。離子型谷氨酸受體(ionic glutamate receptor,iGluRs)在突觸前和突觸后均有表達,有3種類型,包括α-氨基-3-羥基-5甲基-4-異噁唑丙酸受體(α-amino-3-hydroxy-5-methyl-4-isoxazol propionic acid receptor,AMPAR)、NMDAR和紅藻氨酸受體(kainic acid receptor,KA)[1]。AMPARs在突觸前起作用以促進突觸和脊柱形成,在突觸后三種離子受體均有表達。
離子型主要受體NMDARs,是谷氨酸門控的陽離子通道,在突觸可塑性、認知、學習和記憶形成中起重要作用。NMDAR是由GluN1、GluN2A-D和GluN3A-B亞基組成的四元結構,形成一個中心離子通道孔。NMDA受體是一種跨膜蛋白復合物,胞外區域中包含氨基(N)-末端結構域(NTD)和含有谷氨酸和甘氨酸相互作用位點的激動劑結合結構域(ABD);跨膜域TMD由3個跨膜螺旋和1個孔環組成,該孔環排列在離子選擇性過濾器上;細胞內CTD參與受體運輸、錨定和信號分子耦合。這些特性將NMDA與其他離子型受體區分開來。首先,NMDAR離子通道受到Mg2+的電壓依賴性阻斷;其次,NMDAR通道具高度的Ca2+滲透性;再次,由于谷氨酸解結合緩慢,它們表現出異常緩慢的動力學;第四,它們的激活不僅需要谷氨酸鹽,還需要共激動劑(甘氨酸或d-絲氨酸);第五,它們配備了一系列調節位點,賦予對細胞外微環境的敏銳敏感性。此外,NMDAR具有特別長的CTD,允許多種細胞內相互作用[2]。
2 谷氨酸興奮毒性介導的神經元死亡機制
谷氨酸的過度釋放使NMDAR持續激活,導致過多的Ca2+流入并激活下游死亡信號通路,最終導致細胞死亡,稱為興奮性毒性。谷氨酸興奮毒性最早是在1957年被發現,胃腸外給藥谷氨酸后觀察到小鼠視網膜的壞死。隨后,谷氨酸興奮性毒性被認為與腦缺血、腦外傷和神經退行性疾病的神經元死亡有關。
生理情況下,谷氨酸信號穩態通過谷氨酸代謝、谷氨酸受體和谷氨酸轉運體的正常調節來維持,后者又分為興奮性氨基酸轉運蛋白(excitatory amino acid transporter,EAAT)和囊泡谷氨酸轉運蛋白(vesicular glutamate transporter,vGLUT)。谷氨酸由2-酮戊二酸通過谷氨酸脫氫酶和谷氨酰胺兩種途徑產生,隨后谷氨酸被vGLUT攝取并儲存在突觸前囊泡中,后者通過突觸蛋白磷酸化轉化為釋放池與突觸前質膜融合,而后將谷氨酸胞吐到突觸中[3]。突觸間隙的谷氨酸通過與離子型和代謝型受體結合來發揮其興奮性神經傳遞作用,但其過量會過度刺激突觸后谷氨酸受體而導致神經元死亡。因此,過量的谷氨酸主要被星形膠質細胞中的EAAT吸收并被轉化為谷胱甘肽,最后在神經元中再次被合成谷氨酸。因此,谷氨酸合成過多和過度釋放及谷氨酸轉運蛋白功能障礙均可導致谷氨酸在細胞外積累,隨后誘導NMDAR興奮毒性并觸發下游死亡途徑,最終導致神經元死亡。
2.1 星形膠質細胞功能障礙星形膠質細胞通過維持谷氨酸的合成、攝取和釋放以及谷氨酸-谷氨酰胺循環來維持谷氨酸的體內平衡[4]。突觸釋放的谷氨酸主要被星形膠質細胞吸收,在星形膠質細胞中,谷氨酸被星形膠質細胞特異性谷氨酰胺合成酶酰胺化為谷氨酰胺。谷氨酰胺然后被釋放到突觸中并被鄰近的神經元攝取,在那里被轉化為谷氨酸和γ-氨基丁酸(gamma-aminobutyric acid,GABA),谷氨酸被重新包裝成囊泡,并再次作為神經遞質在突觸中釋放。突觸傳遞過程中,約20%突觸釋放的谷氨酸到達突觸后NMDAR,而其余的可以到達突觸外空間,在前腦中星形膠質細胞負責突觸間隙中90%的谷氨酸清除。在急性損傷期間,星形膠質細胞可以通過EAAT把細胞外谷氨酸攝取到細胞中進行代謝和回收,從而防止興奮性毒性的產生[5]。
2.2 NR過度激活NMDAR對谷氨酸有很高的親和力,在谷氨酸介導的興奮毒性中起主要作用。突觸前谷氨酸釋放過多,使突觸間隙谷氨酸積累,強直性刺激突觸后谷氨酸受體,產生興奮毒性。然而,NMDARs在神經元存活和死亡中起雙重作用,其可能取決于被激活受體位置和亞型。在受體定位假說中,刺激突觸NMDAR(主要為GluN2A)激活促存活信號通路,而突觸外NMDAR(主要為GluN2B)的激活與促死亡通路相關[6]。刺激突觸NMDAR可激活PI3K/Akt激酶途徑及CREB依賴的基因表達同時抑制死亡基因,其中Akt可使GSK3β以及死亡信號調節子Bcl-2、ASK1和p53失活,而CREB可靶向抗凋亡的BTG2和BCL6以及神經營養因子BDNF。相反,突觸外NMDAR使CREB失活并促發死亡信號[7]。據報道,NMDAR存在于新生兒的神經元和膠質細胞中,發育早期GluN2B占主導地位,而GluN2A在發育后期逐漸增加,最終超過含GluN2B的NMDAR。在這里主要闡述突觸外NMDAR在興奮毒性中介導的死亡信號通路。
2.2.1GluN2B-PSD95-nNOS死亡信號復合物 研究發現,NMDARs通過支架蛋白PSD95與一氧化氮合酶(nNOS)連接形成GluN2B-PSD95-nNOS復合物,進而允許鈣離子從過度激活的NMDARs流入,引起nNOS過度激活,產生一氧化氮(NO)[8]。NO與超氧自由基反應生成高活性氧化劑過氧亞硝酸鹽,導致蛋白質氧化、脂質過氧化和DNA損傷,后者還可觸發線粒體釋放凋亡誘導因子,最終導致DNA斷裂和細胞死亡。PSD95抑制劑Tat-NR2B9c(NA-1),已被證明可使NMDAR與PSD95解偶聯,而兩種小分子ZL006和IC87201主要通破壞過PSD95-nNOS相互作用來解離GluN2B-PSD95-nNOS復合物,減弱下游神經毒性信號[2]。
2.2.2DAPK1介導的細胞死亡 死亡相關蛋白激酶(death associated protein kinase,DAPK1)是一種依賴鈣的蛋白激酶,其活性與細胞死亡相關。當NMDAR過度激活導致鈣內流進而激活DAPK1,同時,活化的DAPK1直接與GluN2B亞單位的細胞內羧基尾部區域(GluN2BCT)的1292-1304氨基酸結合,進一步增強GluN2B的電導,加重細胞興奮毒性,導致神經元死亡[9]。此外,DAPK1可與p53結合介導細胞死亡。目前已開發出干擾肽Tat-GluN2BCT1292-1304和Tat-p53DM241-281分別對DAPK1-GluN2B和DAPK1-p53的相互作用進行干擾,從而減少興奮毒性的損害。
2.2.3其他 鈣內流可激活PTEN,其與GluN2B的GluN1亞單位相互作用,增加了GluN2B的通道電流,并進一步增強PTEN介導的死亡信號復合物的募集。
2.3 Ca2+超載Ca2+穩態失調被認為是谷氨酸興奮性毒性的重要機制。胞內鈣流入和釋放間的穩態通過質膜鈣泵、Na+/Ca2+交換器、肌內質網Ca2+ATP酶和線粒體Ca2+轉運體來維持。但在興奮毒性中,NMDAR過度活化允許鈣持續流入神經元,導致細胞內Ca2+超載,鈣穩態失衡,激活一系列酶和途徑,導致神經元死亡。鈣調神經磷酸酶和鈣蛋白酶是導致神經元死亡的兩個重要的鈣依賴效應物,它們分別介導BH3和p53來觸發凋亡途徑。此外,鈣通過誘導花生四烯酸級聯反應、抑制GABA和耗盡ATP來損傷神經[10]。
2.4 線粒體功能障礙線粒體是導致谷氨酸神經毒性的另一個主要因素。線粒體在生物能穩態和鈣信號調節中至關重要。興奮性毒性引起鈣內流導致線粒體膜去極化,通過消除NMDAR的電壓依賴性鎂阻滯和降低NMDAR激活閾值,從而使非興奮毒性谷氨酸濃度能夠誘導興奮毒性反應。此外,線粒體損傷ATP能量池,使神經元處于低能和氧化狀態,產生大量ROS,激活半胱天冬酶和鈣蛋白酶,最終導致細胞死亡[11]。
2.5 ROS產生谷氨酸受體的過度活化導致ROS及抗氧化力之間的失衡,稱為氧化應激。在興奮毒性情況下,氧化應激是由較高濃度的ROS引起的,這與谷氨酸的神經毒性直接相關。ROS是酶失活、脂質過氧化和隨后的膜損傷、DNA改變和凋亡的介質。ROS的興奮毒性產生與促氧化酶黃嘌呤氧化酶和NADPH氧化酶的激活和線粒體功能障礙有關[12]。此外,ROS通過影響星形細胞谷氨酰胺合成酶和谷氨酸轉運蛋白活性,進而破壞谷氨酸-谷氨酰胺循環和突觸間隙谷氨酸的清除,進一步導致胞外谷氨酸增加。
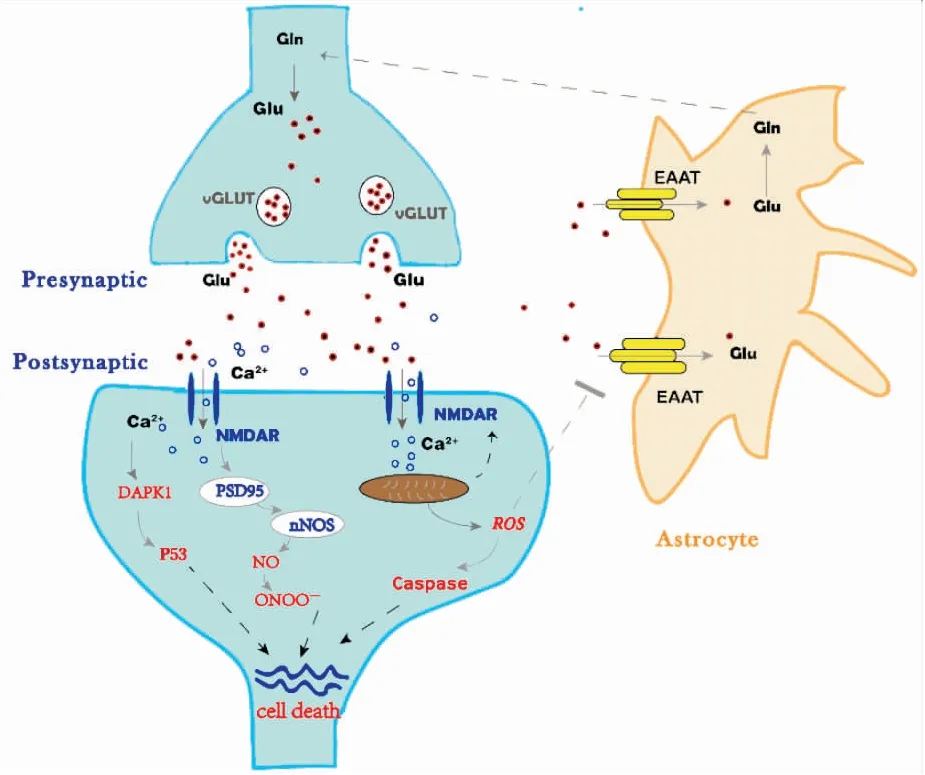
Fig 1 Excitotoxicity mechanism of glutamate
3 谷氨酸興奮毒性在精神疾病中的分子機制
當谷氨酸系統功能障礙時,它會導致神經退行性和神經精神疾病的發生,如AD、PD、抑郁癥和癲癇。
3.1 阿爾茨海默病AD是一種年齡依賴性神經退行性疾病,以β淀粉樣蛋白 (β-amyloid,Aβ)和過度磷酸化的tau蛋白聚集為特征。Aβ的跨細胞擴散會損害神經元Ca2+平衡和線粒體功能,并通過作用于NMDAR和mGluR來破壞谷氨酸能傳遞,從而發揮其病理作用。Aβ還可以增加神經元和星形膠質細胞的谷氨酸釋放以及降低EAAT的表達和功能,致細胞外谷氨酸水平升高激活突觸外NMDAR,誘發致死途徑,產生興奮毒性[13]。
3.2 帕金森病PD是一種常見的神經退行性疾病,臨床癥狀涉及運動(靜止性震顫、運動遲緩)、快速眼動以及自主神經和認知等方面的障礙,其病理特征是黑質的多巴胺能神經元發生變性和路易小體的出現。谷氨酸過度激活NMDAR,導致Ca2+流入加劇ROS水平,導致線粒體損傷,增加了對細胞死亡的易感性[14]。此外,AMPARs和KARs的過度激活導致Na+過載、細胞內高滲透性和急性細胞腫脹,同時自由基的增加對于PD的發病機制尤為重要,因為SNpc(黑質致密部)中的多巴胺能神經元特別容易受到氧化應激的影響[15]。有人提出,細胞死亡途徑始于谷氨酸過度刺激NMDAR并激活,而后具有氧化性谷氨酸毒性的細胞死亡途徑可以把缺乏突觸后谷氨酸受體的神經元殺死,后者所需的谷氨酸濃度高于NMDAR激活所需,表明氧化性谷氨酸可能是興奮病毒級聯反應的一部分,并可能提供一種獨立于iGluR的細胞死亡形式,并且比興奮性毒性造成更大的損害。
3.3 抑郁癥抑郁癥是一種慢性疾病并伴有情緒障礙。研究表明,細胞外谷氨酸水平的增加與抑郁癥有關,通過興奮毒性引起神經元損傷或死亡[16]。抑郁癥中谷氨酸功能障礙的體內證據主要來自質子磁共振波譜(1H-MRS),這是一種檢測神經化學物質的成像技術,能夠評估大腦谷氨酸和谷氨酸/谷氨酰胺水平。此外,一些谷氨酸能基因與情緒障礙有關,包括GRIA3,其編碼AMPA受體;GRIK4和GRIK2,其編碼紅藻氨酸受體;和GRM7,一種編碼代謝型受體的基因。目前,抗抑郁的谷氨酸能調節劑主要有以下幾類[17-18]:(1)廣譜谷氨酸能調節劑:氯胺酮、艾氯胺酮、右美沙芬、右美沙芬奎尼丁、AVP-786、一氧化二氮、AZD6765;(2)GluN2B特異性NMDA受體拮抗劑:曲唑酮MK-0657;(3)甘氨酸位點調節劑:D-環絲氨酸、雷帕斯汀(GLYX-13)、肌氨酸、AV-101;(4)代謝型谷氨酸受體調節劑:AZD2066、RO4917523、JNJ40411813/ADX71149和RO4995819。
3.4 癲癇癲癇是最常見的神經系統疾病之一,其中又以顳葉癲癇為主,特點是局灶性癲癇發作。癲癇發作及神經元的死亡可能與細胞興奮毒性和細胞外谷氨酸水平的增加有關,包括[19]:(1)由EAAT3表達增強并通過增加胞內谷氨酸而導致癲癇發作時谷氨酸釋放的增加;(2)星形膠質細胞谷氨酸轉運體EAAT1和EAAT2表達減少導致細胞外谷氨酸增多;(3)星形膠質細胞功能障礙導致胞外鉀濃度增加和水通道失衡更容易誘發癲癇的發作;(4)谷氨酸引起的鈣超載和線粒體功能障礙導致ROS和NO的產生增加。
4 谷氨酸能系統調節劑
谷氨酸能系統在多種神經疾病中起著如此重要作用,因此,針對谷氨酸興奮毒性,已進行了大量的藥物研究與開發。在這里主要綜述廣譜谷氨酸調節劑、化合物和中草藥天然成分對谷氨酸系統的調節作用。
4.1 廣譜谷氨酸調節劑[20]氯胺酮是一種NMDAR拮抗劑,也是迄今為止最好的谷氨酸能調節劑。氯胺酮與傳統抗抑郁藥不同,其對難治性抑郁癥患者、SRI和SNRI反應遲鈍癥狀以及其他抑郁患者群體具有顯著、持久、快速的抗抑郁獨特效果[21]。在過去5年中,有100多項氯胺酮臨床Ⅲ期試驗,通過聯合療法及多種給藥方案,研究其在術后鎮痛、自殺威脅、產后抑郁癥、難治性抑郁癥、認知功能障礙、精神分裂癥和酒精濫用方面的治療效果。值得注意的是,誤用、濫用和對氯胺酮成癮會導致氯胺酮的幾種急性副作用,表現為消化障礙、視覺幻覺、分離性副作用,甚至肝臟和膀胱損傷。
美金剛是NMDAR拮抗劑,具有快速的開/關動力學,可調節谷氨酸能功能障礙。美金剛在多項臨床Ⅲ期試驗中進行了研究,分別針對AD、雙相情感障礙、缺血性卒中、自閉癥、PD、血管性癡呆和認知障礙等疾病。右美沙芬作為非處方鎮咳藥已使用了50多年,其可阻斷NMDAR,具有抑制谷氨酸興奮性毒性的作用。右美沙芬正被開發為與安非他酮的聯合療法,用于治療重度抑郁癥、難治性抑郁癥和AD。
氯胺酮作為非競爭性NMDAR拮抗劑,急性給藥可對耐藥性患者產生快速而持續的抗抑郁作用,但其如何快速發揮療效,可能與其代謝物密切相關。美金剛通常用于治療中重度AD,但其在其他疾病治療中也表現出優越的效果,然而沒有廣泛應用,可能仍需深入研究具體機制。右美沙芬被認為是非競爭性NMDAR拮抗劑,但其與幾種單胺能受體結合,并可能通過這些受體產生類似于傳統抗抑郁藥的抗抑郁樣作用。總的來說,這些廣譜谷氨酸調節劑繼續開發的潛能仍然非常大。
4.2 化合物作為GluN2B亞基調節劑[22]與廣譜通道阻滯劑相比,亞型選擇性NMDA受體拮抗劑顯示出更高的選擇性和安全性。目前,針對GluN2B亞基的化合物研究一直占據高位。據專利調查顯示,Janssen Pharmaceutica公司提交了6項專利,其中包括639種取代4-氮雜吲哚衍生物、111種吡唑衍生物、118種三唑化合物、另外716種三唑衍生物、612種咪唑并吡啶衍生物和203種吡啶/嘧啶衍生物作為GluN1/GluN2B調節劑。通過競爭性結合實驗和體外功效值來分析化合物對含GluN2B的NMDA受體的親和力并確定化合物的IC50值。其他研究內容還包括化合物的一般合成步驟、質譜、質子核磁共振和鉀通道抑制試驗。
其他公司GluN1/GluN2B亞單位拮抗劑的化合物研究包括二氟乙基吡啶衍生物、雜環化合物、八氫-環戊烯并吡啶類化合物、吡啶衍生物和新型咪唑并吡啶類化合物,通過Ca2+內流分析、HEK293細胞、離體受體占據、hERG通道抑制、腦滲透潛力和小鼠強迫游泳等,對化合物進行生物學評價。主要疾病研究集中在PD、驚厥、重度抑郁癥、雙相情感障礙上。
目前,大多的化合物研發都集中在選擇性靶向NMDAR的亞型,特別是GluN1/GluN2B選擇性變構調節劑。事實上,GluN1/GluN2B化合物調節劑在動物模型中也表現出良好的效果,雖然臨床效果與安全性還有待確認,但其拓展了新結構的治療作用,并推動發現NMDA受體參與新的疾病。
4.3 中草藥成分作為谷氨酸能系統調節劑[23]中草藥成分通過減少谷氨酸釋放來減輕神經毒性。金合歡素是一種源自苦林盤的天然黃酮,通過抑制谷氨酸從Cav2.2和Cav2.1通道的釋放,從而防止海馬的神經毒性。此外,人參總皂苷、松果菊苷和菝葜中的氧化白藜蘆醇通過干擾谷氨酸的釋放來減輕興奮毒性,在AD和癲癇模型中發揮作用。當谷氨酸過度釋放,中草藥成分可通過增加谷氨酸攝取來減少突觸間隙中谷氨酸的濃度,進而預防興奮毒性。大蒜提取物(AGE)、紫草酸鎂(MLB)、丹參酮IIA、五味子乙素、α細辛腦以及人參皂苷Rd和Rb1,通過促進谷氨酸的攝取和增加GLT-1的表達,從而降低興奮性神經元活動。此外,中草藥成分還通過拮抗NMDAR和隨后Ca2+動員來減輕興奮毒性,其中石杉堿甲、MLB、異甘草素以及人參皂苷中成分Rg1、Rb1和Rg3,在PD、AD、癲癇和腦損傷中具有保護作用。此外,三七皂苷R1 (NTR1)、鉤藤堿(RIN)和氧化苦參堿通過調節亞單位NR2B保護神經元免受谷氨酸誘導的興奮毒性,在AD和癲癇中發揮重要作用。
中草藥天然成分在谷氨酸興奮毒性的研究中,表現出巨大潛力,目前已有部分被批準進行臨床試驗,個別已批準用于治療。其中,石杉堿甲在中國已被批準用于治療AD。石杉堿甲的幾項隨機臨床試驗,表明其能改善AD患者的認知功能和日常生活活動。其他正在進行臨床試驗的還有治療PD的人參皂苷Rb1以及治療AD的β-細辛腦。中草藥通過調節谷氨酸釋放、谷氨酸攝取、谷氨酸受體,在臨床前實驗中效果顯著,同時在臨床試驗中也表現出巨大的治療優勢。
5 總結與展望
谷氨酸興奮毒性依賴于多種途徑,這些途徑涉及多種細胞調節機制。主要由谷氨酸變化伴隨的細胞內鈣超載、突觸外NMDAR受體過度激活、谷氨酸轉運體不足、線粒體功能障礙和氧化應激而導致。值得注意的是,也有報道NMDAR誘導的興奮毒性依賴GluN2A和GluN2B二者的過度激活[24]。此外,一些神經退行性疾病AD、PD、抑郁癥和癲癇表現出興奮毒性特征。因此,可以從谷氨酸合成、谷氨酸釋放、谷氨酸傳遞和谷氨酸清除出發,尋找新的治療靶點,通過增強促生存途徑和阻斷死亡途徑減少神經元死亡,治療谷氨酸能系統介導的興奮性毒性。最后,興奮毒性的產生并不只與谷氨酸能系統關聯,還與GABA能系統密切相關,二者的不平衡可能是導致興奮毒性的另一個原因。
目前,GluN1/ GluN2B拮抗劑是迄今為止研究最深入的候選藥物,有望挖掘其巨大的治療潛力。然而,大部分亞型調節劑的臨床研究未能達到理想的效果,可能是體內靶點參與不足,以及動物模型未能正確反映人類疾病。對此,可使用一些先進技術幫助藥物的開發,如GluN1/GluN2B靶向成像探針技術。此外,可看出中草藥天然成分對谷氨酸能系統具有巨大的調節潛力。與合成化合物相比,這些天然產物具有化學多樣性、天然的抗氧化特性、可吸收代謝,可為復雜靶點產生先導候選藥物。然而,在中草藥的天然成分最終成為治療神經疾病的藥物前,還需考慮以下問題,天然成分如何通過血腦屏障增強功效?天然成分的毒副作用大小?天然成分是疾病特異性還是大腦區域特異性或是谷氨酸受體亞型特異性的?明確這些特點,也許可為更復雜的中藥復方開發和走向世界提供新思路。

