應用地諾前列酮出現宮縮過頻取藥時機探討
呼慧蓮,顧 寧,戴毅敏
(南京大學醫學院附屬鼓樓醫院婦產科,江蘇 南京 210008)
引產是自然臨產前啟動分娩的方法,是產科常用的妊娠干預手段。相關研究表明,妊娠晚期伴有母胎并發癥且無陰道試產禁忌者,適時引產分娩才有利于母兒結局[1]。隨著引產方法的改進、臨床安全性的不斷提高和引產指征的放寬,近年來發達國家引產率已高達25%,發展中國家引產率也逐年上升[2]。陰道分娩成功與否取決于宮頸成熟度,控釋前列腺素E2(prostaglandin E2,PGE2)因能有效促進宮頸成熟且使用方便而得到廣泛應用。宮縮過頻是使用PGE2最常見的副反應,發生率約4.8%~17.4%[3-4],可引起宮縮間隙期子宮松弛時間不足,胎盤血流灌注受限,進而導致胎兒缺氧和酸中毒。若能及時取出藥物、使用宮縮抑制劑糾正異常宮縮,則可能減少引產的不良結局[4]。然而,PGE2誘發的早期宮縮可表現為細小而頻繁,也可表現為疼痛性的頻繁宮縮,因此過早取出可致引產失敗,而過晚取出可致產程過快、嚴重產道撕裂、產后出血等嚴重并發癥風險增加[5]。為探討恰當的取藥時機,本研究嘗試增加PGE2取藥時的視覺模擬疼痛評分法(visual analogue scale,VAS),描述宮縮過頻孕婦取藥時的疼痛強度,為臨床安全有效引產提供依據。
1 資料與方法
1.1 研究對象
選取2020年4月至8月在我院接受PGE2促宮頸促熟引產的孕婦為研究對象。納入標準:單胎孕足月頭位初產婦,有終止妊娠指征,胎膜未破,宮頸Bishop評分<6分,孕婦知情同意且自愿接受PGE2促熟且無前列腺素類藥物使用禁忌者。排除標準:使用PGE2前,曾使用過Foley尿管水囊或米索前列醇藥物促熟或臨床資料不全者。收集孕婦的年齡、身高、體重、分娩孕周、宮頸Bishop評分、胎心監護圖形、引產指征等資料,以及產后出血情況、分娩方式、新生兒臍帶血PH值、BE值、新生兒感染和黃疸發生情況。
1.2 促熟引產方法
1.2.1置藥方法
參照PGE2(欣普貝,英國FCT公司生產)說明書,將栓劑置于陰道后穹隆深處,并旋轉90度橫置于后穹隆,臥床30min。
1.2.2監護方法
每3~4h行胎心監護(cardiotocography,CTG)40min,持續9h,依據CTG情況行陰道檢查及增加胎心監護次數。
1.2.3藥物取出
藥物取出標準如下:①出現規律宮縮(1次/3min)同時伴宮頸成熟度的改善;②Bishop評分≥6分;③自然破膜;④宮縮過頻;⑤置藥≥24h;⑥疑為胎兒窘迫:CTG持續為Ⅱ類或Ⅲ類;⑦出現不明原因的嘔吐、腹瀉、發熱或者產前出血等反應。藥物取出時記錄VAS評分及宮頸Bishop評分,記錄用藥的各時間點。
1.2.4其他處理
自然臨產者按照正常產程規范處理;Bishop評分≥6分未臨產者行人工破膜后縮宮素引產。使用PGE2后宮頸仍不成熟者,如有宮縮則予小劑量縮宮素增縮;如無宮縮,則繼續使用藥物促熟引產,但再次促熟后的宮頸評分不記入統計結果中。
1.3 宮縮過頻的處理
①有痛感的宮縮下,如胎心正常,觀察30min無好轉,則陰道檢查取出藥物;②取出藥物后繼續觀察30min,期間予側臥位、吸氧、補液,持續監護,必要時行陰道檢查。對CTGⅡ類者,給予硝苯地平、硫酸鎂或特布他林抑制宮縮;③宮縮過頻伴有持續Ⅱ類或Ⅲ類CTG,經上述處理無好轉,短時間內無法陰道分娩者,急診手術終止妊娠。
1.4 診斷標準
宮縮過頻:10分鐘內宮縮>5次,持續>30min,伴或不伴CTG異常。過頻時長:PGE2促熟直接導致宮縮過頻的持續時間(不包括促熟結束或產程當中的過頻時間)。引產失敗:破膜后,縮宮素引產18h未進入活躍期,或經過充分藥物促熟,使用小劑量縮宮素增縮大于24h但仍未臨產者。羊水異常包括Ⅱ~Ⅲ度或呈血性者。CTG的三級分類按照指南[6],以持續>30min的最高級別圖形為準,由兩位主治以上醫生確認。
1.5 分組和觀察指標
PGE2放置期間出現宮縮過頻需取藥和/或使用宮縮抑制劑者為過頻組,其余則為正常組。比較兩組孕婦的一般特征、用藥情況(藥物放置時長、宮縮過頻時長、放藥至胎兒娩出時長)、母兒結局(催引產及24h內陰道分娩率、羊水污染程度、新生兒體重、5min Apgar評分、新生兒黃疸、感染)。
1.6 統計學處理

2 結果
2.1 兩組孕婦臨床資料的比較
研究共納入226例孕婦,其中宮縮過頻組39例(17.3%),正常組187例(82.7%)。兩組孕婦的身高、體重、分娩孕周、用藥前后宮頸Bishop評分、新生兒出生體重及各項引產指征的差異均無統計學意義(P>0.05),詳見表1。

表1 兩組孕婦臨床資料的比較
2.2 兩組孕婦母兒結局的比較
經宮頸促熟引產后,兩組孕婦24h陰道分娩率的差異無統計學意義(χ2=0.003,P>0.05),但過頻組孕婦的剖宮產率和因引產失敗致剖宮產者均顯著高于正常組,差異有統計學意義(χ2值分別是4.067、4.141,P<0.05)。促熟引產期間,過頻組孕婦較正常組更容易出現胎心監護異常,更容易發生新生兒黃疸,差異有統計學意義(χ2值分別是33.684、4.960,P<0.05);而新生兒臍帶血PH<7.15及BE<-12的情況,以及新生兒感染的差異無統計學意義(χ2值分別是2.143、0.643、0.066,P>0.05),詳見表2。

表2 兩組孕婦母兒結局的比較[n(%)]
2.3 兩組孕婦PGE2用藥情況比較
與正常組孕婦相比,過頻組孕婦持續置藥時間短、取藥時宮頸Bishop評分低(Z值分別是-5.353、-4.276,P<0.05),而宮縮抑制劑使用率高(χ2=128.749,P<0.05)。兩組孕婦的置藥-分娩時長和取藥時VAS評分間的差異均無統計學意義(Z值分別是-0.495、-1.399,P>0.05),詳見表3。

表3 兩組孕婦PGE2用藥情況比較 [M(Q1,Q3),n(%)]
進一步比較兩組患者取藥時間的分布情況,發現過頻組孕婦均在用藥后18h內取藥,其中25例(64%)在8h內即取出;正常組孕婦中,有121例(64.7%)在用藥后18h內取出,50例(27.3%)在用藥后24h取出,詳見圖1。關于兩組孕婦取藥時的VAS疼痛評分比較,過頻組有92.3%的孕婦(36例)取藥時VAS評分在5~8分之間;正常組則有86.1%(161例)的評分在4~8分之間,見圖2。此外,取藥時,VAS在0~3分、4~8分者的剖宮產率分別為61.5%(16/26例)、18.69%(37/198例),差異具有統計學意義(χ2=23.364,P<0.05),見圖3。
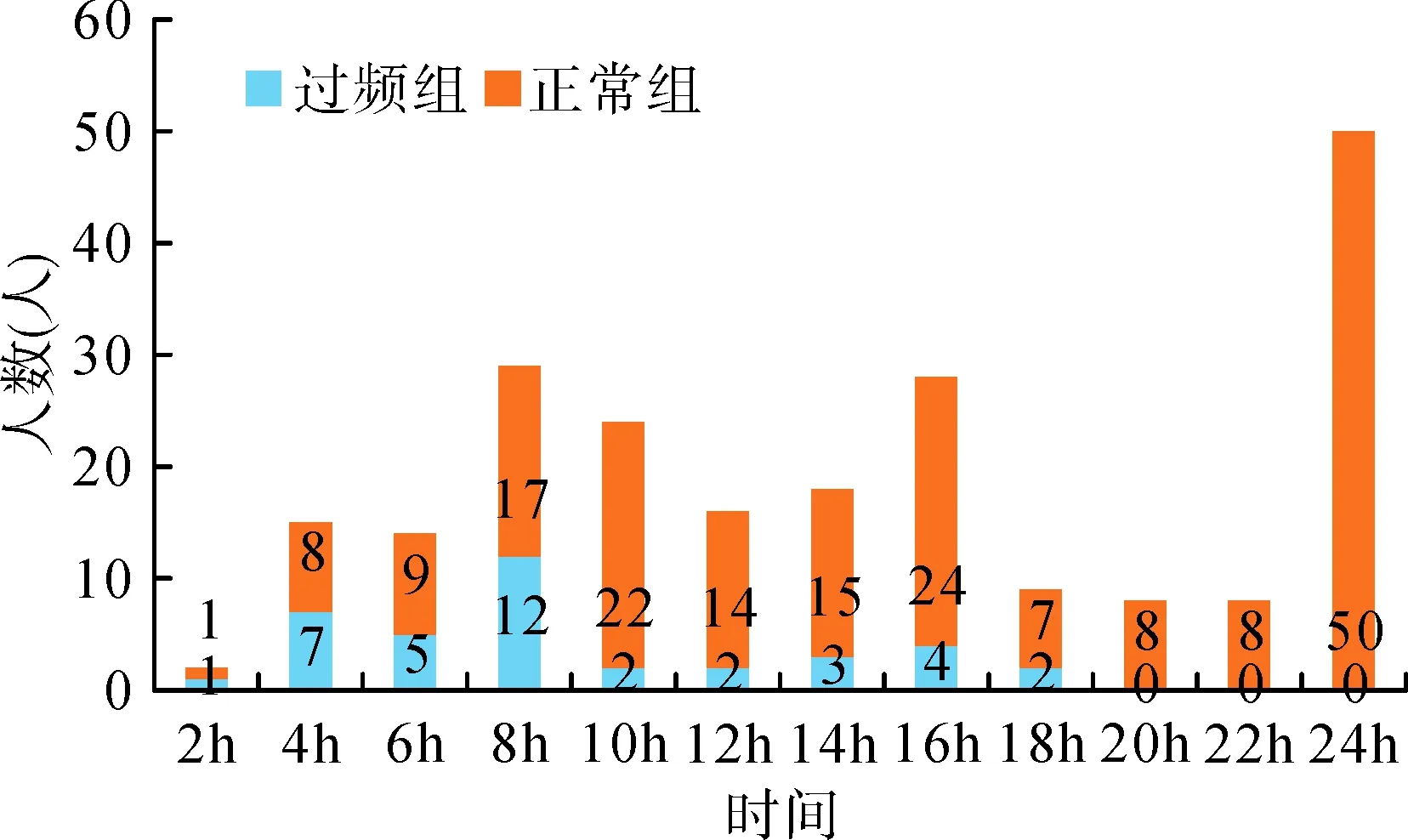
圖1 兩組孕婦PGE2取藥時間的分布情況

圖2 兩組孕婦取藥時的VAS疼痛評分比較

圖3 不同VAS評分下剖宮產情況
3 討論
3.1 PGE2應用廣泛,但宮縮過頻是其引產失敗的主要原因
促宮頸成熟是足月妊娠引產是否成功的重要步驟,常用的方式有給予藥物和機械擴張兩種。藥物方式包括控釋地諾前列酮栓、其他前列素E類藥物、米索前列醇、縮宮素等;非藥物方式主要通過機械性擴張宮頸促使其成熟,如近年來較為常用的宮頸擴張球囊等。有研究認為宮頸擴張球囊引產效果明顯優于控釋地諾前列酮栓[7],亦有研究認為PGE2總體效率高于宮頸擴張球囊[8],不同方式的優缺點有待更多的研究進一步證實。本文通過回顧性研究發現,在胎膜完整的足月單胎頭位初產婦中,PGE2引產的總體陰道分娩率為76.5%,宮縮過頻發生率為17.3%,宮縮過頻者剖宮產率升高,引產失敗為其主要原因。盡管宮縮過頻組孕婦的CTG異常、新生兒黃疸增加,新生兒感染和剖宮產率出現增加趨勢,但新生兒窒息、NICU入住甚至子宮破裂等嚴重并發癥并未增加,與文獻報道結果相符[9],為探討取藥時機和安全引產問題提供了參考。
3.2 結合VAS評分確定PGE2取藥時機提高引產成功率
PGE2在促宮頸成熟過程中難免會出現強弱不等的不規則宮縮,如何規范處理以獲得安全有效引產的方法尚存有爭議性:2013年發布的專家共識指出,置藥后出現細小宮縮為藥物性宮縮,可繼續放置[10],但共識對該類宮縮缺乏頻率、強度、持續時間的定義,以及宮縮過頻難以界定;2014年中華醫學會指南中則推薦,出現宮縮過頻需及時取藥[11],具有臨床干預指征。本研究中首次嘗試結合VAS疼痛評分來描述取藥時間點,結果發現無論是過頻組還是正常組,取藥時的VAS評分中位數均在5分;除外滿24h取藥者后,二組均有85%以上的孕婦取藥時的VAS評分不小于4分,提示VAS評分小于4分者應慎重取藥,以避免引產失敗;而4~8分之間者,即使無宮縮過頻也應行陰道檢查,及時評估宮頸成熟度,適時取藥,以降低不良結局的發生風險。
3.3 結合PGE2藥物特點,制定管理模式,提高引產安全
國內指南和規范表明,引產者均需有醫學指征。進入引產流程者本就是高危妊娠,因此需要頻繁、定期監護,一旦發生宮縮過頻,需要有經驗的醫護人員及時有效處理。可控制釋放PGE2栓劑在設計制作中是以恒定速度進行釋放,但其作用存在峰值。本研究中,過頻組孕婦的取藥時間集中在用藥后8h內,正常組則集中16h內,這很可能與用藥后體內孕激素水平下降集中在4~8h,脫氫表雄酮下降集中在16h的藥代動力學特征相關[12]。因此,我們有如下建議:①合理安排引產時間,晨間8:00前用藥,用藥后8h內可關注是否伴發宮縮過頻,以便在18:00前的白班時間段以及0點午夜前完成大部分中途取藥和評估工作;②由有經驗的醫護人員專職管理、定時監護、定期質控引產的母兒結局。
本研究使用診斷標準依據相關指南和規范,客觀描述研究數據,具有外部推廣價值;引入VAS評分來量化評估宮縮強度,有助于識別取藥時機,但促熟引產過程中有母體和胎兒的多種混雜因素干擾,引入VAS疼痛評分來評估取藥時機是否能改善臨床結局,尚需要前瞻性研究證實。
綜上所述,PGE2宮頸促熟引產是一種高危的產科干預手段,要充分認識PGE2催引產過程、產程的特征和藥物副反應,制定工作流程,采用專人管理模式。早上8點前用藥,結合VAS疼痛評分評價宮縮過頻很可能會有助于提高臨床安全性。
[專業責任編輯:馮 玲]
[中文編輯:李 晶;英文編輯:楊力仁]

