數字化PET/CT病灶探測能力的初探
陶端, 張旭
(1.首都醫科大學,生物醫學工程學院, 北京 100069;2.飛利浦(中國)投資有限公司,高級分子影像業務部,北京 100600;3.首都醫科大學,臨床生物力學應用基礎研究所,北京市重點實驗室,北京 100069)
0 引言
PET/CT成像是基于正電子技術的醫學影像,從分子和代謝水平明確疾病,提升臨床精準診斷的水平,實現更好的多學科聯合診療,提高醫院綜合實力。病灶探測能力與疾病的早發現、早診斷、早治療密切相關[1]。CT的病灶探測能力已達到亞毫米水平,實現了肺微小結節和毛玻璃樣變的精準診斷;但PET/CT的病灶探測能力存在較大差距,還停留在10 mm左右[2-3]。新一代PET/CT因為采用數字化探測器和正則化重建算法,技術飛躍帶來了設備性能全面提升,病灶探測能力有了提高的可能。為了明確新一代數字化PET/CT的病灶探測能力,設計并制造ZT1-10模體,進行PET/CT顯像,進行定性定量以及統計學分析。
1 數字化PET/CT和正則化重建算法
1.1 數字化硅基光電放大器件
數字化PET/CT與傳統PET/CT的硬件區別在于數字化PET/CT探測器,數字化硅基光電放大器件作為光電芯片,與閃爍晶體和電子線路共同構成數字化PET/CT探測器,采用模糊目標函數電壓實時監控技術,時間分辨率提升到310 ps。閃爍晶體與數字化硅基光電放大器件結構上實現了一一對應,對每個光電進行獨立解碼,采集通道數增加50倍,總數超過2萬個[4]。數字化PET/CT探測器的結構如圖1所示。

圖1 數字化PET/CT探測器的結構圖
1.2 正則化重建算法
重建算法是PET/CT的靈魂,PET/CT廣泛采用有序子集似然法和最大極限似然法進行重建運算,伴隨著迭代次數的增加,噪聲增大,信噪比和圖像質量有所降低。正則化重建算法是新重建算法,基于變分以及偏微分的方法,其目標是用一些與原問題相近的良態解去逼近原方程的解,以此來較好地權衡病態解。首先建立含先驗知識的正則化目標函數,再對這個函數求極值,得到的解就是重建解。正則化重建算法的核心思想是通過引入圖像的先驗分布信息,將迭代次數限制在一個合理的數目中,得到高質量圖像,是數字化PET/CT的靈魂[6]。
1.3 正則化重建的流程
PET/CT的原始數據采用表模式存儲,正則化重建過程中將多種校正糅合其中,最終得到衰減校正后與無衰減校正的斷層數據,重建流程如圖2所示。
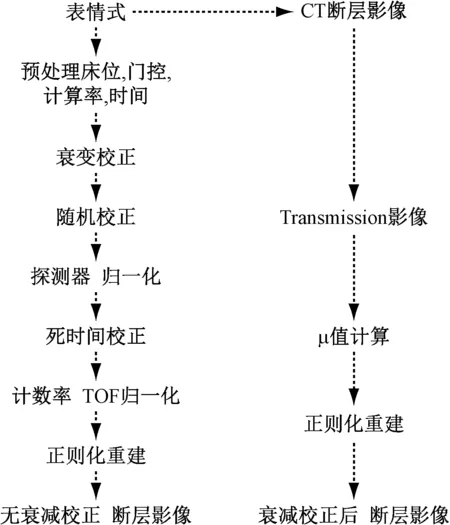
圖2 正則化重建的流程
2 ZT1-10模體的PET/CT顯像
2.1 ZT1-10模體的設計與制造
為更細致了解PET/CT的病灶探測能力,需要設計并制造新模體,命名為ZT1-10模體。ZT1-10模體分玻璃管、支架和外桶等3個部分,10根玻璃管內徑不同,最大內徑為10 mm,按1 mm逐個遞減,最小內徑為1 mm,模擬不同大小的病灶。支架為上下有蓋的圓筒,直徑140 mm,高度140 mm,上下蓋均開10個孔,用以垂直放置玻璃管。外桶高260 mm,內徑175 mm,壁厚2 mm,上方廣口,下方平底。ZT1-10模體實物照如圖3所示。

圖3 ZT1-10模體實物照
2.2 ZT1-10模體的灌注
分別配制不同比活度的放射性溶液,比活度較高的放射性溶液注入1~10 mm的玻璃管內,形成熱區,模擬病灶。比活度較低的放射性溶液注入外桶,形成本底,模擬肌肉組織[7]。PET/CT臨床應用最廣的是葡萄糖代謝顯像,腫瘤對FDG攝取能力高于肌肉組織對FDG攝取能力,大約在4倍左右,基于此,熱區放射性溶液與本底放射性溶液兩者比活度的倍數比設置為4∶1。
倍數比設定后,不會隨著時間變化而變化,因為較高比活度的放射性溶液在發生衰變的同時,較低比活度的放射性溶液也同時發生衰變,相同的放射性核素,半衰期完全相同,即便擱置3~5個半衰期,倍數比都保持不變。灌注ZT1-10模體熱區的長針注射器如圖4所示。

圖4 灌注ZT1-10模體熱區的長針注射器
2.3 顯像設備與質控
選擇飛利浦公司Vereos作為數字化PET/CT的代表,為了對照,另選擇飛利浦公司Gemini作為非數字化、傳統PET/CT的代表。為保證圖像質量和定量準確,PET/CT設備質控包括全面檢測和每日質控。全面檢測包括PET/CT系統空間分辨率、時間分辨率、能量分辨率、散射分數、靈敏度、NECR、圖像質量多項指標,提前1個月邀請廠家資深工程師進行檢測,確認達標。每日質控包含的項目有PET基線核查、PET探測器的增益調整、時間分辨率核查、能量分辨率核查、SUV標準攝取值準確性核查、CT球管預熱、CT空氣校正、CT值核查等,早晨9點前完成每日質控,確保實驗當天的圖像質量和定量準確。相關機架如圖5、圖6所示。

圖5 Vereos PET/CT的機架

圖6 Gemini PET/CT的機架
2.4 ZT1-10模體的顯像
將灌注好的ZT1-10模體轉運到PET/CT機房,在Gemini或Vereos 2臺PET/CT分別進行掃描采集,PET/CT是雙模融合影像設備,采集流程包含3個步驟:首先是定位片掃描,方便指定掃描范圍和計劃;第二步為CT螺旋掃描,得到CT斷層影像;第三步為PET步進掃描,得到PET斷層影像。采集重建參數參考表1。采集完成后,重建得到PET/CT斷層數據,然后導入后處理工作站,進行融合對比顯示。

表1 兩臺PET/CT的采集和重建參數
3 數據分析
3.1 PET/CT斷層影像
圖7為ZT1-10模體的PET/CT斷層影像,左為Gemini,右為Vereos。在Invert-greyscale色譜顯示下,玻璃管內影像上表現更黑,因為玻璃管內放射性比活度更高。

圖7 兩臺PET/CT的斷層影像
3.2 視覺評分法與統計分析
采用視覺評分法明確PET/CT的病灶探測能力,評分標準采用三分法,熱區清晰可見為2分,隱約可見為1分,看不見為0分。邀請5位經驗豐富的PET/CT中心醫生參與閱片,在不告知PET/CT型號、不告知采集重建參數的前提下,參考評分標準進行打分。單獨評分完成后,再將5位醫生的分值進行求和,得到總分,見表2。

表2 兩臺PET/CT,ZT1-10模體熱區的視覺評估總分
圖8是對2臺PET/CT熱區進行視覺評估所得總分繪制的折線圖。橫坐標為10個熱區的直徑,直徑從1 mm到10 mm;縱坐標為視覺評估的總分。帶三角形的實線上可見,Vereos的1 mm熱區為0分,2~3 mm熱區落在5~8分這個區間,4~10 mm熱區都為10分;帶圓圈的虛線上可見,Gemini的1~7 mm熱區均為0分,8 mm熱區為7分,9~10 mm熱區為10分。

圖8 兩臺PET/CT熱區視覺評估總分的折線圖
統計軟件使用SPSS 22.0,計量資料經檢驗,數據不滿足正態分布,配對資料兩組間差異性分析采用兩相關樣本非參數檢驗,檢驗水準定義為0.05。統計分析結果Z等于-2.410,P等于0.016,P<0.05,差異具有統計學意義。
3.3 TBRmax定量法與統計分析
靶本比(Target Background Ratio,TBR)是熱區內放射性比活度與本底區域內放射性比活度的比值,是PET/CT病灶探測能力的定量指標。最大靶本比最能反映病灶探測能力,其計算式為
TBRmax=Hmax/Bmax
(1)
其中,TBRmax為最大靶本比,Hmax為熱區勾畫ROI測量得到放射性比活度的最大值,Bmax為本底區域勾畫ROI測量得到放射性比活度的最大值。
圖9直觀展示10個熱區TBRmax的差異,帶圓圈的虛線為Gemini,帶三角形的實線為Vereos。伴隨著熱區直徑變小,TBRmax值均呈下降趨勢。4∶1倍數比下,Vereos的4 mm熱區TBRmax為2.37,5 mm熱區TBRmax為2.83,6~10 mm熱區TBRmax均大于3.0,最高達3.72。Gemini的8 mm熱區TBRmax為1.50,9 mm熱區TBRmax為2.30,10 mm熱區TBRmax為3.21。

表3 兩臺PET/CT,ZT1-10模體熱區的TBRmax定量
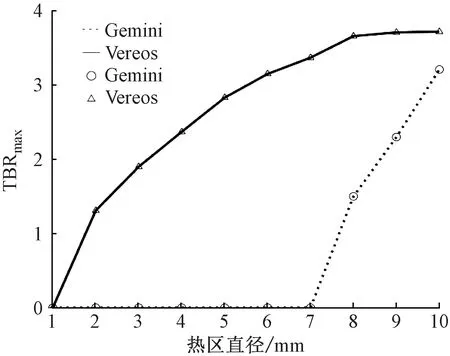
圖9 兩臺PET/CT熱區TBRmax的折線圖
統計分析結果Z等于-2.666,P等于0.008。P<0.05,差異具有統計學意義。
4 總結
原創設計并制造了ZT1-10模體,是評估PET/CT的病灶探測能力新模體,用于明確PET/CT小病灶的探測能力。模體研究采用視覺評分法和最大靶本比定量法,數字化PET/CT能清晰發現直徑3 mm的小病灶。正則化重建算法和數字化PET/CT探測器帶來了更好更優秀的病灶探測能力,可更好地實現疾病的早診斷、精準分期,為分子影像進入疾病超早期診斷帶來可能[8]。

