基于TCGA數據庫研究腫瘤突變負荷與膀胱癌的相關性
羅雪顏,王光明
大理大學第一附屬醫院基因檢測中心,云南 大理 671000
膀胱癌是目前世界上最常見的惡性腫瘤以及泌尿生殖系統第二大常見的惡性腫瘤。估計每年有356000 例新增病例和145000 例死亡病例,且具有復發傾向,患者診斷后需要終生進行身體監測[1]。膀胱癌根據治療模式及疾病預后不同可分類為非肌層浸潤性膀胱癌(non-muscle invasive bladder cancer,NMIBC)、肌層浸潤性膀胱癌(muscle-invasive bladder cancer,MIBC)和轉移性膀胱癌(metastatic bladder cancer,MBC)。NMIBC 為 大 多 數 患 病 類 型,約 占70%,其余的MIBC 患者占30%因發生遠處轉移而死亡風險較高,預后效果比NMIBC 明顯更差。一直以來,膀胱癌的治療仍然進展甚微,在過去的30 年里,臨床醫生通常采用以下兩個方案對患者進行治療,第一是以順鉑類藥物展開化療,第二是對患者采取手術方案進行根治性膀胱切除術或選擇采用保留膀胱的手術。但治療術后達50%的患者會死于遠端轉移,總體來說這類患者5 年生存率不高于30%[2]。有研究表明,采用鉑類化療藥品聯合化療的方案對于MIBC 患者提高生存率并沒有太大的體現[3]。此外,腎功能受損以及其他并發癥的伴隨,臨床上認為這部分的MBC 患者不適合用一線順鉑化療的治療方案[4]。近年來,免疫療法在MIBC和MBC患者的治療中用于治療難治性或不符合鉑類化療的膀胱癌有了一個新的突破方向,體現了潛在的臨床應用前景[5]。
研究發現,腫瘤突變負荷(tumor mutation burden,TMB)是一種新興的以微衛星不穩定性為特征的癌癥生物學標志物,被認為是針對腫瘤免疫治療有反應的預測因子,在不同的癌癥當中表達不同[6]。根據定義,TMB是每百萬堿基當中檢測出的體細胞突變的累計總數,也是腫瘤細胞基因外顯子編碼區中每兆堿基發生突變的總數,包括置換、插入、缺失這幾種突變類型[7]。高度突變的腫瘤被認為具有免疫原性和新抗原負荷,這兩個因素被認為對免疫治療有反應[8]。先前的研究表明,高TMB 的患者對免疫療法的療效反應明顯更好[9]。因此,TMB 可能被作為潛在生物標志物應用于預測腫瘤行為和免疫治療療效評估[10]。本文將對TMB與膀胱癌的相關性展開研究。
1 資料與方法
1.1 膀胱癌數據獲取 癌癥基因組數據庫(the cancer genome atlas,TCGA)是一項癌癥基因組學計劃,可提供公開可用的數據,有助于前沿癌癥的研究。從2021年6月15日的TCGA數據庫中篩選出膀胱癌患者的基因表達譜和相關臨床病理數據,包括膀胱癌的轉錄組學數據、突變數據和臨床數據。本次研究的樣本包括414個膀胱癌組織樣本和19個正常組織樣本。
1.2 突變特征和臨床數據的提取 用R 軟件(版本3.6.3)的MafTools 功能包將提取的數據可視化,并探索突變數據的特征。通過使用目標編碼區域的大小除以計數的突變數來計算出每百萬堿基的體細胞突變總數。膀胱癌患者生存時間、生存狀態、年齡、性別、腫瘤分期、分級和TMN分期的數據從臨床資料庫獲取。然后用R 軟件(版本3.6.3)繪制曲線表達生存期,分析TMB表達與臨床資料的相關性。
1.3 差異表達基因分析 根據中位TMB值的大小將TMB 組分為高TMB 組和低TMB 組,使用“Limma”包識別與TMB 相關的差異基因,導出所有FDR<0.05 和|log2FC|>1.0 的差異基因,“heatmap”包用于執行層次聚類,繪制熱圖。
1.4 基因通路富集分析 根據TMB中位數將基因轉錄組數據分為高低TMB兩組,通過基因集富集分析(gene set enrichmentanalysis,GSEA)軟件進行KEGG(kyoto encyclopedia of genes and genomes)和GO (gene oncology)富集分析,設定隨機組合次數為1000次。以標準化富集分數(NES)>1、標準化顯著性水平(NOM) P<0.05和矯正多重假設檢驗(FDR)q<0.05為判讀標準。
1.5 TMB 與免疫細胞的關系分析 從小提琴圖中獲取標記的免疫細胞,不同分組的免疫細胞亞群利用不同的顏色代表。基于RNA-seq 表達數據,利用新開發的CIBERSORT 評分方法,采用Wilcoxon 秩和檢驗分析高TMB組與低TMB組浸潤性免疫細胞的占比差異,并通過Vioplot 函數包進行數據可視化,對比分析兩組間CD8+T 細胞、記憶激活CD4+T 細胞、靜息的NK細胞和靜息的肥大細胞的表面標記的差異來評估每位患者中22個免疫細胞的比例。
1.6 統計學方法 采用R 軟件(版本3.6.3)和Bioconductor包,總生存期分析采用Kaplan-Meier和對數秩和檢驗,亞組差異分析采用Wilcoxon 檢驗或Kruskal檢驗。以P<0.05判定差異具有統計學意義。
2 結果
2.1 膀胱癌的突變特征 首先將TCGA 數據庫獲得的突變數據可視化后可知超過94.9%的患者存在突變,其中最多的是錯義突變。突變類型中以SNP居多。在SNV 中,最常見的是C>T,其次是C>G。單個樣本突變頻率的中位值為128,最高突變頻率為3398(圖1)。瀑布圖揭示了TCGA 膀胱癌體細胞突變的整合狀態,突變基因排在前十位的基因分別是:TP53、TTN、KMT2D、KDM6A、ARID1A、MUC16、PIK3CA、RB1、SYNE1、HMCN1 (圖1)。通 過 對 比 數 據 發 現TP53、TTN、KMT2D的突變率居前三位(圖2)。突變的互斥基因在膀胱癌中是TP53基因和FGFR3基因,TP53 基因與突變的RB1基因共突變。突變的TTN基因與突變的FAT4、ATM、MACF1、HMCN1、PIK3CA和MUC16 基因間均存在共突變。突變的KMT2D 基因與突變的KMT2C基因也存在共突變的現象(圖3)。
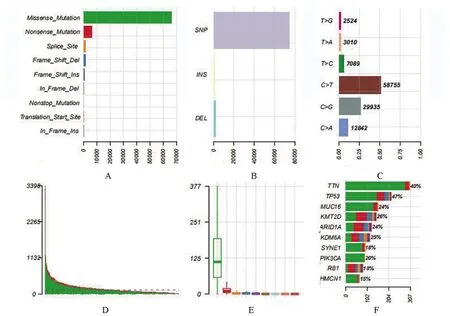
圖1 膀胱癌體細胞突變可視化圖
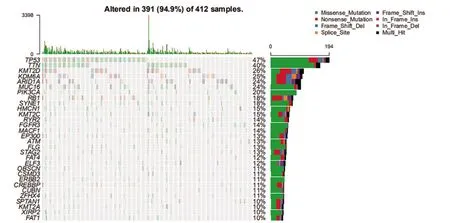
圖2 膀胱癌前30位突變基因突變圖
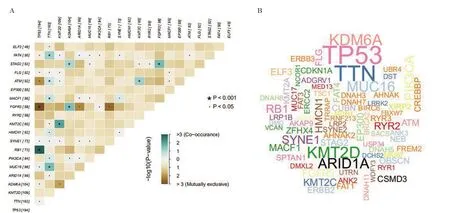
圖3 膀胱癌突變基因的相關性
2.2 膀胱癌的TMB 與臨床的相關性 通過計算每個膀胱癌樣本每百萬堿基的TMB數量,將患者分為高TMB組和低TMB 組。Kaplan-Meier 分析用于評估膀胱癌中TMB與預后生存期的潛在相關性,結果顯示TMB(P=0.006,圖4)與預后生存期相關,高TMB 患者預后較好,表明患者對免疫反應的影響較好。TMB在患者性別(圖4,P=0.016)和腫瘤分級(腫瘤細胞分化程度,圖4,P<0.001)兩方面具有相關性。TMB的表達在男性膀胱癌患者中高于女性膀胱癌患者(P=0.016)。此外,腫瘤分級顯示高分級的膀胱癌(P<0.001)的患者TMB值越高。膀胱癌病理分期、TMN分期與TMB之間差異無統計學意義(圖5)。

圖4 腫瘤突變負荷與臨床特征相關性
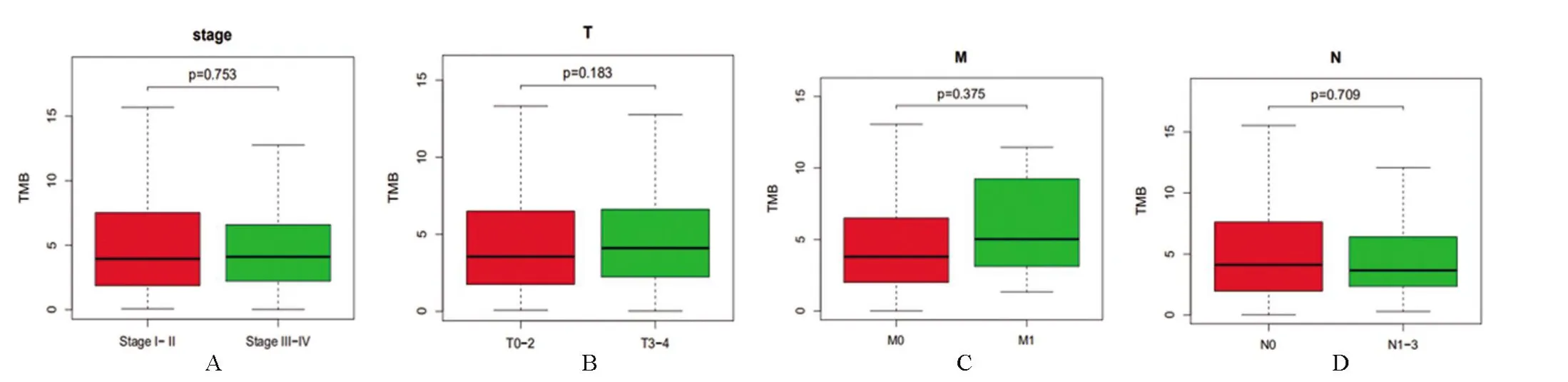
圖5 腫瘤突變負荷與臨床病理特征相關性
2.3 差異表達基因分析結果 從免疫學和ImmPort數據庫中下載免疫相關基因1778 個,篩選得出69 個免疫相關的差異表達基因。選擇高低組熱圖中顯示的前40 個顯著差異基因(圖6),以|log2FC>1|,FDR<0.05關注基因在高低TMB組中的表達差異,觀察到高TMB 組中的基因組表達水平通常會下降。
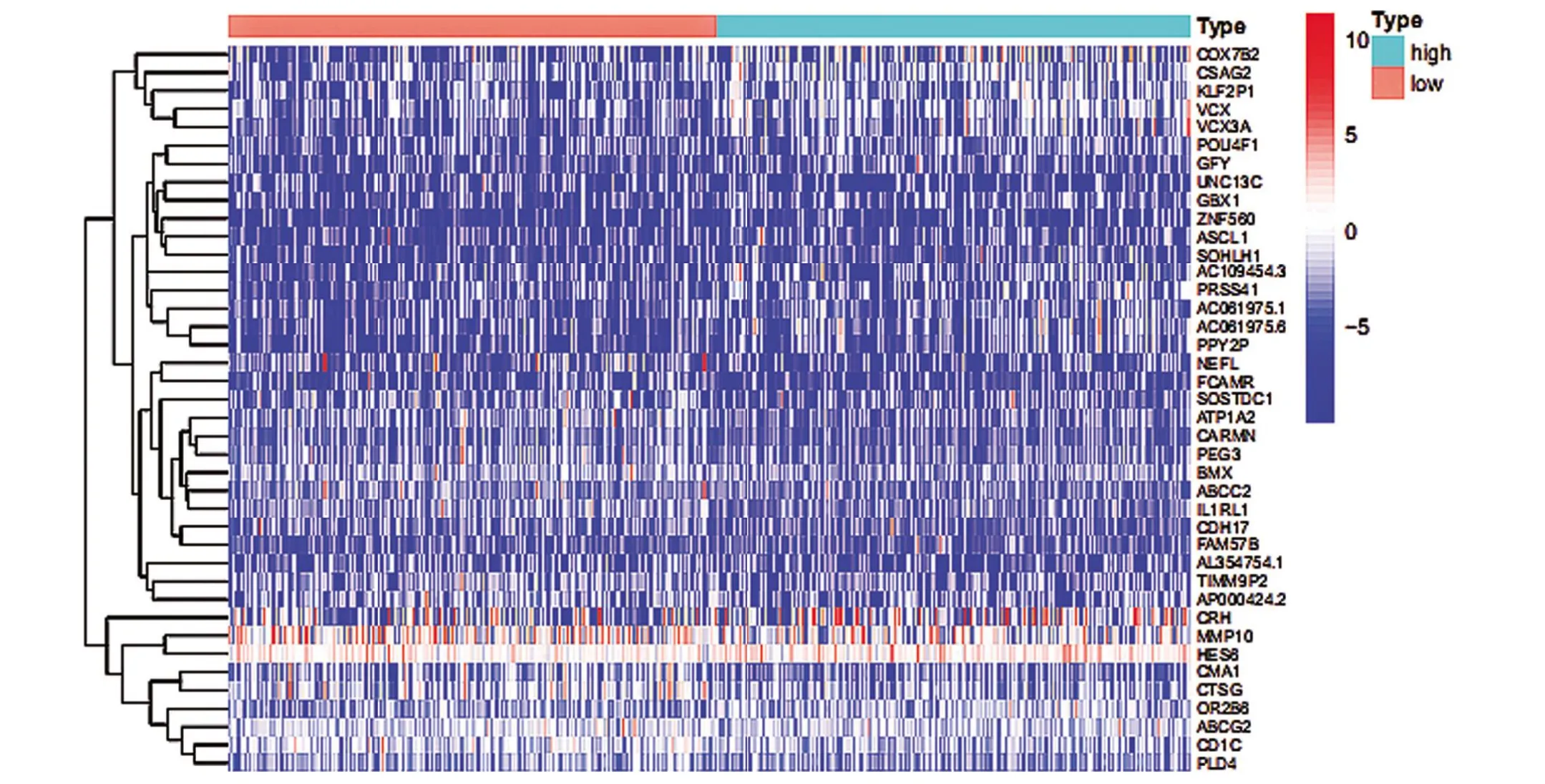
圖6 差異基因的熱圖
2.4 GO 和KEGG 富集分析結果 進行GO 富集分析以闡明DEGs 的生物學功能,如圖7 所示,GO 通路顯示激素代謝過程、心肌組織發育、內分泌過程和全身動脈壓調節在生物過程組明顯表達;細胞成分組成富集在膠原蛋白細胞外基質、神經肌肉接頭;受體配體活性、G 蛋白偶聯受體結合、糖胺聚糖結合等方面與分子功能富集相關。腎素-血管緊張素系統、細胞因子-細胞因子受體相互作用、趨化因子信號通路顯示DEGs 主要富集于KEGG(圖8)通路。GO 和KEGG 的豐富結果表明,這些差異基因可能與細胞周期、核分裂、DNA復制或其他功能途徑有關。
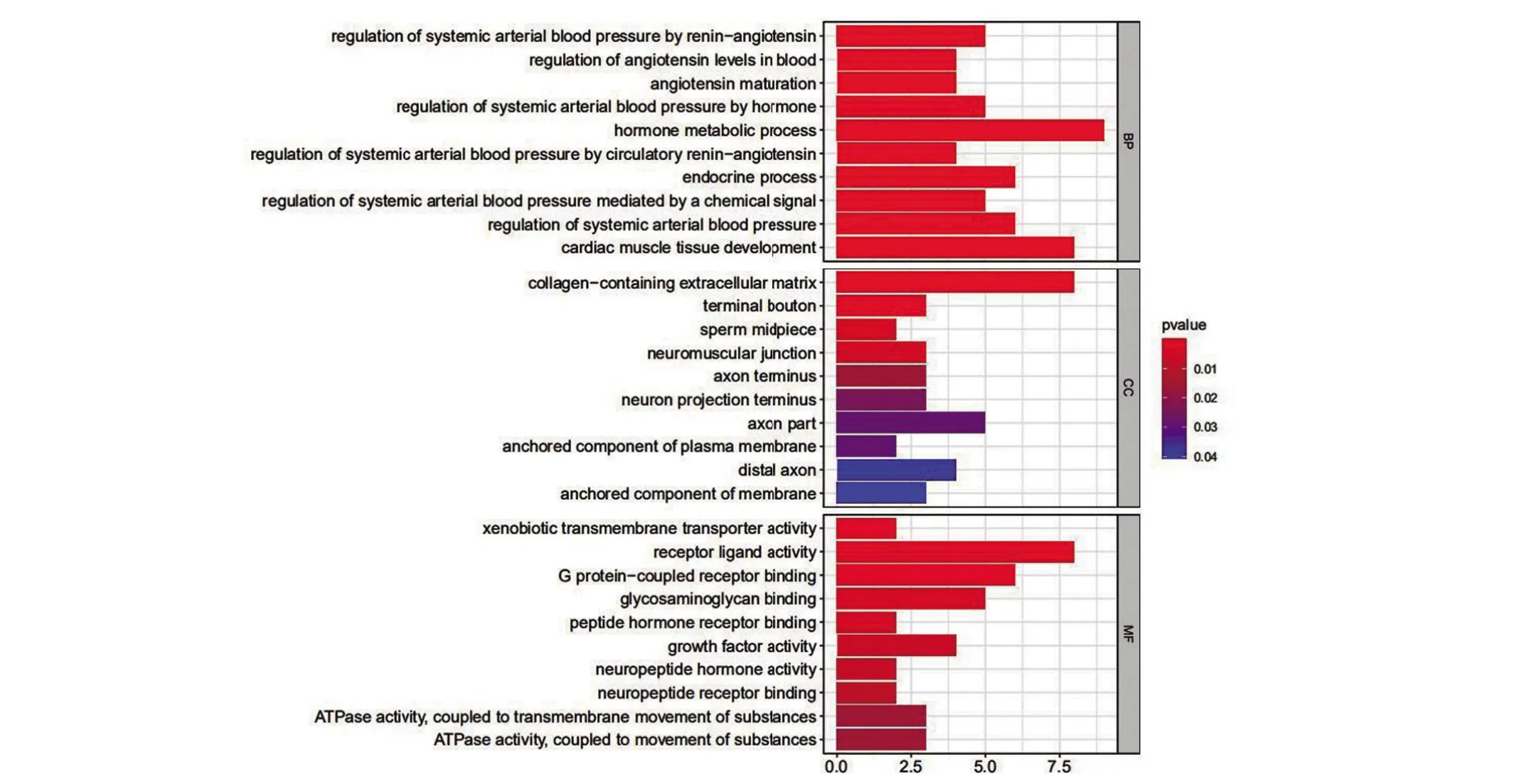
圖7 GO富集
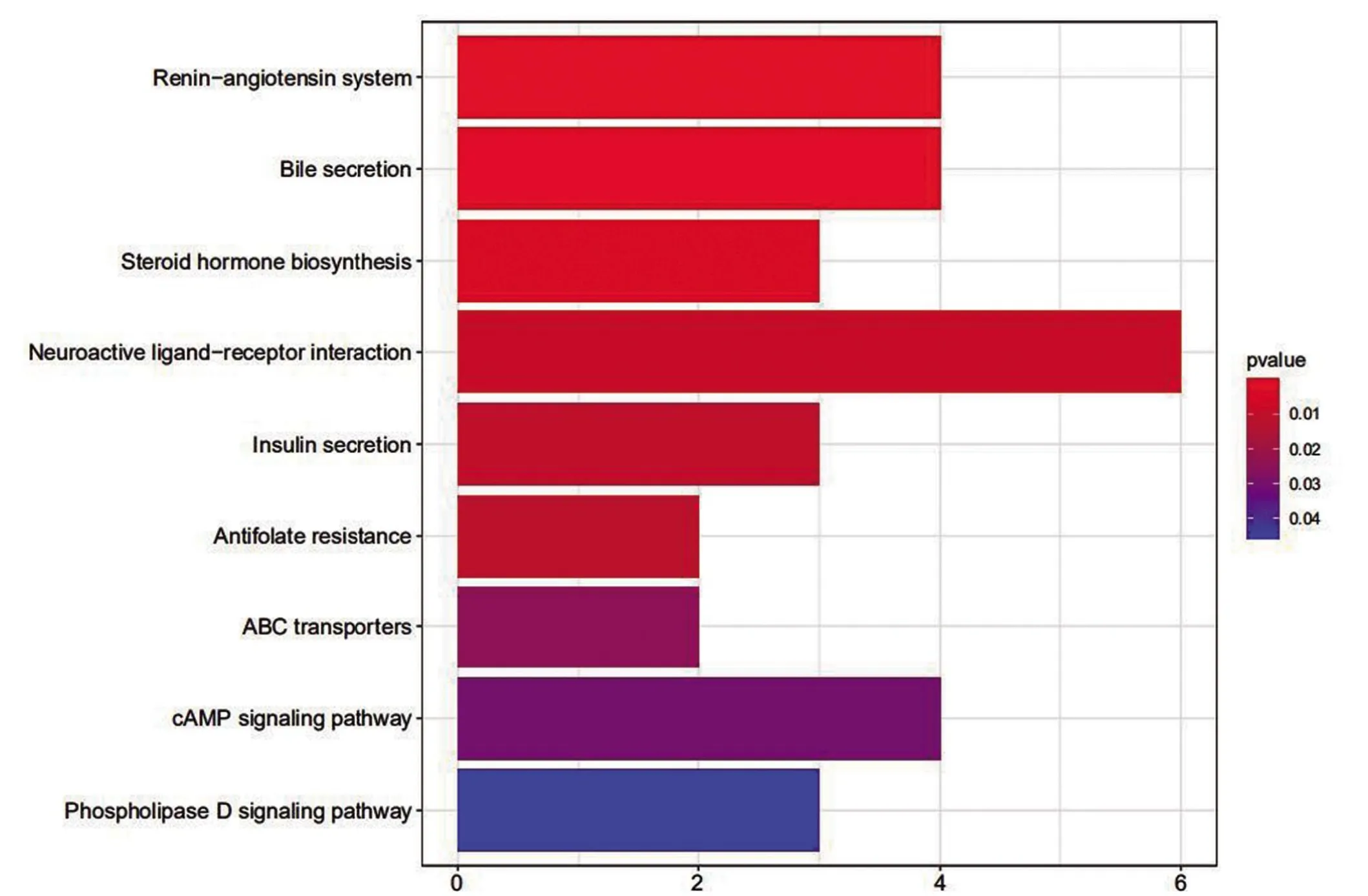
圖8 KEGG富集分析
2.5 TMB 與免疫細胞的相關性 基于RNA-seq表達數據,運用新開發的CIBERSORT方法,評估每位患者22 個免疫細胞的比例,并在方框圖中顯示結果,其中不同的顏色代表了不同的細胞亞群(圖9)。Wilcoxon 秩和檢驗表明,較高的浸潤分別(圖10)表現在高TMB 組的CD8+T 細胞(P=0.001)和記憶激活的CD4+T 細胞(P=0.004)。然而,高TMB 組靜息肥大細胞的密度卻明顯較低。因此,與低TMB 樣本組比較,高TMB 的樣本中CD8+T 細胞,激活的記憶性CD4+T細胞和靜息的NK 細胞含量較高,而靜息的肥大細胞含量較低。鑒于在膀胱癌樣本中評估兩種TMB水平的免疫細胞差異豐度,進一步討論TMB相關的免疫細胞是否具有預后價值。圖11顯示,膀胱癌中的預后相關的免疫細胞可能是CD8+T細胞(P=0.006)。
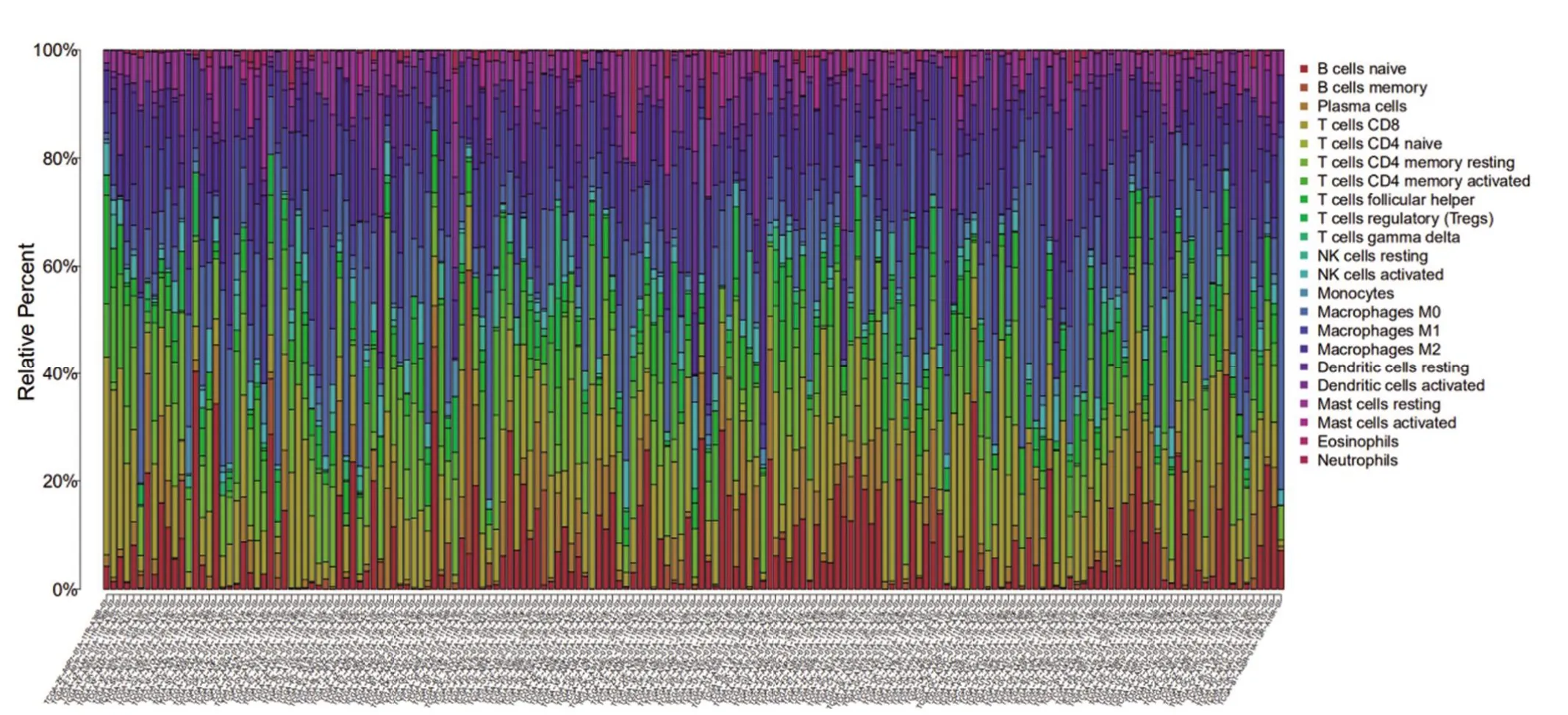
圖9 來自CIBERSORT算法的22種免疫細胞亞型的評估分數匯總
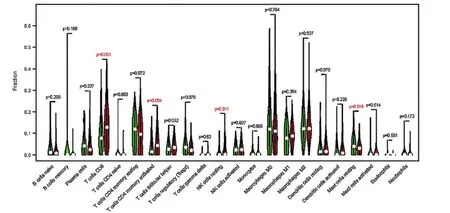
圖10 高低TMB組22種浸潤性免疫細胞的表達
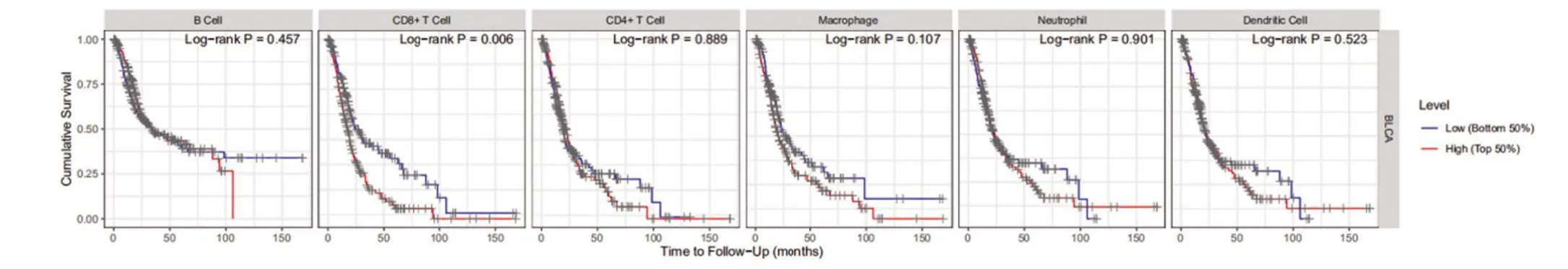
圖11 高低TMB組中6種免疫細胞與生存的關系
3 討論
膀胱癌是全世界第9 位最常見的癌癥,并且具有較高發病率和死亡率。晚期或轉移性膀胱癌患者的5 年生存率僅為15%左右,特別是采用順鉑的聯合化療的MBC患者,目前尚無有效的二線治療方法,導致MBC患者的預后仍然較差[11]。有研究表明,膀胱癌是美國醫療系統中人均治療費用最高的癌癥[12],極大的治療費用給患者及其家庭帶來巨大的經濟負擔,此外,逐年增長的患病率、治療范圍有限的傳統治療方式等都使得膀胱癌免疫治療方面的研究存在難度。
腫瘤的發生是一個復雜的過程,涉及與腫瘤微環境中免疫細胞相互作用的基因改變[13-14]。先前的研究表明,免疫檢查點分子抑制劑開啟了膀胱癌免疫治療的可能性,對肌肉侵襲性和轉移性膀胱癌的免疫治療提供了可能[15],例如抗程序性死亡-1 (PD-1)和抗CTLA-4 抑制劑,對局部晚期轉移性BLCA 的治療有重要影響[16]。最近的研究將膀胱癌與腫瘤突變負荷聯系起來[17],研究TMB與高免疫原性腫瘤之間的相關性可能有助于評估免疫治療的效果。此外,有研究還發現膀胱癌與免疫環境有關。然而,仍需進一步探究來評估免疫療法在膀胱癌中的有效性。
先前的研究已經證明錯義突變和SNP 在膀胱癌在內的各種癌癥類型中發生、進展和預后中的重要性[18]。本研究結果表明,錯義突變、SNP 和C>T 突變是膀胱癌中最多見的三種突變形式。三個最常突變的基因是TP53、TTN和KMT2D。TP53是常見的腫瘤抑制基因之一,據報道其可通過調節細胞周期從而抑制癌細胞的發展[19]。本研究發現,突變頻率最高的基因是TP53基因,達到了47%。TTN是編碼肌節的基聯蛋白基因,與擴張型心肌病可能存在關聯,在腫瘤發生過程當中的作用有待進一步研究[20]。TTN基因突變頻率達到了40%,KMT2D的突變頻率達到了26%,排在了突變基因的第三位。KMT2D是一種已知的癌癥相關蛋白,可調節腫瘤生長和轉移,從而影響預后。在膀胱癌中,KMT2D作為腫瘤抑制因子發揮作用,起到抑制腫瘤細胞的活力、遷移和侵襲的作用[21]。研究膀胱癌的TMB 發現腫瘤分級高的患者TMB 評分較高,高TMB患者的生存期預后明顯好于低TMB患者。這些結果表明,高TMB的表達對改善膀胱癌患者的預后生存很重要。
本研究通過分析DEGs 的潛在生物學功能,發現GO富集分析結果表明GO功能主要表現在:生物過程分組富集在激素代謝過程,心肌組織發育,內分泌過程和全身動脈壓調節;膠原蛋白細胞外基質、神經肌肉接頭與細胞成分表達分組相關;受體配體活動、G蛋白偶聯受體結合、糖胺聚糖結合與分子功能相關。這表明TMB 及差異表達基因可能與膀胱癌的進展相關。另外,KEGG 富集通路分析顯示DEGs 主要富集于腎素-血管緊張素系統、細胞因子-細胞因子受體相互作用、趨化因子信號通路。這表明TMB 及TMB 相關的基因和膀胱癌微環境變化密切相關。
先前研究表明,CD4+T細胞和CD8+T細胞可抑制腫瘤生長,形成腫瘤免疫原性[22]。在研究中發現,高TMB 組的CD8+T 細胞、CD4+記憶激活T 細胞和靜息的NK細胞的浸潤豐度比低TMB組顯著增加,而靜息的肥大細胞的浸潤豐度顯著下降。這些結果表明,CD8+T細胞、CD4+T細胞、靜息NK細胞浸潤水平較高的患者更有可能出現更好的免疫治療效果和預后,目前肥大細胞在膀胱癌中的作用尚未明確。這些發現還推測CD4+T 細胞、CD8+T 細胞和NK 細胞可能是膀胱癌患者抗腫瘤免疫的主要參與者,表明TMB能影響免疫細胞的浸潤,推測新抗原的出現可作為吸引免疫系統的效應細胞。
本研究對TMB 在膀胱癌中的相關性進行闡述,通過TCGA 數據庫分析表明在高TMB 的膀胱癌患者中免疫治療表現出較好的預后,存在潛在的應用前景;初步分析免疫細胞在膀胱癌腫瘤微環境中的表達差異可預測其在膀胱癌識別、治療和預后中的臨床意義,為膀胱癌的免疫治療在臨床上的應用提供理論基礎,但仍需更多的臨床實驗研究來進一步驗證。

