容積旋轉調強放射治療在直腸癌患者中的應用
花威,張先穩,茅冬俊,陳婷婷(通信作者)
江蘇省蘇北人民醫院腫瘤科 (江蘇揚州 225001)
近年來,我國直腸癌的發病率呈不斷升高的趨勢,主要發病原因可能與人們生活水平的提高及飲食和行為習慣的改變相關[1]。目前,手術仍是治療直腸癌患者的主要方式,而放射治療主要用于新輔助和輔助治療前[2]。容積旋轉調強放射治療(volumetric modulated arc therapy,VMAT)作為一種較先進的放射治療技術,具有高效、快捷的特點。其在各類惡性腫瘤放射治療中的應用中均已有報道,且相關研究表明,與傳統調強技術相比,VMAT具有更好的靶區適形度和均勻性,能夠縮短治療時間,減少危及器官的受量[3-5]。VMAT在直腸癌放射治療中的報道多局限于放射治療計劃中的劑量學比較,罕見計劃驗證方面的分析。基于此,本研究將從治療計劃系統(treatment planning system,TPS)計劃值和COMPASS系統驗證結果來探討VMAT在直腸癌中的應用效果,現報道如下。
1 資料與方法
1.1 一般資料
回顧性分析2019年11月至2020年12月于我院行放射治療的10例直腸癌患者的臨床資料,其中男7例,女3例;年齡41~69歲,中位年齡58歲;臨床分期為Ⅲ期,疾病類型為腺癌。本研究經醫院醫學倫理委員會審核批準。
1.2 儀器設備
美國VARIAN IX直線加速器,Eclipse13.5治療計劃系統;美國GE公司大孔徑CT;比利時IBA公司COMPASS三維劑量驗證系統;德國PTW公司UNIDOSE型劑量儀,有效測量體積為0.6 cm3的指形電離室。
1.3 CT定位及靶區勾畫
患者取仰臥位,采用真空墊行體位固定,中心設置在大體腫瘤幾何中心,并利用激光線畫體表標記線;同體位下,采用GE大孔徑CT行增強掃描[經肘正中靜脈高壓注射80 ml碘海醇注射液(揚子江藥業集團有限公司,批準文號 國藥準字H10970358,規格 按碘計100 ml︰30 g),速率為2.5ml/s],設置層厚為5 mm,掃描上界為第2腰椎,下界為坐骨結節下8 cm,掃描后將CT圖像傳輸到Eclipse13.5治療計劃系統進行三維圖像重建。
定位后,由放射治療科醫師勾畫靶區,大體腫瘤區(gross tumor volume,GTV)為CT影像所見直腸原發腫瘤和局部轉移淋巴結區域;臨床靶區(clinical target volume,CTV)包括直腸腫瘤及局部可能發生淋巴結轉移的區域,直腸腫瘤上下界各擴4 cm或下界至肛門口,上界達第5腰椎下緣,淋巴引流或可能侵及的部位包括骶骨前、直腸上動脈周圍、髂血管周圍區域、閉孔區及部分精囊腺、前列腺或子宮和膀胱后壁1/3;計劃靶區(planning target volume,PTV)為受患者體位變化、器官移動等因素的影響,在CTV基礎上各方向擴展5~7 mm的區域。膀胱、小腸、股骨頭等結構則被定義為危及器官(organs at risk,OARs)。
1.4 計劃設計與驗證
采用15 MV X線,設計單弧VMAT計劃,以逆時針旋轉,起始角度為179°、終止角度為181°、機頭轉角為15°、治療床轉角為0°、最大劑量率為600 MU/min,采用各向異性分析算法,以及等中心照射方式。PTV處方劑量DT為5 000 cGy/25 F/5 W。計劃優化目標:PTV小于107%的處方劑量,最小劑量大于95%的處方劑量;小腸30%的體積受照劑量D30%<3 000 cGy,最大受照劑量Dmax≤4 500 cGy;膀胱D50%<4 000 cGy;股骨頭D5%<4 500 cGy。
利用VMAT計劃生成質量保證(quality assurance,QA)計劃,其劑量驗證分為兩部分:利用指形電離室驗證測量等中心絕對劑量,以及利用COMPASS系統驗證相對劑量[6]。Gamma分析中的約束限制:相對劑量偏差3、距離偏差3 mm,以γ<1為通過。驗證值與計劃值的比較:兩者差異[7]PD=100%×(Dcal-Dn)/Dn,其中,PD為差異百分比,單位為%;Dn為利用COMPASS系統測量的劑量,單位為cGy;Dcal為Eclipse13.5治療計劃系統計算的劑量,單位為cGy。
1.5 計劃評估
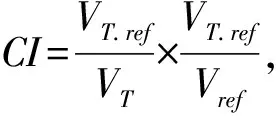
2 結果
2.1 等中心絕對劑量、γ通過率
利用指形電離室測量計劃等中心絕對劑量,發現其準確率達(99.12±0.73)%;利用COMPASS系統分析PTV和OARs的γ通過率,發現PTV的γ通過率達95%以上,OARs的γ通過率達96%以上,見表1。

表1 靶區和OARs的γ通過率
2.2 靶區和OARs的各指標評估結果
PTV的HI、CI分別為(1.06±0.03)、(0.90±0.05),均勻性和適形度均較好,V95%為(97.93±1.21)%,劑量驗證結果顯示,PTV各評價指標差異在4.3%以內;OARs的評估參數均滿足放射治療臨床劑量學要求,其中,膀胱和小腸的V40僅為(20.31±4.23)%和(7.81±3.15)%,低劑量區范圍較高,V20為(92.22±4.33)%和(51.24±4.41)%,Dmean分別為(2 772.54±235.82)cGy和(2 425.75±176.72)cGy,小腸的Dmax稍高,為(4 567.44±156.43)cGy,股骨頭D5%也在4 000 cGy以內,劑量驗證結果顯示,膀胱、小腸、股骨頭的各指標差異在4.4%以內,見表2。

表2 靶區和OARs的各指標評估結果
3 討論
放射治療包括外照射和內照射,目前,臨床對直腸癌的放射治療主要為外照射,其能夠降低直腸癌局部復發率,提高局部控制率,是治療直腸癌患者的主要手段之一。外照射無論是在直腸癌術前、術后,還是晚期姑息治療中均具有重要的意義。但在采用外照射實施放射治療時,可能會對盆腔臟器造成放射性損傷,導致患者出現腹瀉、腹痛、直腸出血等癥狀,影響生命質量,嚴重時甚至導致患者死亡,例如,小腸受射線照射的劑量和體積對急性放射性腸炎的發生具有重要影響。直腸癌靶區形狀相對規則,劑量梯度變化相對較小,在靶區的劑量分布和對小腸、膀胱、股骨頭的受量保護方面,調強技術即可實現。但采用常規調強技術實施治療的時間較長,且治療過程中易發生不確定因素,會對治療精度造成影響。近年來,VMAT技術因其“快、準、優”的特點被廣泛用于臨床放射治療中。Yadav等[3]、Zhang等[4]、張矛等[10]的研究報道,VMAT在宮頸癌、食管癌、鼻咽癌中可達到或優于調強放射治療(intensity-modulated radiotherapy,IMRT)的靶區劑量分布,在一定程度上減少OARs的受照劑量,且出束時間較短。VMAT在直腸癌放射治療中的研究也有類似報道[11-12],但其受限于不同放射治療計劃的劑量學比較。在IMRT計劃中,由于劑量梯度變化大、多葉光柵動態運動,可能會導致較大的計算誤差。精確放射治療時代要求IMRT計劃實施前均需進行劑量驗證,待滿足劑量要求后方可實施。因此,VMAT是否適用于直腸癌放射治療需要劑量驗證研究的支持。
VMAT是在加速器機架旋轉過程中,通過多葉光柵連續運動產生一系列子野,并通過劑量率改變、機架旋轉速度改變,從而形成可變束流來完成的一種IMRT方式,因此,其具有動態調強和旋轉照射的特點。在進行VMAT計劃設計時可優化的條件較多,如機架旋轉速度、弧旋轉度數、機頭角度、多葉光柵、劑量率等,這就對計劃設計和驗證提出了更嚴格的要求。COMPASS三維劑量驗證系統是通過將二維電離室矩陣懸掛在機頭上,隨機頭旋轉保持相對位置不變,來實時探測射野的通量,過程中無角度依賴的問題,適用于VMAT計劃的驗證。COMPASS系統最重要的特點是可使用測量的照射野通量在患者CT圖像上重建劑量分布,且充分計算組織的不均勻性,反映患者體內感興趣區域的真實受照狀況。其可呈現真實的劑量分布,向放射物理師和放射治療醫師提供劑量體積直方圖及三維劑量評估的Gamma分析[13-15]。
自VMAT技術被應用以來,國內外許多研究顯示其優于三維適形放射治療,與傳統IMRT相比,VMAT因具有旋轉特性,布野自由度大,所以獲得的靶區劑量分布趨向更加緊密,靶區的適形度更好,并能夠降低與靶區相鄰OARs的高劑量受照體積[3-7,10]。劉路等[11]的研究表明,VMAT計劃的CI為0.92,優于固定野調強,膀胱和腸道的低劑量區受累體積減小,高劑量區無優勢。Cilla等[16]的研究表明,在局部晚期直腸癌新輔助放射治療中,相較于三維適形放射治療,VMAT可明顯降低小腸受量。殷麟等[12]的研究表明,VMAT計劃的HI和CI明顯優于IMRT計劃,并可降低小腸的高劑量區受照體積,同時急性不良反應發生率及等級均較低。本研究結果顯示,VMAT計劃具有良好的劑量學分布, PTV的HI、CI分別為(1.06±0.03)、(0.90±0.05),V95%為(97.93±1.21)%,同時OARs受照體積呈現出高劑量區低、低劑量區高的趨勢,與上述研究報道相似。另外,腸道不良反應的發生受小腸受射線照射劑量和體積的影響較大,原因為,入射角度多,使劑量趨于分散,VMAT計劃中小腸的Dmean明顯降低,本研究結果顯示,小腸的Dmean僅為(2 425.75±176.72)cGy。本研究通過COMPASS劑量驗證所得靶區、膀胱、小腸、股骨頭的各指標差異均在4.4%以內;此外,劑量驗證還顯示,等中心絕對劑量的準確率達(99.12±0.73)%,PTV的γ通過率達95%以上,OARs的γ通過率達96%以上,完全滿足直腸癌放射治療對輻射劑量學的要求。

