CoCl2誘導低氧對奶牛胎盤滋養(yǎng)層細胞活性的作用
張真豪,袁夢儀,付博凡,高玉平,肖龍菲,倪和民,郭凱軍,蘇 月,安 紅,王相國*
(1.北京農(nóng)學院 動物科學技術學院,北京 102206;2. 北京市昌平區(qū)動物疫病預防控制中心,北京 102206;3.天津市薊州區(qū)下倉鎮(zhèn)人民政府,天津 301905)
在不同生物體和組織器官中,低氧應答結果對機體的影響具有兩面性[1]。由于妊娠初期滋養(yǎng)層細胞浸潤程度淺,胚胎與母體之間物質(zhì)交流建立不完整,螺旋動脈尚未重塑,胎盤滋養(yǎng)層細胞未完成轉(zhuǎn)化而形成完整的血管系統(tǒng),使該階段胎盤組織處于相對低氧環(huán)境中[2-4]。
以往關于低氧對人和小鼠的胎盤滋養(yǎng)層細胞影響的研究表明,滋養(yǎng)層細胞功能受PLGF調(diào)節(jié)。PLGF作為血管內(nèi)皮生長因子之一,能促進血管生成并調(diào)節(jié)內(nèi)皮細胞增殖[5],但其對滋養(yǎng)層細胞的調(diào)控作用受滋養(yǎng)層細胞局部微環(huán)境影響[6]。PLGF缺失或抑制雖然能減少新血管產(chǎn)生,但不影響血管的發(fā)育[7]。體外試驗發(fā)現(xiàn),PLGF通過作用于微血管內(nèi)皮細胞與臍靜脈內(nèi)皮細胞,促進其遷移與增殖[8]。研究證實,PLGF能使內(nèi)皮細胞中DNA合成顯著上升,誘導內(nèi)皮細胞激活[9]。在早孕期,胎盤絨毛內(nèi)合體滋養(yǎng)細胞中的PLGFmRNA表達較強,但在孕晚期胎盤血管合體膜中的PLGFmRNA表達最豐富[7]。為了調(diào)節(jié)內(nèi)皮細胞功能、增強胎盤血氧供給,滋養(yǎng)層細胞合成大量PLGF[10,11]。目前,低氧對人類胎盤滋養(yǎng)層細胞生長發(fā)育的影響已有相關報道,但關于低氧對奶牛胎盤滋養(yǎng)層細胞影響還少見報道。就此系統(tǒng)研究了低氧狀態(tài)對奶牛胎盤滋養(yǎng)層細胞造成的一系列影響,旨在為奶牛胎盤發(fā)育研究提供試驗依據(jù)。
1 試驗材料與方法
1.1 試劑與儀器
試驗動物細胞:奶牛胎盤滋養(yǎng)層細胞系(hTERT-BTC)由北京農(nóng)學院動物科學技術學院動物育種與輔助生殖團隊前期構建[12]并保存。
胎牛血清:杭州四季青公司。逆轉(zhuǎn)錄試劑盒cDNA KIT、熒光定量試劑盒SYBR均為日本Toyobo公司。BCA蛋白定量檢測試劑盒:北京Leagene公司。DMEM/F12培養(yǎng)基:美國Hyclone公司。兔抗人hTERT單克隆抗體和兔抗人E-Cahderin單克隆抗體為美國Abcam公司。轉(zhuǎn)染試劑Lipofectamine2000為美國Invitrogen公司。引物合成:上海生工公司。CO2恒溫培養(yǎng)箱314819-1280美國Thermo公司,熒光定量PCR儀G8830A美國ABI公司,凝膠成像儀721BR09549美國AlphaInotech公司,B2型生物安全柜BCM-1300A蘇州安泰空氣技術有限公司,高速臺式低溫離心機ALLEGRA-64R德國Eppendorf公司。
1.2 建立CoCl2誘導的細胞低氧模型
將奶牛胎盤滋養(yǎng)層細胞接種于24孔板,培養(yǎng)至細胞密度達到70%~80%,加入0、50、100、150、200、250 μg/mL的CoCl2篩選培養(yǎng)基,培養(yǎng)基每3 d更換1次,觀察細胞生長狀態(tài),重復3次。利用Western Blot檢測缺氧誘導因子-1α(HIF-1α)表達情況。
1.2.1 實時熒光定量PCR檢測PLGFmRNA表達量 利用Trizol法提取常氧組(0 μg/mL CoCl2)、低氧組(200 μg/mL CoCl2)胎盤滋養(yǎng)層細胞系中RNA,每組3個重復,反轉(zhuǎn)錄cDNA。以cDNA為模板,交由上海生工設計引物。表1是引物序列。
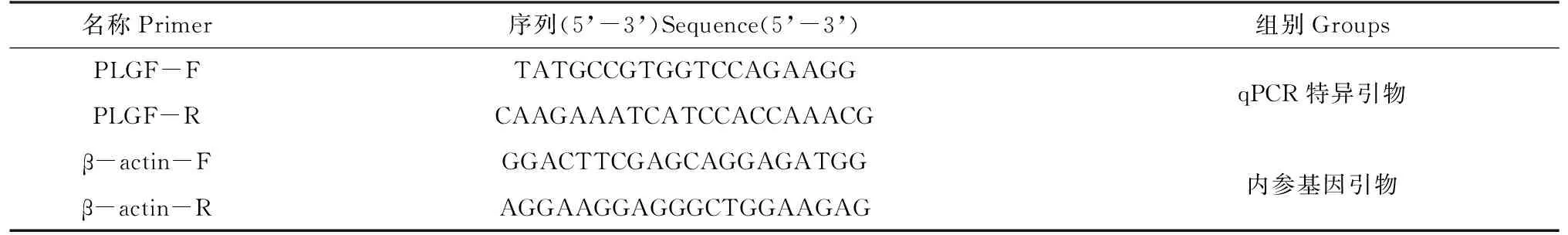
表1 引物序列Tab.1 Primer sequences
PCR擴增體系為:10×buffer 2.5 μL,dNTP(2.5 mmol/L)2.0 μL,MgCl21.5 μL,TapDNA聚合酶0.25 μL,上游引物1.0 μL,下游引物1.0 μL,ddH2O 14.75 μL,cDNA 1 μL;反應程序為:95 ℃預變性5 min,按95 ℃下反應30 s、56 ℃下反應30 s、72 ℃下反應60 s循環(huán)反應30次,最后72 ℃延伸10 min。
1.2.2 顯微鏡觀察 胎盤滋養(yǎng)層細胞鋪滿六孔板后,設置常氧組(0 μg/mL CoCl2)、低氧組(200 μg/mL CoCl2)各3個孔,均處理24 h后,用10 μL槍頭按照標記線做劃痕,每個孔3條劃痕,用PBS沖洗,4%多聚甲醛孵育固定10 min,固定后用PBS清洗2次,用結晶紫染色液染色10 min,用PBS緩沖液清洗殘留染色液,置于顯微鏡下觀察,隨機選取6個鏡下視野,拍照。每組試驗重復3次。
按3∶1的比例將Matrigel基底膠(培養(yǎng)基與槍頭用4 ℃預冷處理)與不含血清的DMEM/F12培養(yǎng)基進行稀釋處理,在Transwell小室濾膜中按50 μL/孔的劑量加入Matrigel基底膠,在37 ℃培養(yǎng)箱中恒溫孵育30 min,收集2×104個經(jīng)200 μg/mL CoCl2處理24 h的奶牛胎盤滋養(yǎng)層細胞,將Transwell上室用Matrigel包被,加入200 μL無血清DMEM/F12培養(yǎng)基重懸后的細胞,在下室中加入500 μL的DMEM/F12完全培養(yǎng)基(含10%胎牛血清),放入含有5% CO2的37 ℃恒溫培養(yǎng)箱中培養(yǎng)24 h;取出Transwell小室,將濾膜上方的上室內(nèi)的細胞和基質(zhì)膠用棉簽輕輕擦去,再用PBS緩沖液沖洗干凈,用4%多聚甲醛將小室包裹孵育,固定穿過濾膜的細胞10 min,用PBS緩沖液清洗2次,用結晶紫染色液染色10 min,再用PBS緩沖液清洗殘留染色液,干燥后將小室濾膜下室面朝上,置于顯微鏡下觀察,鏡下隨機選取6個視野,拍照。每組試驗重復3次。
1.2.3 Western Blot檢測 將低氧處理細胞和未處理細胞(作為陽性對照)中的總蛋白分別提取出來。采用BCA法測定樣品蛋白質(zhì)濃度。制備SDS-PAGE膠(由12%分離膠和5%濃縮膠組成),將膠板放入電泳槽內(nèi),浸泡于電泳液中;在點樣孔內(nèi)加入蛋白Marker與蛋白樣品,接通電源并設置80 V電壓電泳20 min后轉(zhuǎn)為100 V電壓繼續(xù)電泳45 min;觀察蛋白Marker達到分離要求后,將膠板取出浸泡于轉(zhuǎn)膜液中,在轉(zhuǎn)膜液中切下大小合適含有目的條帶的膠條并按照正極板、海綿墊、濾紙、PVDF膜、膠、濾紙、海綿墊和負極板的順序放置轉(zhuǎn)膜夾,在電泳槽內(nèi)加入預冷好的轉(zhuǎn)膜液與冰盒,放入轉(zhuǎn)膜夾,將電泳槽放入盛有冰塊的盆中,100 V電壓轉(zhuǎn)膜75 min;轉(zhuǎn)膜結束之后,室溫下將轉(zhuǎn)好的PVDF膜放入5%脫脂奶粉內(nèi),于搖床上緩慢搖動封閉1~2 h;用5%脫脂奶粉配制E-Cadherin抗體(一抗),將封閉結束后的PVDF膜放入一抗內(nèi)并放在4 ℃冰箱內(nèi)孵育,過夜;一抗孵育結束后用含0.1% Tween20的PBS緩沖液洗滌5次,每次15 min;然后將PVDF膜放入HRP標記的二抗中于搖床上室溫孵育1~2 h;二抗孵育完畢后,將PVDF膜用PBST緩沖液洗滌5次,即可滴加ECL化學發(fā)光劑混合液,進行暗室X-射線膠片顯影。
采用SPSS 18.0分析軟件對數(shù)據(jù)進行顯著性檢驗,采用t檢驗方法對相關數(shù)據(jù)進行統(tǒng)計學處理。P<0.05視為顯著性差異。
2 結果與分析
2.1 最適CoCl2濃度
HIF-1α是細胞在低氧條件下出現(xiàn)的低氧應答蛋白,其含量會隨氧分壓變化而變化,以此作為篩選依據(jù)。圖1 顯示,不同濃度的CoCl2誘導表達的HIF-1α量不同,呈現(xiàn)出隨著CoCl2濃度的升高而顯著升高的趨勢(P<0.05)。因此,以CoCl2濃度為200 μg/mL作為后續(xù)建立模型的濃度。

M:蛋白Marker; 1~5: 0、100、150、200、250 μg/mL CoCl2M: Protein Marker; 1-5: 0, 100, 150, 200, 250 μg/mL CoCl2圖1 不同CoCl2濃度下HIF-1α的表達情況Fig.1 The expression of HIF-1α under different concentrations of CoCl2
2.2 低氧對胎盤滋養(yǎng)層細胞形態(tài)、遷移及浸潤的影響
圖2顯示,常氧環(huán)境下的胎盤滋養(yǎng)層細胞分布均勻且密集,細胞形態(tài)正常,細胞分裂能力較強,生長狀態(tài)良好,能夠清楚地觀察到細胞偽足及合胞體。低氧環(huán)境下的滋養(yǎng)層細胞密度下降,數(shù)量明顯減少,滋養(yǎng)層細胞增殖緩慢,偽足數(shù)量減少,同時合胞體數(shù)量減少,細胞形態(tài)出現(xiàn)不同的改變。
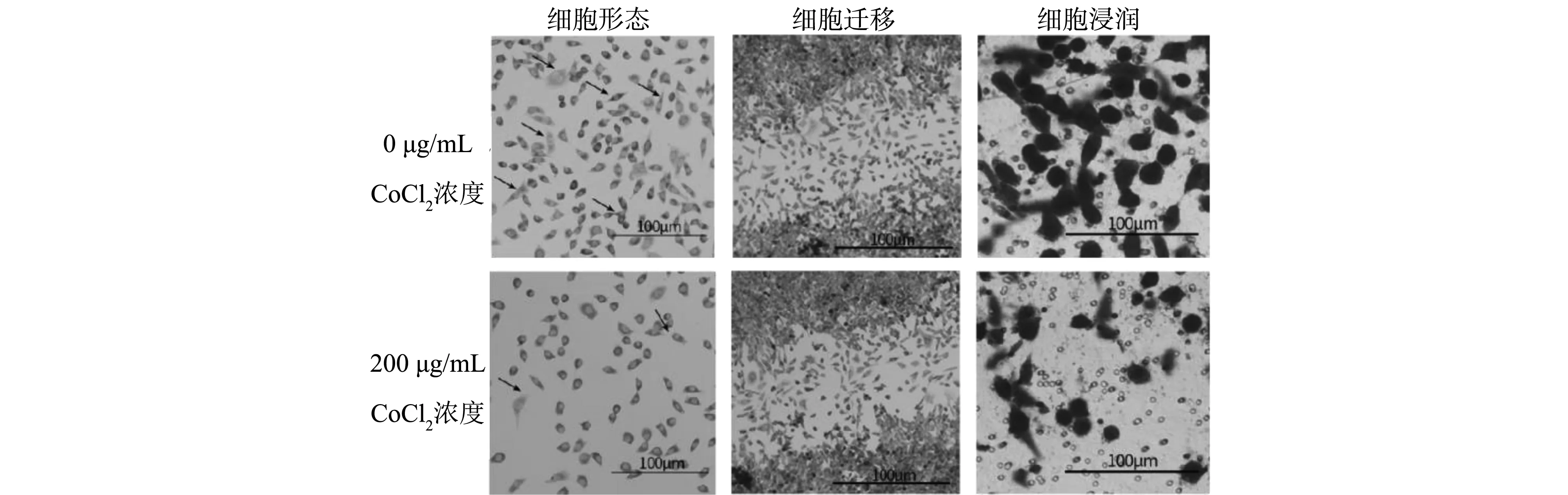
圖2 低氧條件下滋養(yǎng)層細胞形態(tài)、遷移及浸潤變化情況Fig.2 Changes in trophoblast morphology, migration and infiltration of trophoblast cells under hypoxia
常氧狀態(tài)下的滋養(yǎng)層細胞在遷移過程中分布均勻,遷移細胞狀態(tài)良好;但在低氧環(huán)境下的胎盤滋養(yǎng)層細胞表現(xiàn)出明顯的遷移減緩,遷移率下降,分布不均勻并且有明顯的空白區(qū)域。
常氧狀態(tài)下的滋養(yǎng)層細胞浸潤能力強,細胞數(shù)量多,密度大,細胞形態(tài)飽滿,狀態(tài)良好。低氧環(huán)境下的胎盤滋養(yǎng)層細胞在Transwell小室中穿梭數(shù)量減少,表現(xiàn)出明顯的浸潤率下降。
2.3 低氧條件下PLGF mRNA表達
胎盤生長因子(PLGF)作為胎盤生長發(fā)育主要的影響因子,在胎盤滋養(yǎng)層細胞增殖分化過程中起著重要作用,并對細胞生理功能具有顯著影響。圖3結果顯示,常氧條件與低氧條件下PLGFmRNA的表達量無顯著差異(P>0.05),說明PLGFmRNA的表達不受氧分壓變化的影響。
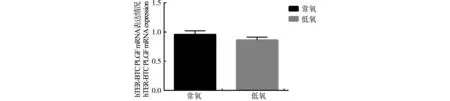
圖3 常氧與低氧條件下 hTERT-BTC中PLGF mRNA的表達情況Fig.3 Expression of PLGF mRNA in hTERT-BTC under normoxia and hypoxia conditions
2.4 低氧條件下E-Cadherin表達
圖4顯示,E-Cadherin的表達量在低氧環(huán)境下表現(xiàn)出顯著下降趨勢(P<0.05),說明低氧環(huán)境會使E-Cadherin表達量減少。
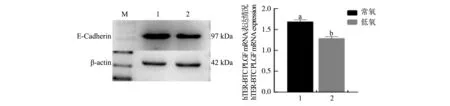
圖4 常氧與低氧條件下hTERT-BTC中E-Cadherin的表達情況Fig.4 Expression of E-Cadherin in hTERT-BTC under normoxia and hypoxia conditions
3 討 論
氧氣是細胞生長發(fā)育的必要條件之一,是細胞的必要營養(yǎng)素。氧氣含量過高或過低都會引起機體的適應性反應,有研究表明子宮內(nèi)氧濃度能夠調(diào)節(jié)并影響胎盤的結構和功能[13]。在人類胎盤的研究過程中,人們對缺氧的作用有著不同的見解[14]。HIF-1α是細胞內(nèi)表達的低氧標志物,本研究通過Western Blot檢測HIF-1α在胞內(nèi)的表達變化來篩選CoCl2濃度,并以此建立細胞體外低氧模型。有研究比較了兩種常用的低氧模型誘導劑CoCl2與DMOG,結果顯示,200 μM CoCl2可明顯引起HIF-1α的靶基因Glut1的表達增加,但對Vegfα無明顯影響;500 μM的DMOG則對Glut1和Vegfα均有明顯影響[15]。說明CoCl2與DMOG均可用于建立體外低氧模型,但誘導低氧的作用機制或產(chǎn)生程度有所不同,從而使下游基因表達情況也出現(xiàn)不同趨勢。
有研究表明,低氧可以促進人胎盤滋養(yǎng)層細胞增殖和遷移[16]。而對于反芻動物,我們的試驗結果顯示,低氧環(huán)境下的胎盤滋養(yǎng)層細胞增殖緩慢,密度下降。這種結果的差異可能與試驗對象的種族或發(fā)育狀態(tài)有關[17]。胎盤滋養(yǎng)層細胞由于其特殊性,本身具有遷移、侵襲功能,在胚胎著床后完成與子宮內(nèi)膜上皮細胞的接觸與融合,并進一步遷移、浸潤完成胎盤血管系統(tǒng)的建立[2]。本研究的結果顯示,在低氧環(huán)境中,細胞出現(xiàn)明顯的遷移減緩、遷移率下降、浸潤率降低等滋養(yǎng)層細胞功能衰退的現(xiàn)象。研究表明,胎盤滋養(yǎng)層細胞侵襲、分化的能力受損可能與不明原因的自然流產(chǎn)有關[18]。
胎盤生長因子(PLGF)作為影響胎盤生長發(fā)育的主要因子,對胎盤滋養(yǎng)層細胞的生長發(fā)育具有重要作用,其通過自分泌或(和)旁分泌方式對自身及周圍細胞均有不同程度的作用[19]。Fumihito Nishimoto等[20]通過CoCl2誘導獲得低氧環(huán)境,對來自于人胎盤分離出的原代滋養(yǎng)層細胞進行實時PCR擴增和ELISA試驗,發(fā)現(xiàn)在低氧環(huán)境下PLGFmRNA的表達水平顯著降低,但是HIF-1α不改變PLGFmRNA的表達。對于以奶牛為代表的反芻動物,試驗結果顯示,PLGFmRNA的表達不受氧分壓變化的影響,推測低氧環(huán)境下,各因子對其的影響主要作用于蛋白質(zhì)翻譯過程,這為后續(xù)研究提供了新的方向。
E-Cadherin是上皮細胞表達的特殊表面黏附分子,可作為上皮細胞形態(tài)特征的重要參考因子,胎盤滋養(yǎng)層細胞作為上皮樣細胞,E-Cadherin在其發(fā)育轉(zhuǎn)化過程中具有重要意義,尤其表現(xiàn)在涉及胎盤血管生成的生理過程。有研究結果表明,低氧通過HIF-1α誘導Snail上調(diào),從而導致E-Cadherin表達量下降[21],本研究結果與此相吻合。低氧環(huán)境導致的E-Cadherin蛋白表達減少可能與細胞形態(tài)變化、偽足減少等有關。
總之,本研究利用CoCl2成功構建了奶牛胎盤滋養(yǎng)層細胞低氧模型,利用該模型系統(tǒng)的研究了低氧狀態(tài)對于奶牛胎盤滋養(yǎng)層細胞造成的一系列影響,為探究奶牛胎盤早期發(fā)育奠定理論基礎。

