基于信息處理與模型建構的課堂教學設計和實踐
葉依叢


摘要:“化學反應的調控”是根據化學反應原理指導實踐的重要內容,揭示了知識的實踐價值。分析并歸納從理論學習到科學實踐層面的主要難點,以“合成氨工業條件選擇”為例,通過處理合成塔中真實物料數據、合成氨反應機理示意圖、鐵催化下合成氨反應歷程-勢能圖等一系列真實信息,引導學生從反應限度-速率-技術-效益等綜合角度構建真實情境下化工條件的選擇與優化的思維模型。
關鍵詞: 信息處理; 模型建構; 合成氨; 調控反應
文章編號: 1005-6629(2022)03-0041-07
中圖分類號: G633.8
文獻標識碼: B
1 提出問題
《普通高中化學課程標準(2017年版2020年修訂)》在“化學反應原理”模塊主題2“化學反應的方向、限度和速率”中,新增了化學反應的調控內容: 認識化學反應速率和化學平衡的綜合調控在生產、生活和科學研究中的重要作用。知道催化劑可以改變反應歷程,對調控化學反應速率具有重要意義[1]。它指明了學習反應原理相關理論的實踐價值和社會價值,幫助學生建構綜合認識化學反應的思路,尋找最優的反應條件調控實際生產中的反應。
但是,當學生面臨真實情境下工業生產條件的選擇和優化時,往往存在較大的困難。通過與學生的溝通與對話后發現,這部分內容在“輸入”和“輸出”的轉化過程中,普遍存在兩個難點:
第一,學習的過程采用封閉、靜態的平衡體系為研究對象得到相關結論,但真實的工業生產過程,卻是一個開放、動態的體系。故不能利用“理想狀態”的結論簡單地推演并解釋真實反應過程。
第二,學習過程一般是從孤立的角度調控反應速率或者反應限度,而實際工業生產中需要綜合考慮反應速率和反應限度因素,且某一條件的改變對反應速率和反應限度的影響往往是矛盾的,復雜問題背景下難以抽提出解決問題的關鍵要素。
要攻克上述難點,必須厘清以下問題: 一是“真實的開放體系”與“理想的封閉體系”兩者的區別是什么?二是如何建立綜合角度調控反應?三是催化劑為什么對調控反應有重要意義?
2 主題價值分析
比較不同版本的教材,針對“化學反應的調控”內容,人教版和魯科版教材都選擇“合成氨反應條件的選擇”為主題展開討論,這與合成氨反應本身具有的獨特???? 的學科價值與社會價值密切相關。
首先,合成氨工業相對成熟,便于提供合成氨塔內各組分濃度的真實物料數據。引導學生關聯相關知識、分析和計算數據,有效打破思維定勢,建立“開放體系”的思考模型,為合成氨工業條件的選擇提供思考的起點。
其次,合成氨反應是一個放熱反應,溫度升高有利于加快反應速率,但不利于平衡正向移動。選擇最優溫度的過程,能有效幫助學生建立“單位時間轉化率”的概念;壓強增大有利于促進平衡正向進行,但對設備提出了很高的要求,因此選擇最佳壓強的過程,將科學理論與工程技術相結合,有助于形成速率—限度—技術—效益等多角度考慮工業問題的思維。
第三,合成氨反應蘊含豐富的關于催化劑改變反應歷程的學科本體素材[2],經過適當加工后能有效引導學生從微觀角度認識基元反應、催化劑與活化能的關系,有助于學生在復雜問題中抽提關鍵要素建立邏輯關系,形成有序調控反應的思維模型。
第四,合成氨反應融合了科學發展史,系統地梳理人類探索合成氨反應條件優化的發展脈絡,將調控化學反應的認識思路外顯化、認識角度結構化,有助于學生形成綜合調控化學反應的思維模型。
3 學習目標確立
(1) 通過理論分析合成氨反應條件,運用反應方向、限度和速率等理論知識調控生活、生產中的化學反應,形成穩定的認識思路。
(2) 通過對合成氨塔中各組分濃度的定性、定量分析,構建分析化工生產中“開放體系”的思維模型。
(3) 通過認識催化劑參與下合成氨的微觀反應歷程,知道基元反應活化能對反應速率的影響,從“提高反應決速步驟速率”的角度優化反應條件。
(4) 通過解讀合成氨反應的科學發展史,了解科學家的科學態度和社會責任感,總結提煉“多角度分析化學反應,選擇和優化化工生產條件”的思路,體會化學反應原理的社會價值和應用價值。
4 教學設計構思
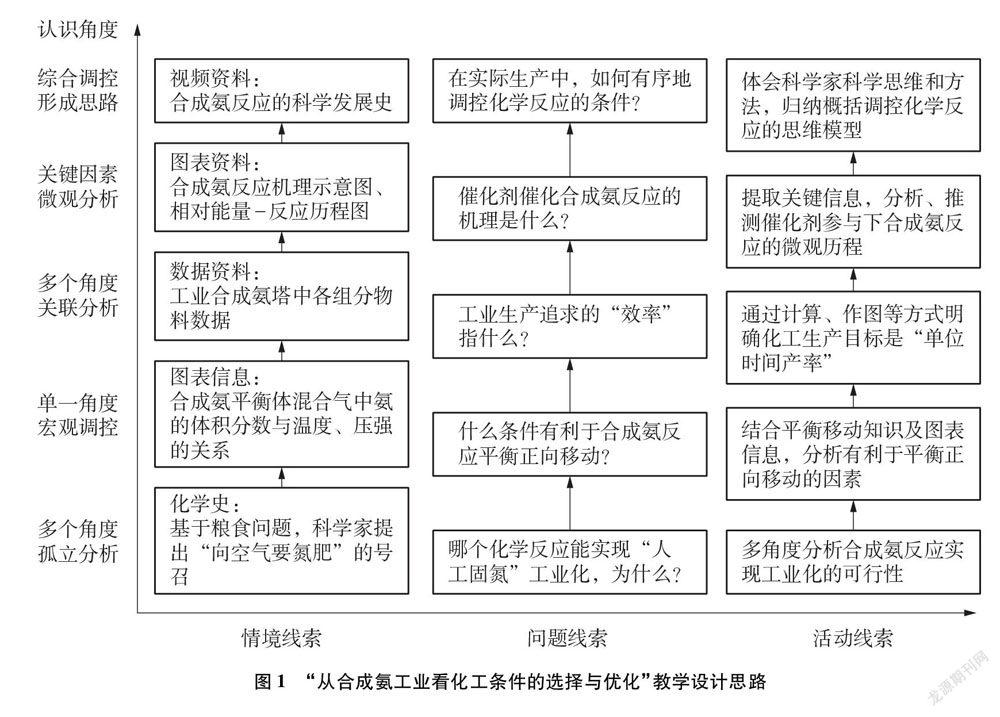
圍繞“如何調控反應”以及“為什么這么調控”兩個核心問題,為學生提供一系列真實的數據、圖表信息。學生在分析和處理信息的過程中,深度認識化學反應的方向和限度、工業生產的效率、催化劑改變反應歷程的微觀原理等問題;學生認識和調控反應的視角由發散到聚焦、由單一到綜合、由宏觀到微觀,從而形成有序調控反應的思維模型。具體教學設計思路如圖1所示。
5 課堂實踐實錄
5.1 創設情境,引入課題——構建化工生產主反應選擇思路
[教師]19世紀,隨著第二次工業革命的到來,世界人口劇增,人類面臨糧食不足的問題,各國都迫切要求建立規模巨大的生產氮化合物的工業。科學家克魯克斯創造性地提出“向空氣要氮肥”的號召。
[設問]為什么要“向空氣要氮肥”?
[學生]思考、回顧。空氣中氮含量高,主要以不被植物吸收的N2存在,需要將N2轉化為能被植物吸收利用的含氮微粒。
[追問]回顧學過的人工固氮反應,哪個反應可以實現工業化生產?說明原因。
[學生]N2+3H22NH3可以實現工業化生產。原因如下: (1)NH3可以進一步轉化為NH+4、 NO-3被植物吸收和利用;(2)該反應原料來源豐富;(3)合成氨反應ΔH<0,ΔS<0,低溫下反應能自發進行;(4)該反應在常溫下反應限度較大。
[教師]合成氨反應被譽為“20世紀科學領域最輝煌的成就之一”,它成功解決了糧食問題。如何調控反應條件使它滿足工業化生產的要求呢?我們一起學習“從合成氨工業看化工條件的選擇和優化”。
設計意圖: 追溯“合成氨工業”產生的歷史背景,使學生切實感受到科學家們面對社會需求時所展現的科學態度和社會責任感,充分體現化學對人類社會進程的重要推動作用。引導學生從解決糧食問題——制造肥料出發,按照“需要合成什么→需要用什么原料→選擇什么反應→該反應熱力學是否可行→是否能夠實現工業化生產”的思路展開思考,初步構建化工生產中主反應選擇的思路。
5.2 運用舊知,理論分析——從平衡角度選擇合成氨反應條件
[ppt]N2(g)+3H2(g)2NH3(g),ΔH=-92.2kJ·mol-1。
[設問]結合圖表數據(見圖2),描述平衡狀態時,氨的體積分數與反應的溫度、壓強有什么關系?
[學生]讀圖并回答: 在平衡混合物中,壓強一定時,溫度升高,氨的體積分數減小;溫度一定時,壓強增大,氨的體積分數升高。
[設問]請用平衡移動原理判斷并解釋什么條件有利于合成氨反應正向進行?
[學生]高壓、低溫條件。合成氨反應是一個熵減的放熱反應,壓強增大和溫度降低均有利于平衡正向移動。
[教師]1MPa=1×106Pa,30MPa相當于30N的力(約300kg的重量)作用于1cm2的面積上所產生的壓強。考慮設備的承受能力,工業上往往選擇10~30MPa的壓強。
[設問]在30MPa壓強下,選擇低溫作為工業生產條件是否合適?
[學生]不合適,溫度降低雖然有利于平衡正向移動,但是溫度降低,反應速率減慢,導致生產效率低。
[教師]溫度在調節速率和平衡的時候出現矛盾,選擇哪個溫度最合適呢?需要進一步討論,工業生產追求的主要目標是什么?
設計意圖: 先從單一的熱力學角度(即化學平衡角度)對合成氨反應條件進行選擇,有利于學生思考相關問題時思維的有序性。但理論運用于實際時會出現偏差需要修正,并引出關鍵問題: 化工生產中追求的主要目的是什么?為后文動力學分析(即速率角度)做好鋪墊,由淺入深、由單一到綜合地討論合成氨反應條件的選擇與優化。
5.3 數形結合,突破難點——構建動態開放體系的認識模型
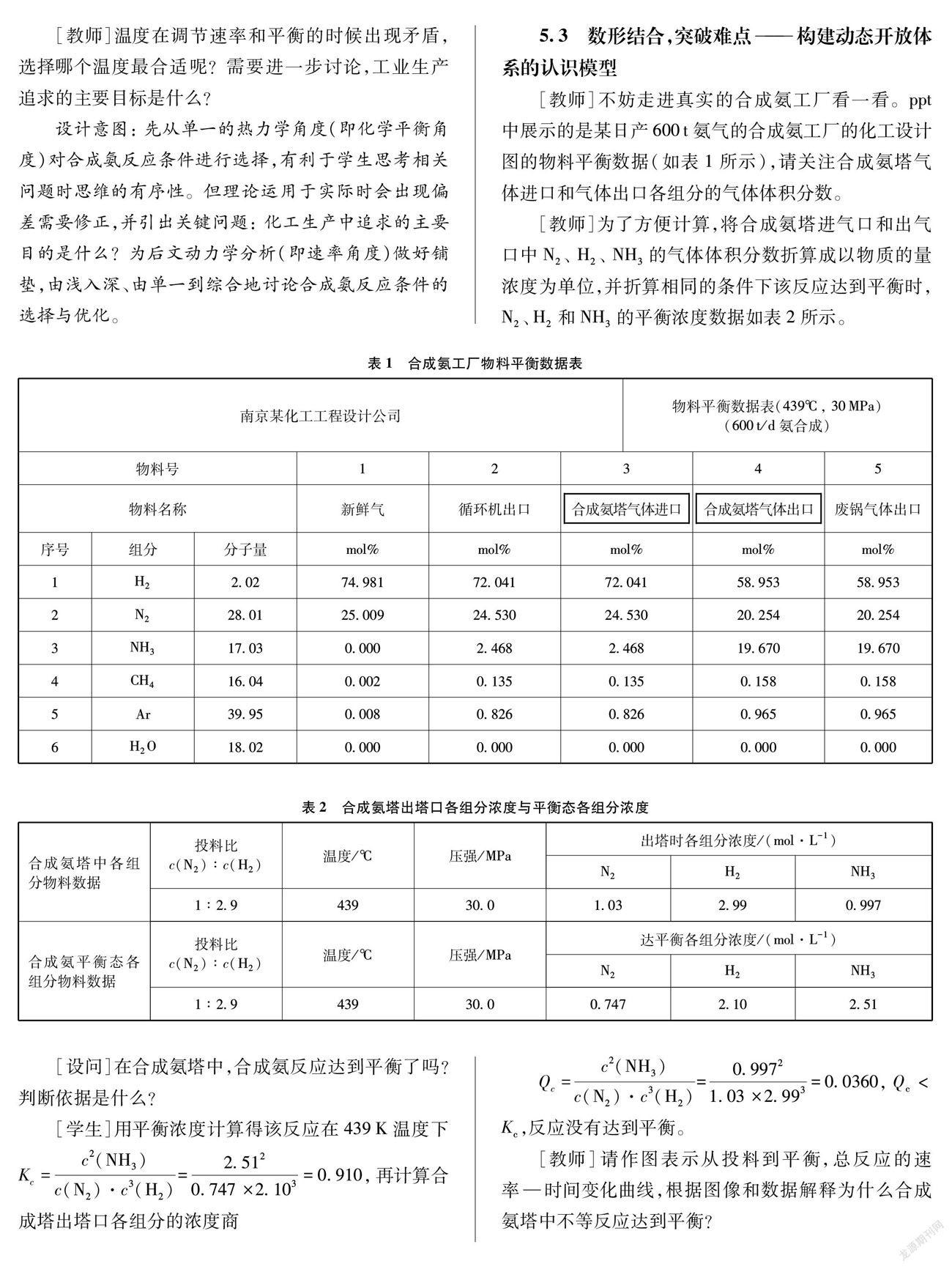
[教師]不妨走進真實的合成氨工廠看一看。ppt中展示的是某日產600t氨氣的合成氨工廠的化工設計圖的物料平衡數據(如表1所示),請關注合成氨塔氣體進口和氣體出口各組分的氣體體積分數。
[教師]為了方便計算,將合成氨塔進氣口和出氣口中N2、 H2、 NH3的氣體體積分數折算成以物質的量濃度為單位,并折算相同的條件下該反應達到平衡時,N2、H2和NH3的平衡濃度數據如表2所示。
[設問]在合成氨塔中,合成氨反應達到平衡了嗎?判斷依據是什么?
[學生]用平衡濃度計算得該反應在439K溫度下Kc=c2(NH3)c(N2)·c3(H2)=2.5120.747×2.103=0.910,再計算合成塔出塔口各組分的濃度商
Qc=c2(NH3)c(N2)·c3(H2)=0.99721.03×2.993=0.0360,Qc<Kc,反應沒有達到平衡。
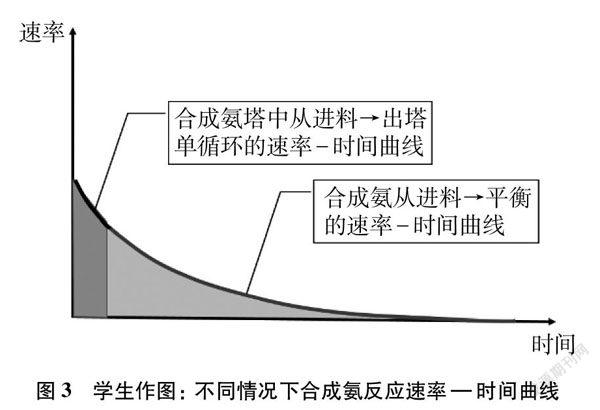
[教師]請作圖表示從投料到平衡,總反應的速率—時間變化曲線,根據圖像和數據解釋為什么合成氨塔中不等反應達到平衡?
[學生]作圖(如圖3中曲線)。從圖中可以看出,隨著反應的進行,總反應速率不斷減小最后趨近于0,速率過低不利于工業生產效率。
[教師]請在圖3的基礎上,畫出其他條件均相同、合成氨塔中從進料到出塔單個回合的速率—時間曲線,并分別說明兩條曲線與坐標軸形成的面積所代表的物理意義。
[學生]作圖(如圖3所示)。深色圖形面積代表合成氨塔中從進料到出塔單次合成氨氣的濃度,淺色圖形面積代表相同條件下合成氨反應達平衡時氨氣的濃度。
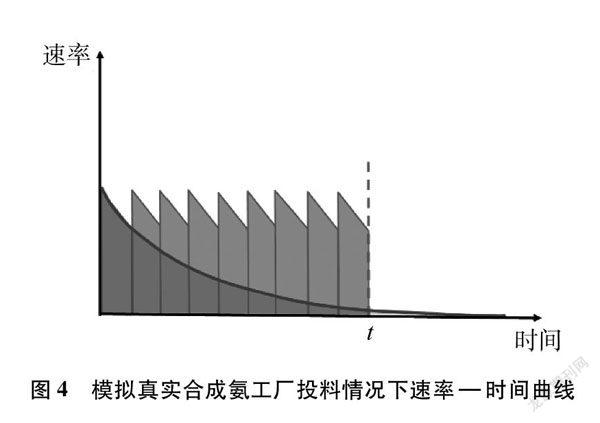
[教師]雖然一個回合的氨氣產量比不上平衡產量,但可以再來一個回合,再來一個回合,如此不斷重復,形成如圖4所示的速率—時間曲線。
[設問]比較單位時間內,上述速率—時間圖中兩種曲線圍成的面積的大小。并解釋工業上不等到反應達平衡,而采用不斷投料的方式進行生產的優勢是什么?工業生產追求的目標是什么?
[學生]優勢在于讓反應持續在反應物濃度比較大、速率比較高的狀態下發生,增大產物在時間上進行疊加之后的總量。
[學生]工業追求的是單位時間的產量,所以除了考慮反應限度,還要考慮反應速率。
設計意圖: 為學生提供合成氨塔中真實的物料數據,引導學生從定性與定量結合的角度收集證據。通過定性分析、定量計算以及數形結合分析等方法,打破慣有的封閉體系反應平衡的定勢思維,重塑工業生產中開放體系、循環投料的思維模型。該模型的建立有助于學生抓住本質,更深刻地理解工業生產調控的關鍵著力點。形成模型的過程充分建立了證據—結論之間的聯系,培養學生的證據推理能力。
5.4 信息助力,微觀探析——理解催化劑作用下的反應歷程
[提問]控制哪些反應條件可以提高合成氨反應的反應速率?
[學生]升高溫度、增大壓強、提高反應物濃度、加入催化劑……
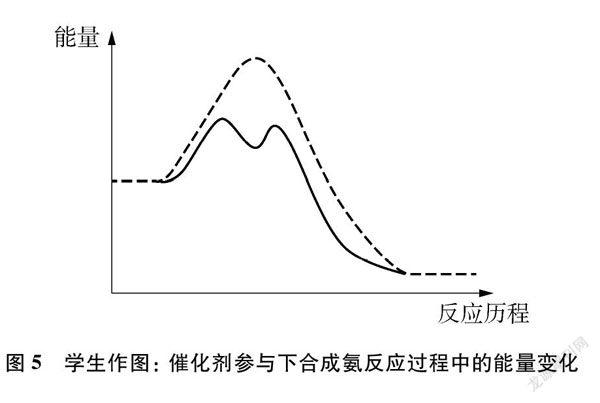
[教師]催化劑能加快化學反應速率的本質原因是什么?請在能量—反應歷程圖中畫出催化劑參與下合成氨反應過程中的能量變化。
[學生]作圖(如圖5所示)。
[追問]加入催化劑之后能量圖出現兩個峰代表什么含義?
[學生]代表催化劑先作為反應物參與反應,又作為產物生成。
[教師]這是合成氨在鐵觸媒催化作用下,通過計算機模擬生成的能量—反應歷程圖[4](如圖6所示)。
[教師]請用自己的語言描述,加入催化劑后,該反應的能量—反應歷程圖像有什么變化?
[學生](1)加入催化劑之后,活化能大大降低;(2)加入催化劑之后,產生了幾個小峰,說明發生了幾個反應。
[教師]沒錯,N2和H2分子在催化劑表面經過若干簡單反應步驟,才最后轉化為NH3分子。每一個簡單的反應步驟,就是一個基元反應。
[教師]想知道N2和H2在催化劑表面發生反應生產氨氣的過程嗎?請結合合成氨在催化劑參與下反應機理示意圖[5](如圖7所示),用自己的語言描述這個過程。
[學生]氮氣和氫氣擴散到催化劑表面,吸附在催化劑上。吸附在催化劑表面的氮氣和氫氣斷開化學鍵,氫原子逐一與氮原子成鍵,一個、兩個、三個,在催化劑表面生成NH3,最后NH3脫離催化劑表面,飛走了。
[教師]正如同學們描述的,合成氨的催化歷程一般分為五個主要步驟: 擴散→吸附→表面反應→脫附→擴散,具體過程見圖7。
1 氣體向催化劑表面擴散。
2~3 氣體在催化劑表面吸附: N2(g)→N2(ad); H2(g)→H2(ad)。
4~7 表面反應: N2(ad)2N(ad); H2(ad)→2H(ad); N(ad)+H(ad)→NH(ad); NH(ad)+H(ad)NH2(ad); NH2(ad)+H(ad)NH3(ad)。
8 NH3從催化劑表面脫附: NH3(ad)→NH3(g)。
[教師]我們將這一系列基元反應中,反應速率最慢的一步稱為“決速步驟”,它決定了總反應的反應速率。根據合成氨在鐵催化下的能量-反應歷程圖(如圖6實線部分所示),判斷這些基元反應中,哪個步驟是決速步驟?說出你的判斷依據。
[學生]步驟12N2(ad)+32H2N(ad)+3H(ad),因為這個步驟對應的活化能最大。活化能大,反應速率慢。
[追問]這部分能量主要是克服哪種微粒間的作用力?
[學生]吸附態的N2中的化學鍵,因為NN的鍵能大,斷裂需要較多能量。
[教師]結合以上分析結果思考: 如何調控反應條件,加快“決速步驟”的反應速率,從而提高催化效率呢?
[學生](1)增加N2的濃度(分壓),從而增加N2的吸附濃度,加快決速步驟的反應速率。(2)及時移走生成的NH3,為N2和H2騰出更多可供吸附的催化劑表面空間。
設計意圖: 利用驅動問題并輔以反應機理示意圖,啟發學生利用已有知識,結合提示信息,經歷“認識反應歷程→找到決速步驟→調控決速步驟→實現深度調控”的過程,探索反應的微觀歷程,學生在解決新問題的過程中獲得知識與發展能力。補充的信息,既拓展了教材知識的深度,也提升了學生的信息素養,為調控反應留下了思考的空間和發揮的余地。
5.5 貫穿史實,總結提煉——構建調控化學反應的思維模型
[視頻]以諾貝爾化學獎獲得者——哈伯、博施、艾爾特的研究為主線介紹合成氨發展史。
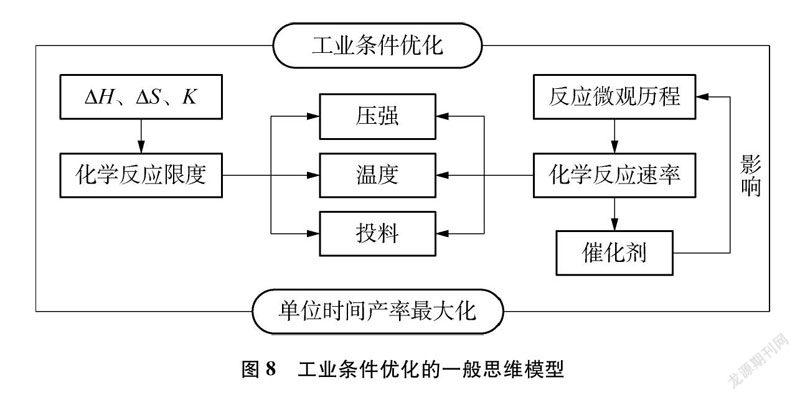
[教師]結合所學內容,從合成氨工業發展史中,與學生共同提煉出工業條件優化的一般思維模型(如圖8所示)。
設計意圖: 在課堂結尾系統地呈現人類探索合成氨反應工業條件的優化過程,將科學知識、技術發明、社會發展相聯系,系統梳理了合成氨反應條件選擇和優化的發展脈絡,將合成氨工業條件的選擇優化的認識思路、認識角度結構化和外顯化,有助于學生形成比較穩定的思維模型。在歷史事件的發展進程中,學生充分感知前人在探索和改造自然過程中展現的嚴謹的科學態度與高度的社會責任感,理解和體驗合成氨工業對人類文明進程巨大的推動作用。
6 課堂教學反思
工業合成氨反應條件的選擇和優化是一個涉及工業生產設備、反應歷程等多方面因素的復雜問題,因此不要求學生能獨立找到最佳的生產條件,而是希望他們在這一過程中初步形成從多方面綜合思考問題的意識[6]。在教學實踐中,將合成氨反應條件的選擇作為證據推理、建立認知模型的教學契機,需關注以下幾點:
(1) 選擇真實情境素材作為推理證據,構建推理路徑。挖掘并利用科技文獻數據、生產物料數據、化學發展史實等真實鮮活的素材作為推理證據,培養學生有序地建立外界條件、圖表數據、推理結論之間的邏輯關系,使學生初步了解化工條件選擇的思考維度、證據來源和建模過程。
(2) 依據學生認知特點設置核心問題,構建思維模型。尊重學生的認知特點,設置每一環節的核心問題。尤其在多因素影響下反應條件對反應的影響產生矛盾時,通過驅動性問題厘清主要矛盾是什么,矛盾的主要方面是什么,引導學生在條件選擇時有清晰的權衡和側重,從而構建全面、有序、可發展的思維模型。
(3) 根據工業合成氨的背景,開展拓展活動。例如原料氣H2的制備過程中反應條件的選擇,它進一步增大反應調控的復雜程度——對主、副反應的調控。依據本節課的思維模型,創造性地解決問題,從模型建構向模型應用遷移,提升思維的深刻性和靈活性,擴展和深化思維模型。
參考文獻:
[1]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版)[S]. 北京: 人民教育出版社,2018: 31.
[2]江合佩,劉炯明,鄭玉海. “情境結構,模型建構”促進催化劑反應歷程有效復習[J]. 化學教學,2020,(11): 57~64.
[3]王晶,鄭長龍主編. 普通高中教科書·化學(選擇性必修1)·化學反應原理[M]. 北京: 人民教育出版社,2020: 45.
[4]劉化章. 氨合成催化劑100年: 實踐、 啟迪和挑戰[J]. 催化學報,2014,(10): 1620~1640.
[5]鄭仁垟. 固體表面上的化學反應——2007年諾貝爾獎簡介[J]. 大學化學,2007,(12): 13~17.
[6]王磊主編. 普通高中教科書·化學(選擇性必修1)·化學反應原理教師用書[M]. 濟南: 山東科學技術出版社,2020: 210.

