米曲霉優良菌株的篩選及在制曲發酵西瓜黃豆醬中的應用
孫笑寒,蔣雪薇,2,*,肖智予,歐德沖,李 開,周 慧,2,方勤軍
(1.長沙理工大學食品與生物工程學院,湖南 長沙 410114;2.湖南省調味品發酵工程技術研究中心,湖南 長沙 410600;3.加加食品集團股份有限公司,湖南 長沙 410600)
西瓜黃豆醬是我國非物質文化遺產,起源于清朝后期豫魯地區,是一種傳統調味品[1]。西瓜黃豆醬主要以黃豆、小麥面粉和西瓜為原料,經霉菌(主要是米曲霉)、酵母菌和乳酸菌等微生物及其酶系共同作用而制成的具有獨特色、香、味的半固體黏稠狀調味品[2-3]。米曲霉是西瓜黃豆醬最重要的制曲菌種,其分泌的豐富酶系能有效降解淀粉及蛋白質原料,為其他微生物的生長代謝及黃豆醬特征風味的形成奠定基礎。近年來,米曲霉蛋白酶活性是篩選此菌種的主要指標,但對米曲霉淀粉酶活性研究卻較少,而淀粉酶活性對增香提味也具有重要作用[4]。與開放式制曲發酵工藝相比,將蛋白酶活性優良米曲霉應用于黃豆醬單一菌種制曲發酵,雖然能夠縮短發酵周期,保證產品穩定性,但是由于淀粉酶活性較弱,使淀粉質原料利用率低,黃豆醬鮮甜味不足[5-6]。
黃豆醬原料中大豆與小麥面粉比例多為7∶3或8∶2,淀粉質原料過少導致其通過糖代謝反應生成小分子糖類物質含量低,豆醬甜感較弱;同時,還原糖與氨基酸通過美拉德反應產生的風味物質和焦糖色也隨之較少,使黃豆醬出現香氣寡淡,米曲霉孢子霉味明顯,色澤暗淡、無光澤等問題[7-8]。而在西瓜黃豆醬發酵過程中,西瓜作為主要原料添加,其含有豐富的果糖和葡萄糖,不僅賦予黃豆醬調和的甜感,同時使酵母利用足夠充分的糖類化合物產生醇類物質,再通過脫羧反應生成酸類物質,通過酯化反應生成酯類物質,為提升黃豆醬的醇香、酯香風味做出極大貢獻[9]。新鮮西瓜本身也含有不飽和C9醇和醛類等氣味活性化合物,是西瓜黃豆醬具有獨特果香的主要原因[10]。但是,現階段我國西瓜黃豆醬多采用家庭手工作坊生產,生產效率低、發酵周期長;天然制曲和日曬夜露發酵工藝具有菌種多樣、酶系豐富等特點,但在自然接種過程中易發生雜菌污染,造成豆醬質量不穩定[11]。針對以上問題,可以從菌種、制曲方式2 個方面解決西瓜黃豆醬品質不穩定的問題。
本研究從制醬用成品曲中分離篩選蛋白酶及淀粉酶活性優良的菌株,通過對比研究蛋白酶活性與淀粉酶活性優良菌的單一菌種制曲及混合菌種制曲后的西瓜黃豆醬發酵過程,考察其不同制曲方式對西瓜黃豆醬的理化指標、揮發性風味物質以及感官評分的影響,探索米曲霉不同酶活性優良菌與西瓜黃豆醬風味物質形成的關系,以期從滋味、香氣、色澤、體態四方面提高豆醬品質,為工業化生產質優的西瓜黃豆醬奠定基礎。
1 材料與方法
1.1 材料、試劑與培養基
1.1.1 材料與試劑
成品曲(制醬用),采自湖南某調味品廠;商業米曲霉曲精 河北石家莊市鼎鑫釀造食品科學研究所;黃豆、小麥面粉、西瓜、馬鈴薯均為市售。
真菌基因組DNA提取試劑盒 北京索萊寶科技有限公司;福林-酚 上海麥克林生化科技有限公司;3,5-二硝基水楊酸 國藥集團化學試有限公司;2-甲基-3-庚酮(內標物,99.5%,色譜純) 德國Dr.Ehrenstorfer公司。
1.1.2 培養基
馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基:200 g去皮、塊狀馬鈴薯,添加1 000 mL水,煮沸30 min,多層紗布過濾取濾液,加水至1 000 mL,葡萄糖20 g/L,瓊脂粉20 g/L,pH 7.0,121 ℃滅菌20 min;蛋白酶初篩上層平板培養基:脫脂牛奶4 mL/L,磷酸氫二鉀1.07 g/L,硫酸鎂0.5 g/L,磷酸二氫鉀0.36 g/L,胰蛋白胨0.04 g/L,氯化鋅0.04 g/L,硫酸亞鐵0.02 g/L,氯化鈣0.002 g/L,氯化鈉0.16 g/L,瓊脂20 g/L,pH 7.0,121 ℃滅菌20 min;淀粉酶初篩上層平板培養基:可溶性淀粉20 g/L,蔗糖30 g/L,硝酸鈉3 g/L,磷酸氫二鉀1 g/L,硫酸鎂0.5 g/L,氯化鉀0.5 g/L,硫酸亞鐵0.01 g/L,瓊脂20 g/L,pH 7.0,121 ℃滅菌20 min;下層平板瓊脂培養基:瓊脂20 g/L,pH 7.0,121 ℃滅菌20 min;制曲培養基:蒸煮黃豆-炒面粉質量比5∶1,121 ℃滅菌20 min。
1.2 儀器與設備
UV1800紫外-可見分光光度計 日本島津公司;VERITI聚合酶鏈式反應(polymerase chain reaction,PCR)擴增儀 美國應用生物系統公司;YRE2000B旋轉蒸發儀 鞏義市予華儀器有限責任公司;436GC/EVOQ TQ/PAL氣相色譜-質譜(gas chromatography-mass spectrometry,GC-MS)聯用儀 美國布魯克科技有限公司;DB-5MS色譜柱 安捷倫科技中國有限公司。
1.3 方法
1.3.1 工藝流程

圖1 菌種篩選及釀造西瓜黃豆醬的工藝流程Fig. 1 Flow chart of strain screening and manufacturing of fermented watermelon-soybean paste
工藝流程如圖1所示。從成品曲中分離篩選發酵性能優良的米曲霉,制備孢子懸液接種至蒸煮黃豆及焙炒小麥面粉的混合原料中,制備西瓜黃豆醬成品曲;成品曲與鹽和西瓜按比例混合,28 ℃恒溫發酵30 d,釀制得到西瓜黃豆醬。
1.3.2 米曲霉的分離純化
將成品曲樣品梯度稀釋后,吸取不同梯度稀釋液0.1 mL涂布于PDA培養基中,每個梯度進行3 個重復實驗,28 ℃培養3 d,挑選具有米曲霉典型形態特征且生長良好的菌株進行鏡檢,將初步鏡檢結果為米曲霉的菌株在PDA平板中進一步分離純化獲得純培養菌株。
1.3.3 米曲霉的篩選
1.3.3.1 牛津杯法初篩產蛋白酶、淀粉酶菌株
將純培養菌株接種至PDA液體培養基中,培養36 h,收集菌液,制成孢子數為1×108的孢子懸液。無菌條件下,取0.1 mL孢子懸液至蛋白酶初篩培養基的牛津杯中,28 ℃培養48 h,測定蛋白酶水解圈直徑。按照上述方法,將等量孢子懸液接種至淀粉酶初篩培養基的牛津杯中,培養結束時,利用稀碘液噴灑至培養基中,顯色后,測量淀粉酶水解圈直徑。每株菌均重復3 次平行實驗[12-13]。
1.3.3.2 制曲復篩產蛋白酶、淀粉酶優良菌株
取2 mL孢子數為108個/mL的孢子懸液接種于制曲培養基中,28 ℃恒溫培養72 h,分別在培養0、12、24、36、48、60、72 h取樣測定蛋白酶、淀粉酶活性。
1.3.4 菌種鑒定
1.3.4.1 菌落及菌體形態鑒定
接種針沾取少許孢子點接于PDA平板培養基中央,30 ℃培養4 d,形成菌落培養物,拍照記錄菌落形態;接種環取少許孢子點接于載玻片上,滴加少量融化并冷卻至45 ℃的PDA培養基,待形成薄而圓的小瓊脂塊后進行濕室培養[14],顯微鏡觀察菌體形態。
1.3.4.2 ITS rRNA序列分析
利用真菌試劑盒提取所篩菌種模板DNA,以ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4 (5’-TC CTCCGCTTATTGATATGC-3’)作為引物進行PCR擴增。PCR體系(30 μL):模板3 μL,上下游引物各3 μL,Taq聚合酶1 μL,dNTP 2.5 μL,MgCl22 μL,10×PCR Buffer 3 μL,ddH2O補齊30 μL。PCR條件:95 ℃預變性5 min;95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸1 min,循環30 次;72 ℃延伸10 min,4 ℃保存。產物用1%瓊脂糖凝膠電泳檢測,PCR擴增產物測序由生工生物工程(上海)股份有限公司武漢分公司完成,結果在NCBI序列數據庫中比對,利用軟件MEGA 7.0構建系統發育樹。
1.3.5 制曲及發酵
單一菌種制曲發酵:分別將5 mL孢子數為108個/mL的商業米曲霉菌株、篩選米曲霉菌種CS3.04、CS3.22的孢子懸液接種到300 g原料(蒸煮黃豆-炒面粉質量比5∶1)中,32 ℃制曲72 h獲得成品曲,成品曲與西瓜以質量比1∶1.5裝瓶發酵;28 ℃恒溫發酵30 d,每隔5 d取樣測定理化指標,發酵結束后用GC-MS分析揮發性風味物質并進行感官評定;接種商業米曲霉、CS3.04、CS3.22孢子懸液的樣品分別為S0、S1、S2。混合菌種制曲發酵:菌種CS3.04及CS3.22單一菌種制曲所獲得的成品曲以質量比1∶1混合后,按上述條件發酵制得的混合菌種制曲發酵西瓜黃豆醬樣品為S3。
1.3.6 酶活性測定
蛋白酶活性參照SB/T 10317—1999《蛋白酶活力測定法》[15]測定,以干基質量計,計算如式(1)所示:
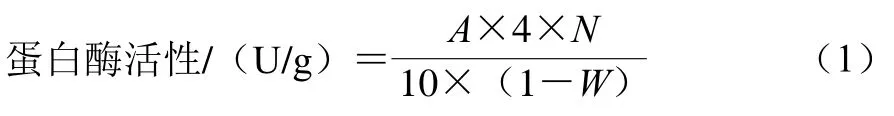
式中:A為在680 nm波長處由樣品測得的吸光度;4為酶反應總體積(mL);N為稀釋倍數,本實驗稀釋倍數為400 倍;10為反應時間(min);W為成品曲的水分質量分數,本實驗為55%。
淀粉酶活性參照3,5-二硝基水楊酸比色法[16]測定,以干基質量計,計算如式(2)所示:
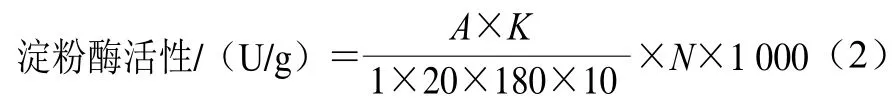
式中:N為稀釋倍數;180為葡萄糖摩爾質量(g/mol);20為反應時間(min);1 000為mmol到μmol單位換算;1為酶液體積(mL);A為在540 nm波長處由樣品測得的吸光度;K為葡萄糖標準曲線斜率。
1.3.7 發酵黃豆醬還原糖、總酸、氨態氮測定
還原糖含量:參照GB 5009.7—2016《食品中還原糖的測定》[17]測定;氨態氮及總酸含量:參照GB 2718—2014《釀造醬》[18]測定。
1.3.8 發酵黃豆醬中揮發性風味物質分析
液體進樣樣品準備:取樣品20 g,三氯甲烷萃取2 次,混合有機相,45 ℃旋轉蒸發至溶液剩余5 mL,無水硫酸鈉除水,0.22 μm膜過濾;樣品定量處理:向準備好的樣品中添加20 μL 8.16 μg/μL的2-甲基-3-庚酮作為內標物,總體積為1.5 mL;GC條件:40 ℃維持2 min,以5 ℃/min升至120 ℃維持2 min,再以10 ℃/min升至230 ℃,維持5 min,載氣(He)流速為1.0 mL/min,分流比為10∶1;MS條件:電子電離源,電子能量70 eV,發射電流200 μA,離子源溫度250 ℃,質量掃描范圍m/z30~500[19]。揮發性化合物定量計算如式(3)所示:

式中:C1為揮發性風味物質含量/(mg/kg);C2為內標物含量/(mg/kg);A1為揮發性風味物質峰面積;A2為內標物峰面積。
1.3.9 發酵黃豆醬感官評定
發酵結束時,選擇11 位具有相關食品背景且經過本實驗內容訓練的專業人員對隨機編碼的4 種西瓜黃豆醬進行感官評分。參考GB 2718—2014中對黃豆醬的感官要求,從滋味、香氣、體態、色澤4 項評價指標對西瓜黃豆醬進行感官評定[18,20-21],評分標準[22]見表1。
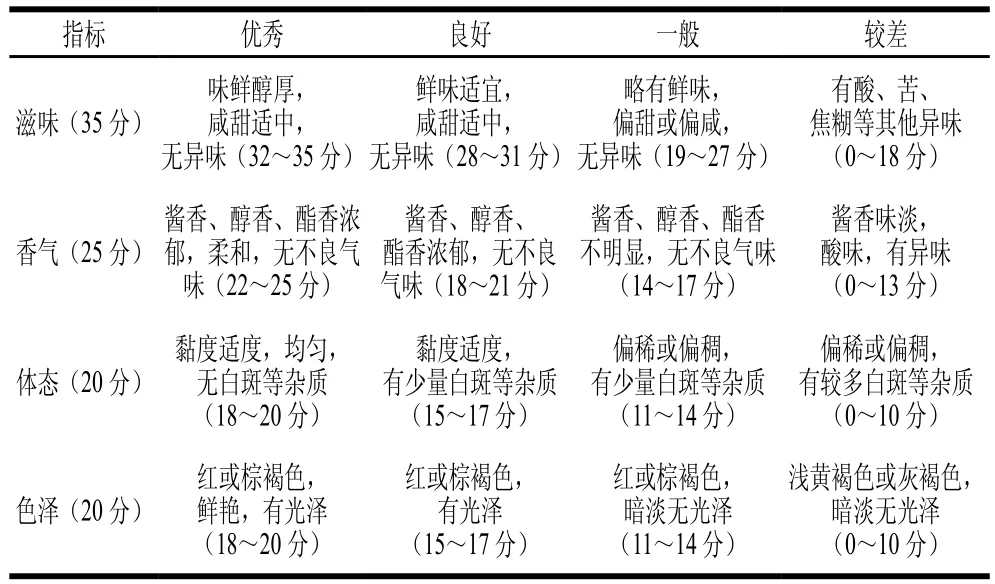
表1 西瓜黃豆醬感官評定評分標準Table 1 Criteria for sensory evaluation of fermented watermelon-soybean paste
1.4 數據處理
牛津杯水解圈直徑、酶活性、理化指標以及揮發性風味物質均3 次重復測定,并對所得數據進行標準化處理;利用Excel、Origin 2018對數據進行可視化處理。
2 結果與分析
2.1 產蛋白酶、淀粉酶優良菌株的初篩
菌株初篩工作量較大,且霉菌生長過程中菌絲伸展生長,不易測量直徑。采用牛津杯雙層平板法初篩菌種,不僅省去制曲過程,節省大量時間;也能解決霉菌水解圈與菌落直徑比存在較大誤差的問題。從成品曲中分離米曲霉,在PDA平板上挑選生長良好的單菌落進行分離純化,篩選出38 株米曲霉,命名為CS3.01~CS3.38。將38 株菌株發酵液接種于牛津杯中,考察其分解上層平板中蛋白質及淀粉能力大小,反映其蛋白酶及淀粉酶活性強弱。如圖2所示,比較牛津杯水解圈直徑大小,發現4 株菌株的2 種水解圈直徑均較大。其中蛋白酶初篩平板中直徑大小依次為CS3.22>CS3.04>CS3.31>CS3.12;淀粉酶初篩平板中直徑大小依次為CS3.12>CS3.04>CS3.22>CS3.31。因此,對這4 株菌株進行制曲酶活性驗證。
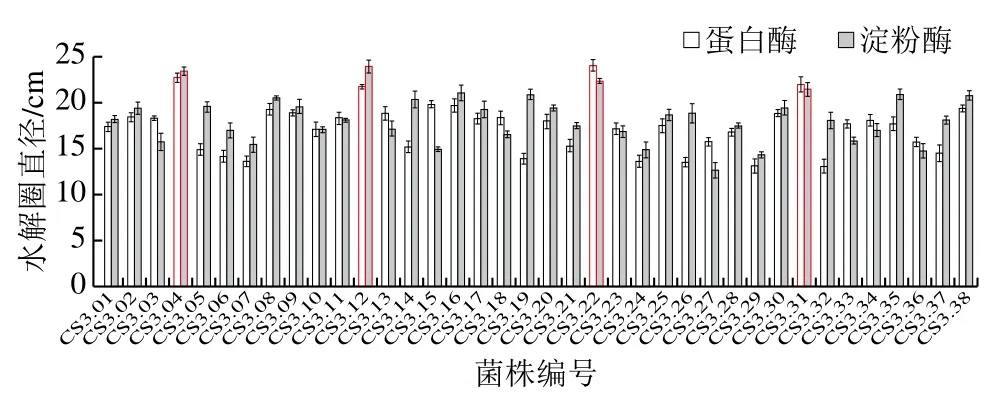
圖2 產蛋白酶及淀粉酶菌株的初篩結果Fig. 2 Preliminary screening results of protease- and amylaseproducing strains
2.2 產蛋白酶、淀粉酶優良菌株的復篩
為測定所篩4 株菌株的酶活性隨時間變化情況,分別將菌種孢子懸液(1×108CFU/mL)接種到制曲培養基中,測定其蛋白酶活性和淀粉酶活性。從圖3可以看出,4 株菌株的蛋白酶活性均在制曲72 h達到最大,酶活性大小為CS3.22>CS3.04>CS3.31>CS3.12,其中CS3.22蛋白酶活性最大,為3 132.16 U/g。淀粉酶活性在制曲60~72 h達到最大,酶活性大小為CS3.04>CS3.22>CS3.12>CS3.31,其中CS3.04淀粉酶活性最大,為107.60 U/g。這與牛津杯法初篩的結果基本保持一致,說明其結果具有真實性和可靠性。通過比較4 株菌蛋白酶和淀粉酶的測定結果,發現CS3.22和CS3.04分別是產蛋白酶和淀粉酶優良菌株,有利于降解原料中蛋白質和糖類等大分子物質,提高氨態氮及還原糖含量,改善黃豆醬滋味,故對CS3.22和CS3.04進行鑒定及后續發酵研究。
2.3 菌種鑒定
2.3.1 形態學鑒定
將CS3.04和CS3.22點接PDA培養基平板和濕室培養后,觀察其形態。如圖4所示,2 株菌的菌落均呈黃綠色,絲絨質地,菌絲短且疏松。顯微鏡觀察菌體形態,CS3.04、CS3.22兩株菌具有分生孢子梗,底端有明顯的足細胞;頂端有球形頂囊,其表面長出輻射狀小梗,分生孢子串生。根據菌落及菌體形態,初步判斷所篩選的2 株菌為米曲霉。
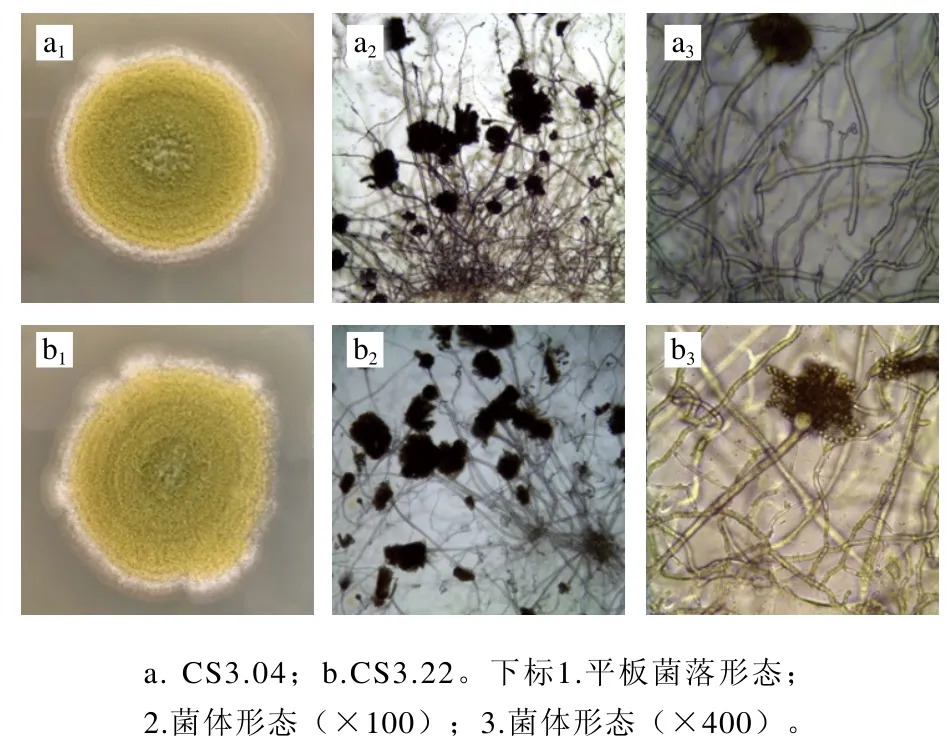
圖4 菌落及菌體形態Fig. 4 Colony and cell morphology
2.3.2 ITS rRNA序列分析
2 株菌的分子生物學鑒定結果如圖5a所示,CS3.04和CS3.22擴增片段的長度約為600 bp,條帶清晰。將2 株菌PCR擴增產物進行ITS序列分析,建立系統發育樹,如圖5b所示,CS3.04和CS3.22 ITS序列相似度高,聚為一類,結合形態學特征,鑒定均為米曲霉(Aspergillus oryzae)。
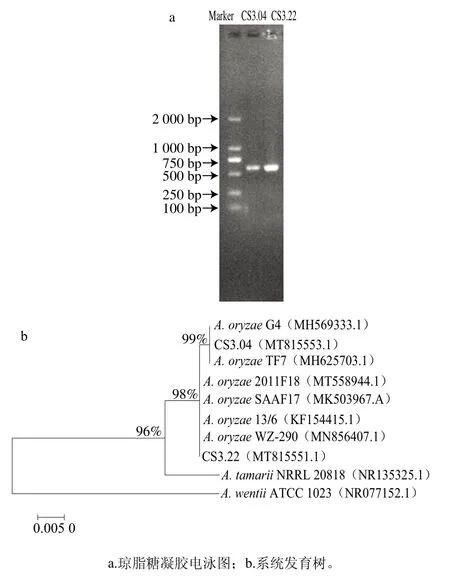
圖5 菌種的鑒定結果Fig. 5 Identification of the strains
2.4 制曲發酵西瓜黃豆醬
2.4.1 不同制曲方式發酵西瓜黃豆醬過程中理化指標的變化
以接種商業米曲霉發酵的西瓜黃豆醬S0作為對照組,單獨接種CS3.04制曲發酵的S1、單獨接種CS3.22制曲發酵的S2、以CS3.04和CS3.22質量比1∶1混合菌種制曲發酵的S3作為實驗組,考察4 組樣品在發酵過程中理化指標的變化。如圖6a所示,在0~30 d還原糖含量呈先上升后下降的趨勢,由于西瓜中糖類物質含量較高,使得在發酵起始期就明顯高于傳統黃豆醬得還原糖含量。在10 d還原糖含量均達到最高值,大小依次為S3>S1>S2>S0,其中S3為107.37 g/kg,比S0提升了11.02%。主要是由于CS3.04淀粉酶活性較高,有利于將原料中淀粉等大分子物質分解為小分子糖類物質,使還原糖含量增加較快。隨著發酵體系中各種微生物生長活動逐漸旺盛,還原糖作為主要碳源被不斷利用,使還原糖含量逐漸下降。如圖6b所示,氨態氮含量逐漸增加,在25 d氨態氮含量大小依次為S3>S2>S1>S0,S3在30 d達到6.76 g/kg,符合GB 2718—2014要求(氨態氮≥5.00 g/kg),比S0提升了5.56%。說明具有較強中性蛋白酶活性的CS3.22,水解蛋白質產生游離氨基酸的能力優于CS3.04及市售米曲霉,有利于提高氨態氮含量。如圖6c所示,總酸含量呈先增加后降低的趨勢,總酸含量大小依次為S0>S1>S2>S3。在15 d,S0的總酸含量最高為3.77 g/kg,總酸含量過高,超過適口濃度,并不利于西瓜黃豆醬品質提升。
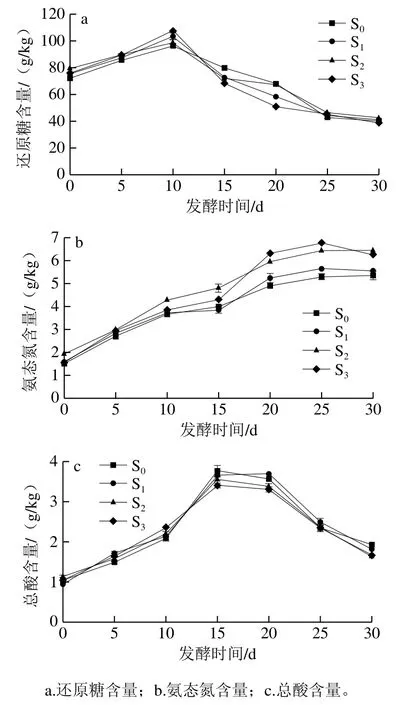
圖6 發酵過程中理化指標的變化Fig. 6 Changes in physical and chemical indicators during fermentation
2.4.2 不同制曲方式發酵西瓜黃豆醬的香氣成分分析
西瓜黃豆醬的香氣物質主要來源于制曲和發酵2個階段,原料、菌種、制曲方式、發酵工藝都對香氣組成有重要影響[23]。發酵結束時,分析4 種西瓜黃豆醬的揮發性風味物質,結果如表2所示。4 種不同制曲方式發酵的西瓜黃豆醬共檢測到54 種物質,其中醇類11 種、酯類13 種、酸類9 種、酚類8 種、醛類5 種、酮類4 種、其他物質4 種。不同制曲方式對西瓜黃豆醬揮發性風味物質的種類影響不顯著,但對其含量具有顯著影響。
醇類物質是發酵食品中一類重要的揮發性風味物質,S0~S3中醇類物質種類分別為7、9、10、11 種,S1、S2、S3較S0略有提升,但其含量相較于S0均有明顯提高,分別提升了61.31%、137.69%、168.98%。生成醇類物質的途徑主要有2 條,一條途徑是氨基酸與小分子糖類通過氧化反應生成,另一條途徑是由部分醛類物質轉化成醇類[24]。混合菌種制曲發酵菌株CS3.04與CS3.22所分泌的淀粉酶與蛋白酶發生協同作用,為生成醇類物質提供豐富的前體物質。S3中醛類物質含量最高,說明醛類物質的含量同醇類物質的含量呈正相關。其中苯乙醇在4 組樣品中均檢測到,S3含量最高,為3.36 mg/kg,分別比S0、S1、S2提高了160.46%、65.52%、12%,使S3具有更明顯的玫瑰花香;1-辛烯-3-醇在S1、S2、S3中均檢測到,其香味閾值較低,僅為1.5 μg/kg[25],該物質在西瓜黃豆醬中的香氣活性值均較高,賦予西瓜黃豆醬蘑菇及油脂香氣。
在發酵食品中,低濃度的醛、酮類化合物會帶來清新愉悅的香氣,高濃度則會產生刺激性氣味[26]。黃豆醬中醛類物質大部分來源于氨基酸脫氨基、脫羧基而生成,如苯甲醛、苯乙醛是由苯丙氨酸降解產生;另外一部分來源于微生物利用不飽和脂肪酸發生氧化反應而生成[27-28]。樣品S0、S1、S2、S3中醛類物質種類分別為1、2、3、5 種,而其醛類物質含量則分別為0.25、0.52、0.62、1.57 mg/kg,推測是蛋白酶活性直接影響氨基酸及多肽生成,從而間接影響醛類物質的種類及含量。己醛在4 組樣品中均檢測到,具有典型的西瓜香氣[11],是原料西瓜所賦予的獨特果香;乙縮醛在S3、S2中被檢測到,呈辛辣及芳草香;桃醛和苯甲醛僅在S3中檢測到,具有強烈的桃子香氣和苦杏仁氣味。
S0~S3中酮類物質種類分別為3、4、2、3 種,S1、S2、S3中酮類物質含量相較于S0分別提高63.41%、32.12%、164.25%。具有奶油香氣的3-羥基-2-丁酮在4 組樣品中均檢測到,S1、S2、S3中3-羥基-2-丁酮的含量是S0的3.86、2.30、1.57 倍。2-壬酮僅在S0和S1中檢測到,具有柔和的藥草香氣,是藥材姜黃的典型揮發性風味物質,為黃豆醬賦予醇厚感[29]。
酯類物質是西瓜黃豆醬中的主體香氣成分,S2和S3酯類物質含量相似,分別為3 305.36、3 129.72 mg/kg,高于S0與S1。其中棕櫚酸乙酯、亞油酸乙酯在4 組中占比較高,這3 種酯類均是濃香型白酒中一種典型的高級脂肪酸酯,能夠增加后味,可能是由于原料黃豆中含有20%左右脂肪,米曲霉通過分泌脂肪酶將脂肪分解為脂肪酸及甘油后經過復雜代謝反應生成[30-31];S3中異戊酸異戊酯、乙酸異戊酯、丁酸甲酯含量高于其他3 組,這些短鏈脂肪酸酯是黃豆醬的重要風味物質,具有清新的果香。
酸類物質主要作用是與其他香氣物質相輔相成、調和助香。S1中酸類物質含量最高,與理化指標中總酸含量吻合。S1的棕櫚酸、異戊酸、肉豆蔻酸含量均高于其他3 組,其中肉豆蔻酸具有乳脂和椰子油的香氣,而低濃度異戊酸具有甜潤果香,高濃度異戊酸具有不良氣味,對人類食道和呼吸道具有一定刺激性[32]。
酚類物質主要來源于小麥等碳水化合物原料中木質素代謝有關,增加原料中小麥粉比例可提高酚類物質含量[24]。S1的酚類物質含量最高,比S0提高了28.57%,其中愈創木酚及4-乙基愈創木酚這2 類酚類物質含量均高于其他3 組,它們是豆醬中典型的呈香物質,具有煙熏香和焦香。說明增強淀粉酶活性,提高淀粉質原料降解率,可以提升愈創木酚及4-乙基愈創木酚等酚類物質的含量。
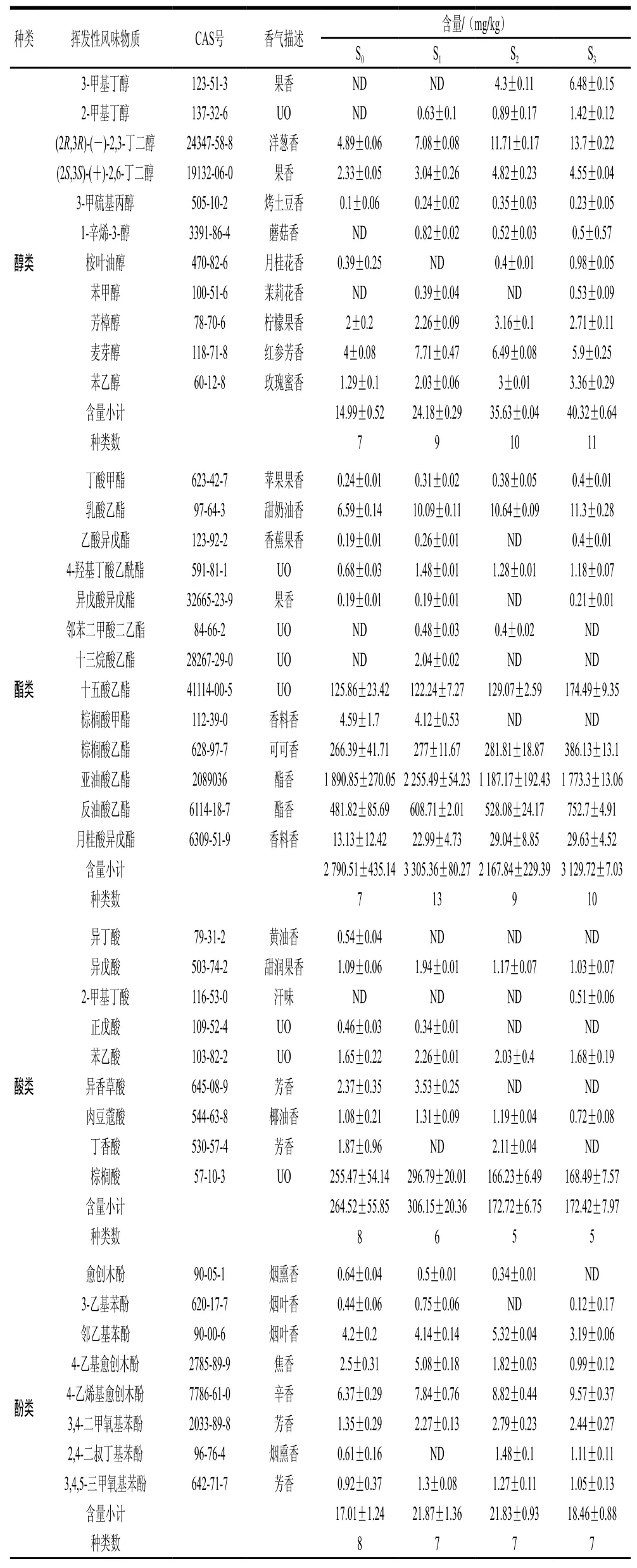
表2 發酵過程中揮發性風味物質成分及含量Table 2 Changes in composition and content of volatile flavor compounds during fermentation
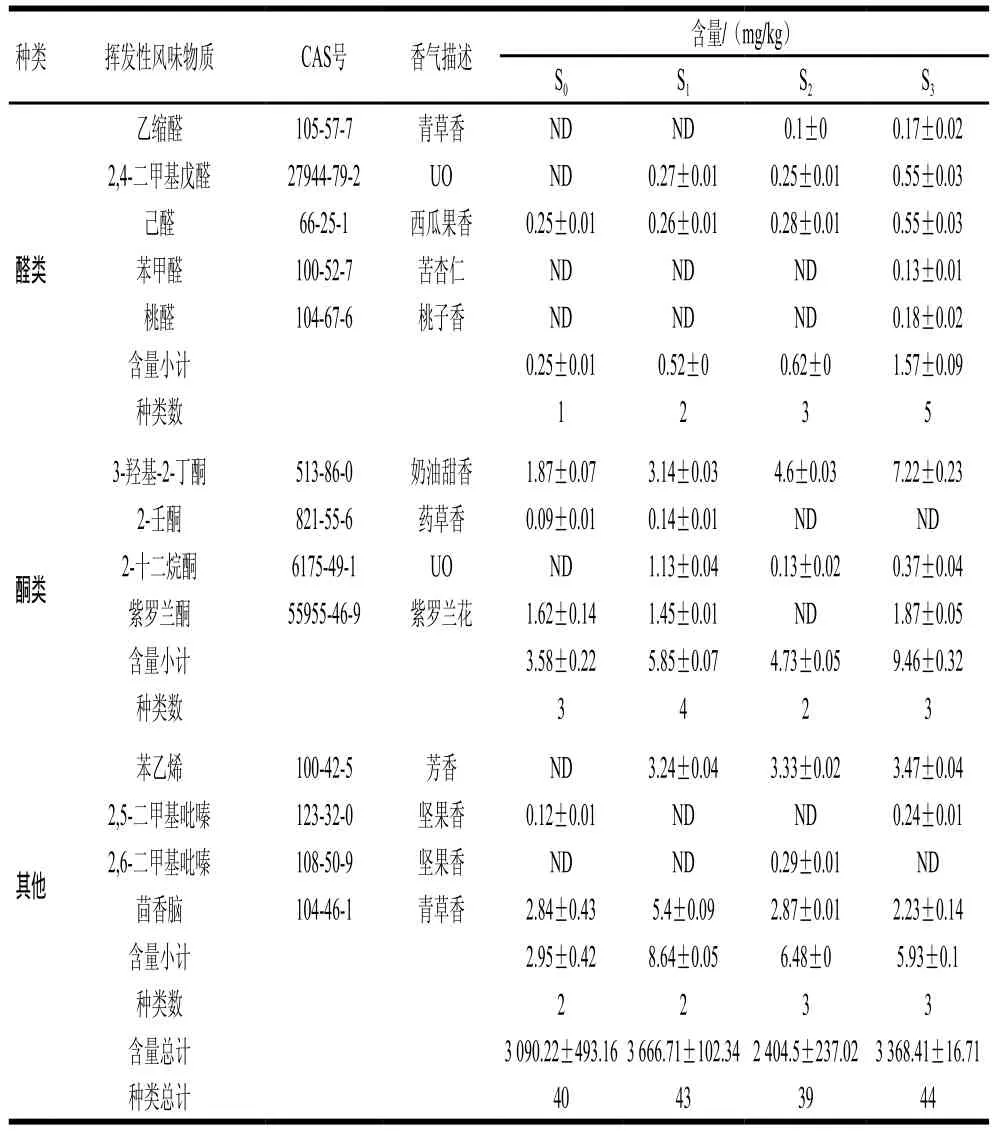
續表2
2.4.3 不同制曲方式發酵西瓜黃豆醬的感官評定結果
西瓜黃豆醬感官評定是鑒定其品質必不可少的一步,因此,在發酵結束期,對4 組生西瓜黃豆醬進行感官評定。如圖7所示,感官總分排名次序為S3>S2>S1>S0。滋味上,S2和S3優于S0和S1,說明蛋白酶活性對西瓜黃豆醬滋味具有顯著影響,與氨態氮含量趨勢結果保持一致。香氣上,S3>S2>S1>S0,這與揮發性風味物質含量測定結果不同,可能是由于不同風味物質香氣閾值存在差異,對于未達到其閾值的風味物質,則無法被嗅聞到。色澤及體態上,S3評分均高于其他3 組。說明CS3.04、CS3.22能夠改善西瓜黃豆醬的品質,并且通過混菌制曲發酵可以達到最佳效果。
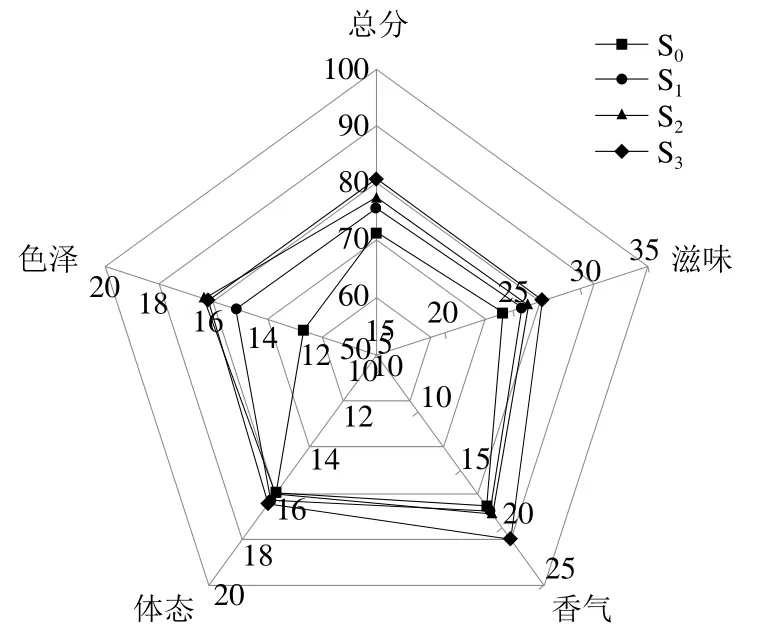
圖7 西瓜黃豆醬感官評分結果Fig. 7 Sensory scoring results of fermented watermelon-soybean paste
3 結 論
本研究篩選獲得1 株淀粉酶活性優良米曲霉CS3.04和1 株蛋白酶活性優良米曲霉CS3.22,將2 株菌株以不同制曲方式應用于西瓜黃豆醬發酵中,與單一菌種制曲發酵相比較,混合菌種制曲發酵中在理化指標、揮發性風味物質以及感官評定均占有一定優勢。混合菌種制曲發酵過程中,淀粉酶與蛋白酶發揮互補協同作用,提供豐富的糖類及氨基酸等小分子前體物質,使還原糖及氨態氮含量有所提升,有利于生成醛類、醇類、酮類及短鏈酯類等花果型香氣物質。研究發現,淀粉酶活性優勢菌CS3.04與蛋白酶活性優勢菌CS3.22混合菌種制曲發酵西瓜黃豆醬的工藝能為解決豆醬甜感不足、香氣寡淡等問題提供一條新的途徑,具有良好的應用潛力。

