CCR5 siRNA對類風濕關節炎大鼠滑膜細胞增殖周期的影響
王友強,蘭由玉,張 為,姚 娟,鄒興靜,劉 偉
1.西南醫科大學附屬中醫醫院檢驗科(瀘州 646000);2.西南醫科大學附屬醫院風濕免疫科(瀘州 646000)
類風濕關節炎(rheumatoid arthritis,RA)是一種全身性炎癥性免疫性疾病,其患病率約為1%,可導致關節的滑膜增生和關節破壞,最終出現關節畸形,功能喪失和生活質量下降[1]。成纖維樣滑膜細胞(fibro?blast-like synovial cells,FLS)是關節滑膜組織中的主要細胞,FLS的過度增生和滑膜血管翳形成是RA滑膜炎發展的關鍵因素,并且還表現出細胞增殖與凋亡失調[2-3],FLS釋放多種細胞因子加速了RA關節的破壞[4-5]。細胞周期進程的失調可導致FLS的過度生長,RA中細胞周期相關基因的異常表達可影響FLS的細胞周期進程[2,6]。
CC 趨化因子受體5(CC Chemokine Receptor 5,CCR5)是一種G 蛋白偶聯受體,與相應的促炎性趨化因子結合后在RA 等炎癥性免疫性疾病中有著重要的作用[7-8]。CCR5 與免疫和炎癥反應有關,其高效拮抗劑可減少膠原誘導的關節炎小鼠模型中的關節炎癥[9]。并且有研究發現CCR5 在RA 中明顯升高,并與RA 的發生發展有關[10-11]。小分子干擾RNA(small interfering RNA,siRNA)技術[12],主要是一種利用siRNA靶向沉默目標基因表達的技術。目前RA的具體發病機制仍不清楚,CCR5 在其中的作用機制報道甚少,因此本研究擬通過RNA 干擾技術抑制RA 大鼠滑膜細胞CCR5 的表達,以探討CCR5 基因沉默對RA 大鼠滑膜細胞增殖及細胞周期的影響,以便于進一步探尋RA的發病機制及可能的治療方法。
1 材料與方法
1.1 實驗動物與材料
1.1.1 實驗動物 SPF 級Wistar 雄性大鼠30 只,體重(171±8)g,購買于西南醫科大學實驗動物中心,實驗通過了西南醫科大學實驗動物倫理委員會批準。
1.1.2 材料 脂質體Lipofectamine 2000(美國Invitro?gen 公司),弗氏完全佐劑(CFA)(美國Sigma 公司),Trizol Reagent(日本Takara公司),逆轉錄試劑盒(美國Promega公司),MTT(美國Solarbio公司),PI染色液(上海如吉生物科技發展有限公司),CCR5 抗體、兔抗鼠Cyclin D1、兔抗鼠Cyclin E1、兔抗鼠Cyclin B1(英國Ab?cam公司),二抗(兔抗羊IgG)(英國Abcam公司),GAP?DH(美國Invitrogen 公司),PCR 試劑盒(日本Takara 公司),CCR5 siRNA(3 條)和NC siRNA(1 條)序列由GeneChem公司設計合成。
1.2 方法
1.2.1 siRNA 載體構建 將事先設計好的大鼠CCR5 siRNA(3條)和NC siRNA(1條)序列(見表1)經處理后構建成pU6-siRNA-GFP 載體(均由GeneChem 公司完成),再通過Lipofectamine 2000將載體轉入大鼠滑膜細胞,操作按照說明書進行。轉染完成48 h 后檢測細胞CCR5 mRNA的水平以判斷各條siRNA的轉染效率,我們前期的研究[13]已經明確選取了效率最佳的一條(CCR5 siRNA-2)進行后續實驗。

表1 CCR5 siRNA序列Table 1 CCR5 siRNA sequences
1.2.2 RA大鼠模型構建 SPF級Wistar雄鼠30只適應性飼養1 周后隨機分為2 組:Control 組10 只、RA 組20只。用膠原蛋白誘導法[14]構建RA 大鼠模型,具體方法為:將Ⅱ型膠原蛋白充分溶解于濃度為0.1 mmol/L 的醋酸溶液中,然后再將相同劑量的弗氏完全佐劑(com?plete freund’s adjuvant,CFA)充分與上述混合液一起混勻,最后放置在冰浴中待其完全乳化;用注射器在Wi?star雄鼠尾根部多處注射,同樣的方法再于1周后重復操作一次;Control組的Wistar雄鼠可以在同樣的時間、同樣的部位僅注射Ⅱ型膠原蛋白0.2 mg。采用關節炎癥指數(arthritis index,AI)評分法評估RA 大鼠模型是否構建成功,AI大于或等于4分提示造模成功,四肢評分標準見表2,每隔5 d觀察一次。

表2 AI評分標準Table 2 Arthritis Index score
1.2.3 滑膜細胞的分離與培養 用6 g/L的Ⅱ型膠原酶處理滑膜組織,37 ℃、5%CO2培養箱中消化3 h;再將細胞團用2.5 g/L的胰蛋白酶消化5 min;離心棄上清,將得到的細胞重新懸浮于含1.5 mL/L 胎牛血清、1×105U/L青霉素和100 mg/L 鏈霉素的DMEM 培養基中,置37 ℃、5%CO2條件下培養3~5 d使用臺盼藍初步判斷細胞的存活率,若存活率大于95%,可供后續實驗使用。第7 d,經2.5 g/L的胰酶-EDTA消化傳代細胞,取3代的細胞用于后續實驗。
1.2.4 滑膜細胞的轉染 在轉染前24 h,將待轉染的大鼠滑膜細胞以2×105個/mL 的密度鋪于6 孔板內;每孔添加500 uL 不含抗生素的完全培養液,放入37℃、5%CO2培養箱內孵育24 h后,待細胞匯合達50%即可用于轉染。本研究將細胞分為4 組:RA 組(RA 大鼠滑膜細胞)、RA+NC 組(加入脂質體包裹的NC siRNA)、RA+mock組(加入脂質體)、RA+siRNA組(加入脂質體包裹的CCR5 siRNA)。轉染前更換細胞培養基(37 ℃預溫),用250 μL 不含血清培養基OPti-MEM 稀釋100 pmol mock、siRNA(終濃度50 nM)及5 μL liPofectamin 2000,輕輕混勻并室溫孵育5 min后加入6孔板中輕搖,常溫放置20 min;再在6 孔板中添加含10%血清的細胞培養基,于37 ℃,5%CO2放置6~8 h 后,換完全培養基,持續放置48 h后獲取細胞。
1.2.5 CCR5、Cyclin D1、Cyclin E1、Cyclin B1 mRNA及蛋白水平測定 各組滑膜細胞用Trizol 法提取總RNA,并按照逆轉錄試劑盒說明書將RNA 逆轉錄為cDNA,再以GAPDH 為內參基因,將cDNA 進行PCR 擴增,引物序列,見表3。滑膜細胞以2×105個/mL的濃度平鋪于6 孔板培養72 h,加入蛋白裂解液提取蛋白,再利用10%SDS分離膠與濃縮膠電泳分離、轉膜,滴加稀釋的一抗兔抗鼠CCR5、兔抗鼠Cyclin D1、兔抗鼠Cy?clin E1、兔抗鼠Cyclin B1,4 ℃孵育過夜;加入二抗37 ℃振蕩孵育l h后用化學發光儀檢測。
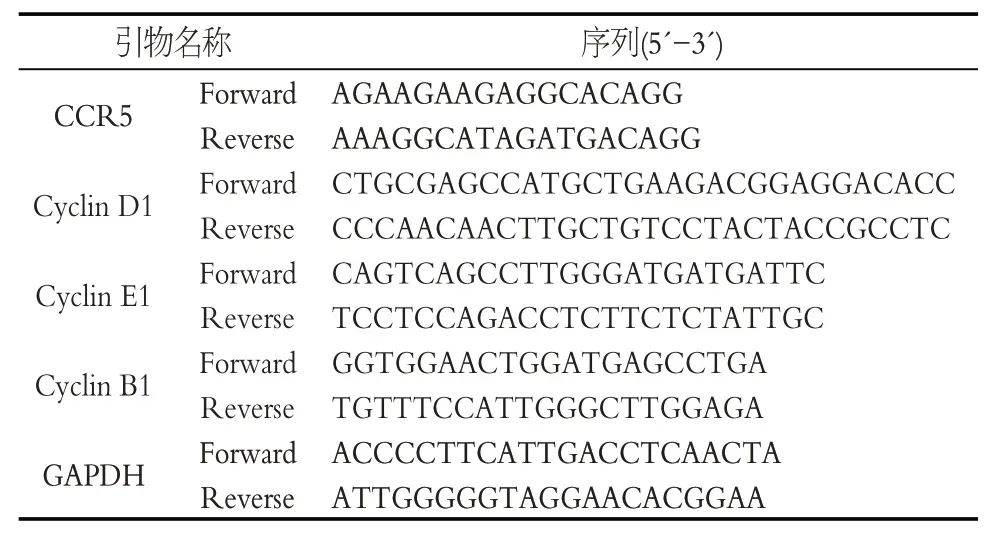
表3 引物序列Table 3 Primer sequences
1.2.6 MTT檢測細胞增殖情況 選取對數生長期的滑膜細胞以2×105個/mL 的密度100 μL 平鋪于96 孔板,每組各有3個相同的孔。在37 ℃、5%CO2條件下過夜,待細胞逐漸貼壁,24 h后換液,分別在相同條件下培育后的第0、24、48 和72 h 時添加5 mg/mL 的MTT 20 μL再培育4h,棄上清,每孔加入DMSO 150 μL,震蕩10 min。酶標儀分別測定第0、24、48和72 h時各孔吸光值(A490)值,并作好記錄,以3孔的平均值為最終結果。
1.2.7 PI 單染檢測細胞周期 將快速生長期的滑膜細胞鋪于6 孔板,其密度為1.2×105個/mL,每孔2 mL,培養24 h 后,每組設置3 個復孔。用不含EDTA 的胰酶消化、收集細胞,2 500 rpm/min 離心5 min。PBS 洗滌× 2次,離心收集細胞,加3mL 70%酒精處理,4 ℃靜置一夜。第二天,離心,去除上清液,添加PI 染色液,4 ℃避光30min。染色結束后,用細胞濾網過濾,流式細胞儀上樣,在大于575 nm下檢測PI,計算細胞周期百分比。
1.2.8 統計學分析 用SPSS 21.0 分析所得數據,計量資料以()表示,兩樣本均數比較t 檢驗,多組間比較采用單因素方差分析,數據正態性檢驗采用Kol?mogorov-Smirnov 法,呈正態分布的數據多組間比較使用One way AVONA 分析。P <0.05 表示差異有統計學意義。
2 結果
2.1 RA大鼠模型鑒定
在給大鼠注射弗氏完全佐劑(CFA)8 h后,RA組大鼠在注射一側足趾部位出現紅腫等關節炎癥的表現,24 h后出現足踝部腫脹。10 d后RA模型大鼠表現出多關節炎,具體為前肢或對側肢體甚至耳、尾均有前面所述的炎癥反應的表現。皮毛暗沉,有部分褪毛現象,體重下降,食欲減退,活動量減少,甚至有脫皮、潰瘍和結節。10 d 時RA 組大鼠AI(1.31 ± 0.63)較5 d 時(0.98±0.54)明顯升高(P <0.05);分別與10 d(1.45 ± 0.58)、15 d(5.06±1.29)時AI 比較,25 d 時AI(7.22±1.23)進一步增高(P <0.05),且AI隨著時間的增加而升高,見圖1。而Control 組大鼠無關節炎癥等表現。由此可見RA大鼠模型構建成功。
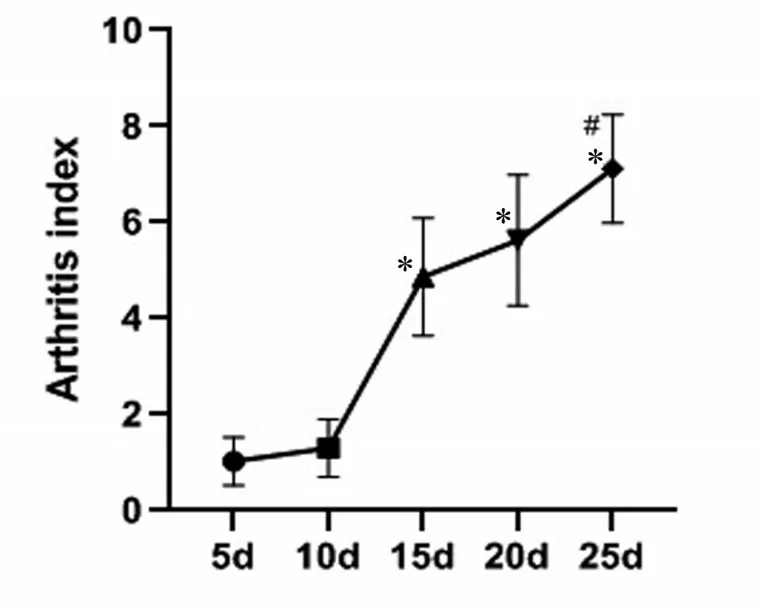
圖1 RA組大鼠關節炎指數(AI)Figureure 1 The Arthritis Index of RA group
2.2 siRNA轉染效率
轉染大鼠滑膜細胞48 h 后,qRT-PCR 測定CCR5 mRNA表達水平,由圖2可知,與CCR5 siRNA-NC組相比,3 條siRNA 序列轉染后均可引起CCR5 mRNA 明顯下降(P <0.05),其中CCR5 siRNA-2 序列轉染效率較CCR5 siRNA-1 和CCR5 siRNA-3 更高。因此本研究選用CCR5 siRNA-2序列為最終實驗所用序列,進行后續研究。
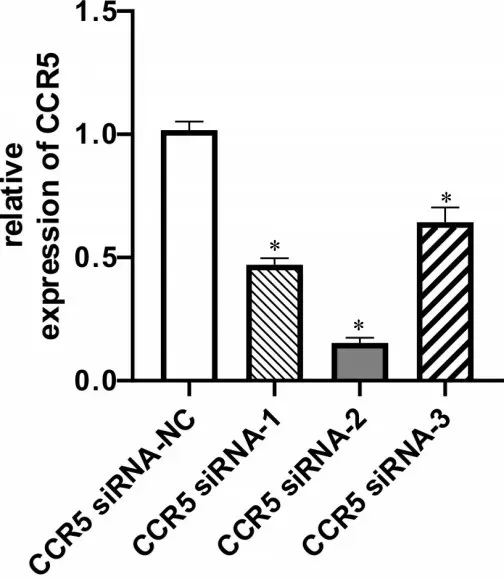
圖2 CCR5 siRNA序列轉染效率Figureure 2 CCR5 siRNA transfection efficiency
2.3 沉默CCR5 對CCR5、Cyclin D1、Cyclin E1、Cy?clin B1 mRNA水平的影響
各組RA 大鼠滑膜細胞CCR5、Cyclin D1、Cyclin E1、Cyclin B1 mRNA 表達水平如圖3A、3B 所示:與RA組相比,RA+siRNA 組CCR5 mRNA 表達水平(1.16 ±0.21)較(1.85±0.61)明顯下降(P <0.05),進一步驗證了CCR5 siRNA 轉染是有效的,見圖3A;圖3B 提示,RA+siRNA 組Cyclin D1、Cyclin E1、Cyclin B1 mRNA 水平(1.32±0.01)、(1.23±0.26)、(1.33±0.05)分別較RA組(1.52±0.06)、(1.68±0.08)、(1.94±0.07)顯著降低,差異有統計學意義(P <0.05);而RA+NC組、RA+mock組較RA組無明顯變化(P >0.05)。
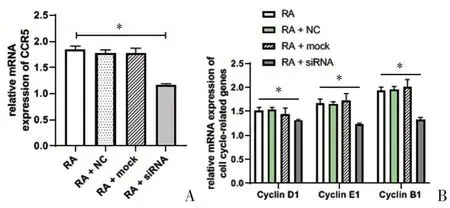
圖3 CCR5、Cyclin D1、Cyclin E1、Cyclin B1 mRNA水平比較Figureure 3 ThemRNAexpressionofCCR5、CyclinD1、CyclinE1、CyclinB1
2.4 沉默CCR5 對CCR5、Cyclin D1、Cyclin E1、Cy?clin B1蛋白水平的影響
各組RA 大鼠滑膜細胞CCR5、Cyclin D1、Cyclin E1、Cyclin B1蛋白表達水平如圖4A、4B所示:與RA組相比,RA+siRNA 組CCR5 蛋白水平(0.19 ± 0.01)較(0.44±0.05)明顯下降(P <0.05),見圖4A;由圖4B可知,RA+siRNA 組Cyclin D1、Cyclin E1、Cyclin B1 蛋白水平(0.88±0.03)、(1.46±0.13)、(1.56±0.13)分別較RA組(1.38±0.03)、(1.98±0.12)、(2.13±0.08)顯著降低,差異有統計學意義(P <0.05);而RA+NC 組、RA+mock組較RA組無明顯變化(P >0.05)。
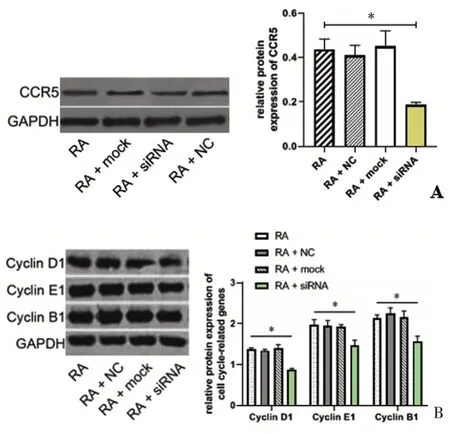
圖4 CCR5、Cyclin D1、Cyclin E1、Cyclin B1蛋白水平比較Figureure 4 TheproteinexpressionofCCR5、CyclinD1、CyclinE1、CyclinB1
2.5 CCR5基因沉默對RA大鼠滑膜細胞增殖的影響
本研究采用MTT 協助判斷沉默CCR5 對RA 大鼠滑膜細胞增殖情況的影響,見圖5。與RA 組相比,RA+siRNA 組滑膜細胞出現明顯生長抑制,且隨時間增長其抑制效果逐漸增大(P <0.05),而RA+mock組、RA+NC組無特別變化(P >0.05)。
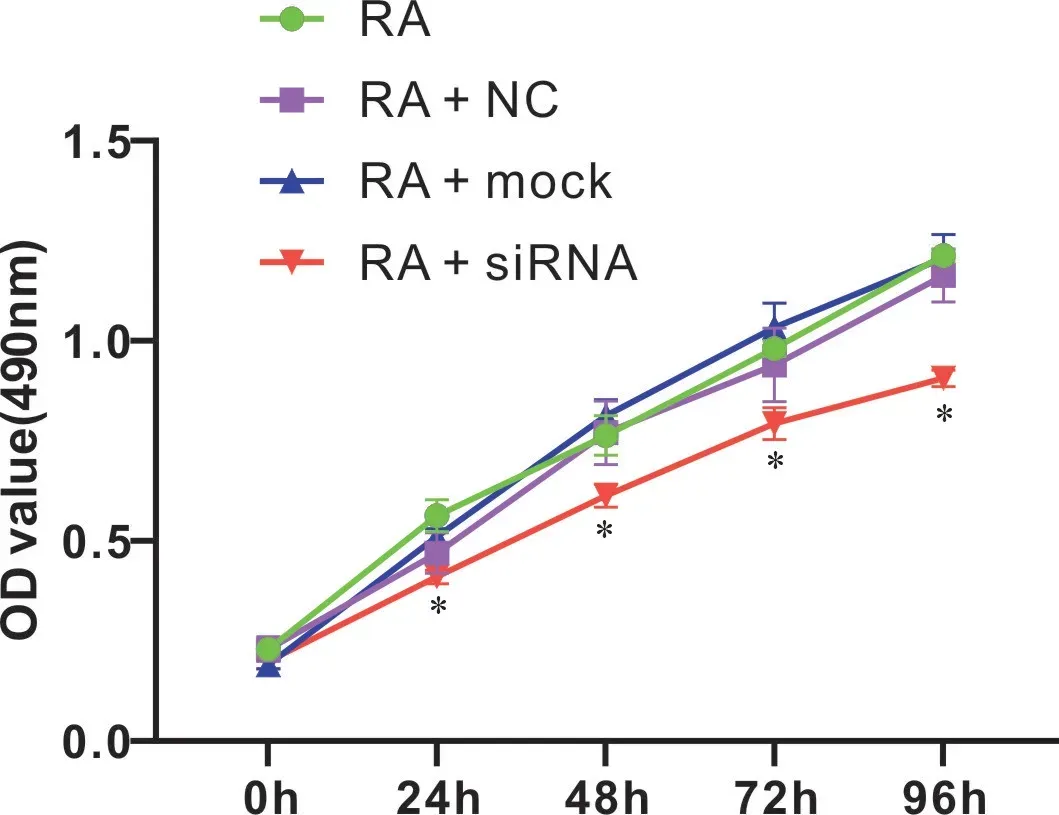
圖5 各組RA大鼠滑膜細胞增殖情況比較Figureure 5 The synoviocytes proliferation of each group
2.6 沉默CCR5對RA細胞周期分布的影響
PI 單染測定細周期分布情況,見圖6。與RA 組對比,RA+siRNA 組RA 大鼠滑膜細胞G0/G1 期比例(70.27 ± 1.06)%較(59.26 ± 0.59)%上升,S 期比例(14.10±0.82)%較(23.94±1.71)%降低(P <0.05),而RA+mock、RA+NC組無明顯變化(P >0.05)。
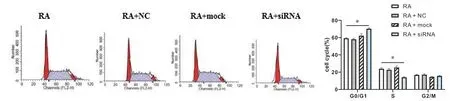
圖6 各組RA大鼠滑膜細胞細胞周期分布情況比較Figureure 6 The cell cycle distribution of each group
3 討論
RA 發病機理受多種因素的影響,包括遺傳、表觀遺傳學和環境因素以及免疫紊亂和細胞因子等因素[15-16]。活化的RA-FLS 表現出與腫瘤細胞相似的增殖特征,其腫瘤樣增殖特性可導致滑膜增生發展,逐漸出現軟骨的侵蝕及關節破壞[3,17]。RA-FLS 具有激活細胞周期和抗細胞凋亡的特性,從而可導致細胞增殖[18]。同時,細胞周期又控制著細胞生長或凋亡的潛力[6,19]。
細胞周期分為DNA合成前期(G1期),DNA合成期(S期),DNA合成后期(G2期)和分裂期(M期),大多數細胞處于G0/G1期[20]。細胞周期的正確進展取決于細胞周期蛋白的表達水平以及細胞周期蛋白依賴性激酶(Cdks)的激活[21]。本研究發現,CCR5 siRNA干預后RA大鼠滑膜細胞的生存能力受到抑制,G0/G1 期滑膜細胞比例增大,S 期細胞的比例減少,提示沉默CCR5 可明顯抑制滑膜細胞的生長,并影響細胞周期的分布。有還研究發現,通過調節細胞周期調節因子將細胞周期阻滯在G1 到S 相轉變,即G1 停滯,即可抑制FLS 的增殖[22]。細胞周期從G1 到S 期的進展還受Cyclin D 和Cy?clin E及其同系激酶CDK 2,CDK 4和CDK 6的調節[22],且可通過誘導細胞周期停滯在G0/ G1 期來抑制RA-FLS的增殖[23]。
此外,CCR5沉默可抑制CCR5的表達,還可調節細胞周期相關基因的表達,相應地,CCR5、Cyclin D1、Cy?clin E1 和Cyclin B1 的表達均降低。細胞周期調節劑是控制RA-FLS 分裂和增殖的強制因素,可先后作用于Cyclin D、pRB和Cyclin E,進而加速RA-FLS的DNA合成和增殖[6]。其中cyclin D1 在RA 的滑膜細胞增殖和凋亡中起了重要作用[24]。細胞周期相關蛋白的異常表達與RA的疾病進展有關[19]。Cyclin D1和Cyclin E1是細胞周期的調節因子[25],主要調控G1/S 期轉化,其中Cyclin D1的主要功能在于促進細胞增殖,而Cyclin E是G1晚期的重要調控因子;Cyclin B1是細胞周期中G2/M階段的主要介質[26],主要與M期的完成有關。
4 結論
本研究結果顯示,沉默CCR5可抑制滑膜細胞的生長,使G0/G1期滑膜細胞比例增加,S期細胞比例減少,還可通過調節與細胞周期相關的基因表達來影響細胞周期的分布,進而抑制滑膜細胞的增殖。本研究為CCR5基因沉默作為RA治療的潛在靶點提供了實驗依據,但還需進一步大規模的研究闡明RA 滑膜細胞中CCR5的潛在機制。
(利益沖突:無)

