龍船花花藥愈傷組織誘導研究
余惠文,左 梅,柯玲俊,王玉玲,陸鑾眉*
(1.閩南師范大學生物科學與技術學院,福建 漳州 363000;2.閩臺特色園林植物福建省高校重點實驗室,福建 漳州 363000)
龍船花(Ixora chinensisLam)又名白日紅、仙丹花、山丹花等,是茜草科(Rubiaceae)、龍船花屬(IxoraLinn.)植物,龍船花花色艷麗、植株較矮,應用廣泛[1].茜草科龍船花屬植物世界上約有400 種,其中大多數品種分布在熱帶地區,而我國主要分布在云南省和福建省等大部分地區,約有19 種[2].龍船花花期比較長,花期從3月至12月份[3],可用于鮮切花[4]和園林景觀應用[5-6],此外龍船花具有一定的藥用價值[7].
花藥愈傷組織誘導培養基的各種生長調節劑濃度組合、植物材料的基因類型、花蕾的生長發育時期、植物材料的預處理方法差異等培養條件都會對花藥愈傷組織的誘導產生不同的影響[8].龍船花組織培養和快速繁殖的相關研究為龍船花花藥愈傷組織誘導積累了理論基礎[9-11].龍船花在生產上應用廣泛,而相關育種研究相對滯后,尤其對其花藥愈傷誘導相關研究未見報道.花藥培養在植物育種中具有重要的用途,研究龍船花花藥誘導愈傷的培養條件,建立龍船花花藥誘導愈傷組織培養體系,有利于龍船花育種以及開展相應分子機理研究.因此,本研究應用不同植物生長調節劑濃度組合的培養基對兩個不同品種的龍船花花藥進行愈傷誘導,并探索低溫預處理花藥時間對愈傷誘導的影響,篩選出適合龍船花花藥培養的誘導培養基以及低溫預處理最佳時間.
1 材料與方法
1.1 植物材料
供試驗的龍船花品種為“杏黃龍船花”和“宮粉龍船花”(圖1).采集地點為閩南師范大學生物科學與技術學院植物園.

圖1 本研究使用的龍船花品種Fig.1 Ixora chinensis accessions used in the study
1.2 實驗方法
1.2.1 培養基制備
誘導培養的基礎培養基為MS 培養基+蔗糖30 g·L-1+活性炭0.5 g·L-1+瓊脂8 g·L-1,分別添加不同濃度的2,4-D和KT,本研究設計了25組誘導培養基(表1),培養基的酸堿度調節至5.8.
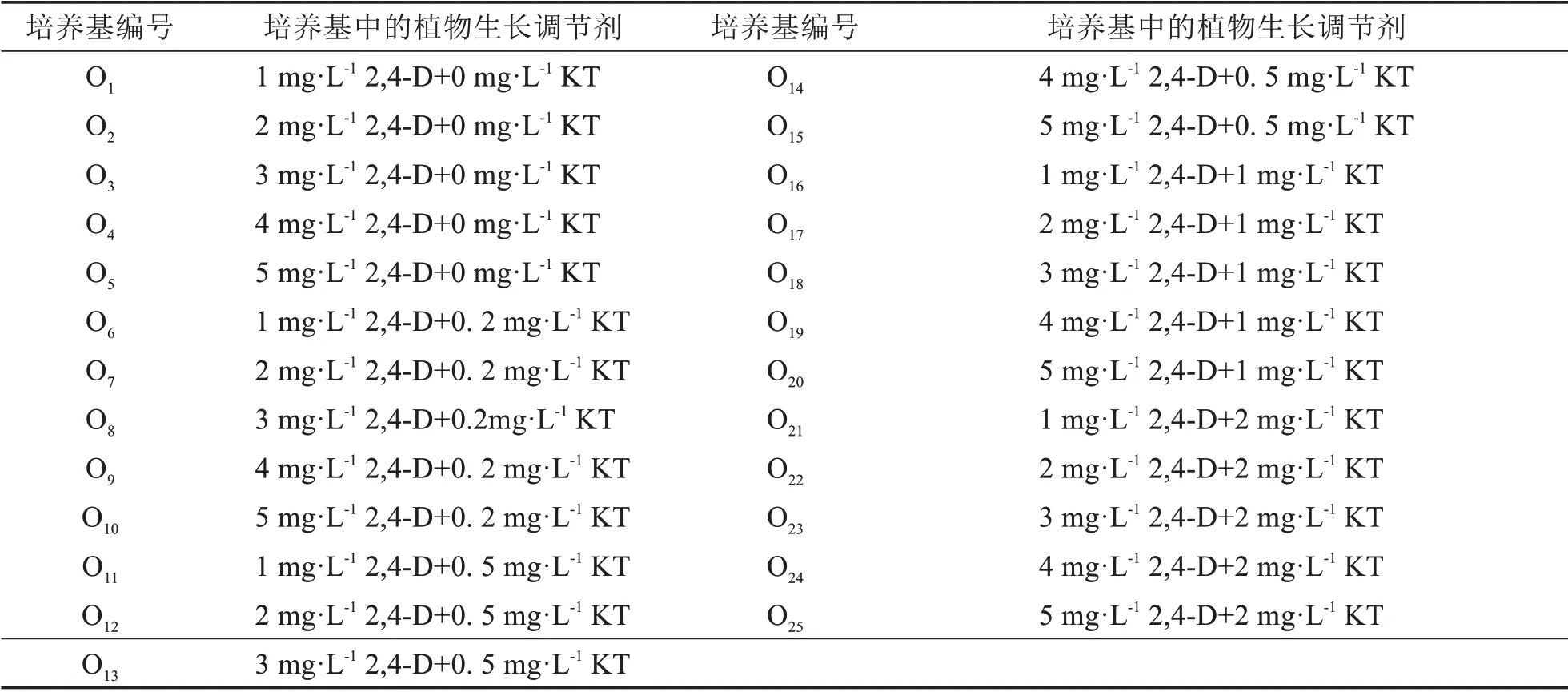
表1 誘導培養基Tab.1 Induction medium with plant growth regulators(PGRs)
1.2.2 花穗取材及低溫預處理
花穗取材一般在晴朗的早晨9∶00至11∶00摘取,選取單核中晚期、外觀品質正常、無病蟲害的龍船花花蕾,用枝剪將一整枝花團剪下,裝入保鮮袋帶回實驗室.把摘下的花蕾放入密封袋,在4 ℃冰箱中低溫預處理0、24、36、72 h后以備用,繼而用O13培養基進行愈傷組織誘導.
1.2.3 花藥接種
將花蕾置于體積為100 mL 的三角瓶里面,在紫外線滅菌后的超凈工作臺上先用75%乙醇浸泡30 s后,用無菌水沖洗1次;再用2%次氯酸鈉溶液浸泡10 min后,浸泡過程中輕微振蕩三角瓶,使其花蕾消毒徹底,最后用無菌水沖洗2至3次.把花蕾放在有無菌濾紙的培養皿里(挑選生長良好以及保存良好的花蕾).選擇處于單核期的個頭飽滿的、無破損的花藥以備接種.在接種過程中,用滅菌后的鑷子和解剖刀將花藥輕輕剝開,然后接種到誘導培養基中,每個皿接種20粒.
1.2.4 培養觀察及數據分析
將接種好的花藥培養皿放入(27±1)℃條件下的培養箱進行暗培養.培養三天左右開始觀察污染狀況,分別觀察培養3、4、5、6、7 d后的花藥,排除污染、褐化以及其他原因導致死亡的花藥,記錄其花藥誘導出愈傷組織所需的培養時間,20 d 后觀察長愈傷組織的情況并統計數據,計算每個時間段愈傷組織的誘導率,然后每隔十天記錄一次.分別統計20、30、40 d 時的愈傷組織數目并計算愈傷組織的誘導率,整理數據并分析結果.誘導率計算公式為
誘導率=產生的愈傷組織數/接種成活的花藥數×100%.
2 結果
2.1 花藥愈傷組織誘導
將生長狀況良好且不同生長時期的花藥進行分類,分別制片.用醋酸洋紅染液進行染色在40×顯微鏡下觀察,在花蕾長約為8 mm 時花粉發育時期處于單核期(圖2A、B),并取該時期花藥在MS 培養基+蔗糖30 g·L-1+活性炭0.5 g·L-1+瓊脂8 gL-1+3 mg·L-12,4-D+0.5 mg·L-1KT 培養基中進行接種培養.兩種龍船花品種僅“杏黃龍船花”花藥可誘導出愈傷,花藥接種培養15 d 開始長出愈傷組織,愈傷組織比較光滑,呈半透明狀.繼續培養20 d后愈傷組織形狀不規整,顏色較淺(圖2C).將愈傷組織轉移到光照條件下培養,愈傷組織即轉成綠色,整體質地較硬(圖2D).
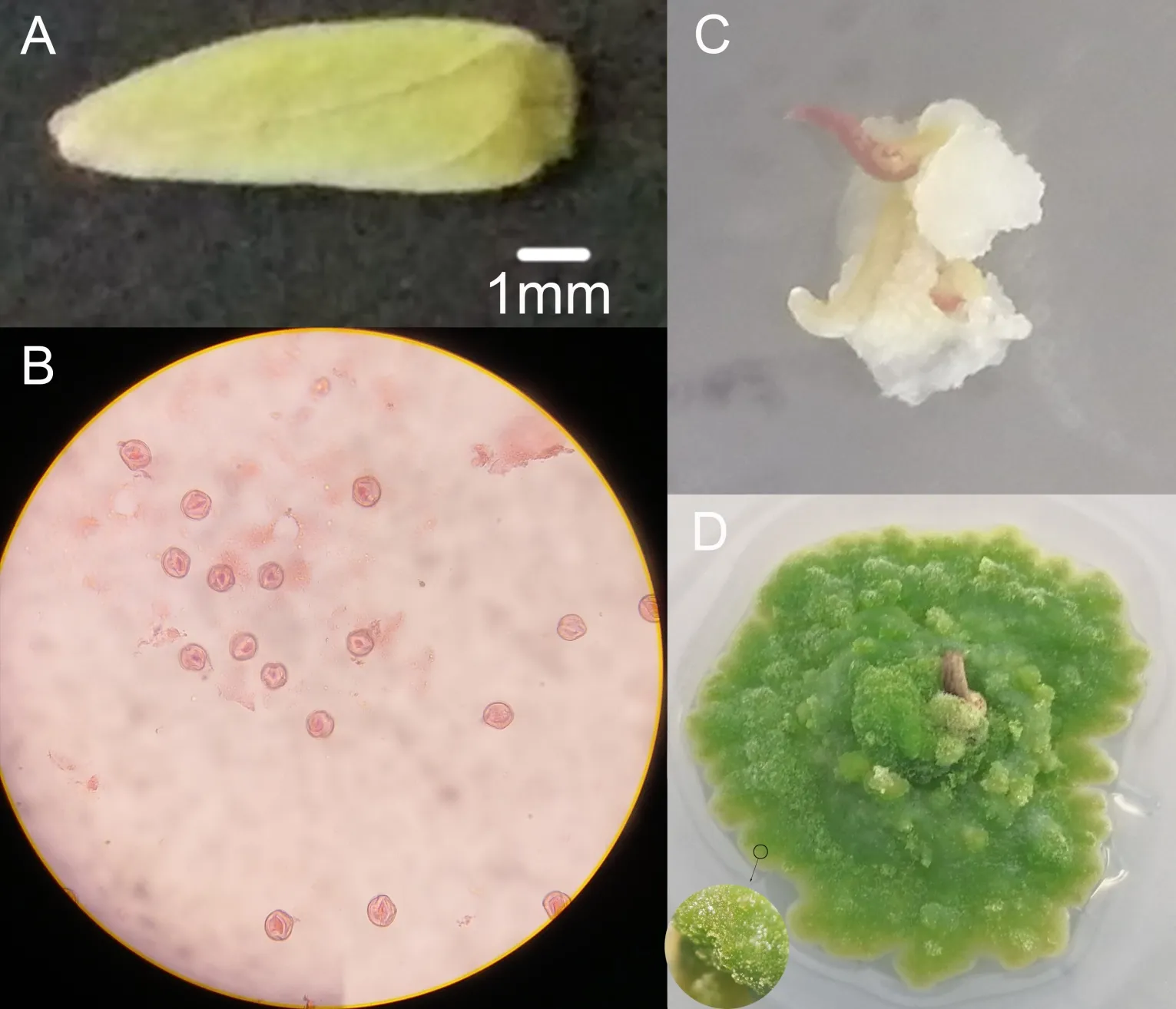
圖2 花粉發育時期觀察Fig.2 Observation of pollen development period
2.2 不同濃度的植物生長調節劑組合對龍船花花藥愈傷組織誘導的影響
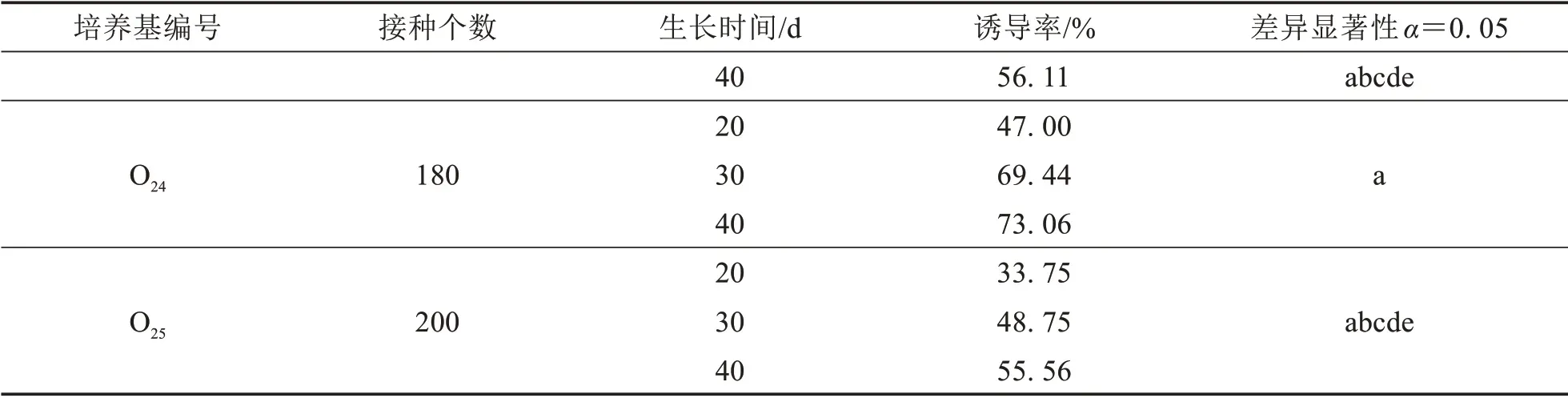
用含不同濃度植物生長調節劑的培養基培養的“杏黃龍船花”花藥均能誘導出愈傷組織,而“宮粉龍船花”均未誘導出愈傷組織.培養20 d時,“杏黃龍船花”花藥愈傷的誘導率在2.80%~47.00%之間,培養30 d 時花藥愈傷的誘導率在19.07%~69.44%之間,培養40 d 時花藥愈傷的誘導率在26.67%~73.06%之間(表2).在KT 濃度分別為0.2、0.5 和2 mg·L-1時,愈傷誘導率隨著2,4-D 濃度的升高呈現先增加后減少的趨勢,且均在2,4-D 濃度為4 mg·L-1時為峰值.在MS 培養基+4 mg·L-12,4-D+2 mg·L-1KT 誘導培養基中,培養20、30 和40 d 時龍船花花藥愈傷誘導率均為最高,且40 d 時龍船花花藥愈傷誘導率達到最高73.06%.不同濃度植物生長調節劑培養條件下誘導出的龍船花愈傷組織生活力旺盛,形態外觀以及生長速率上沒有明顯差異.
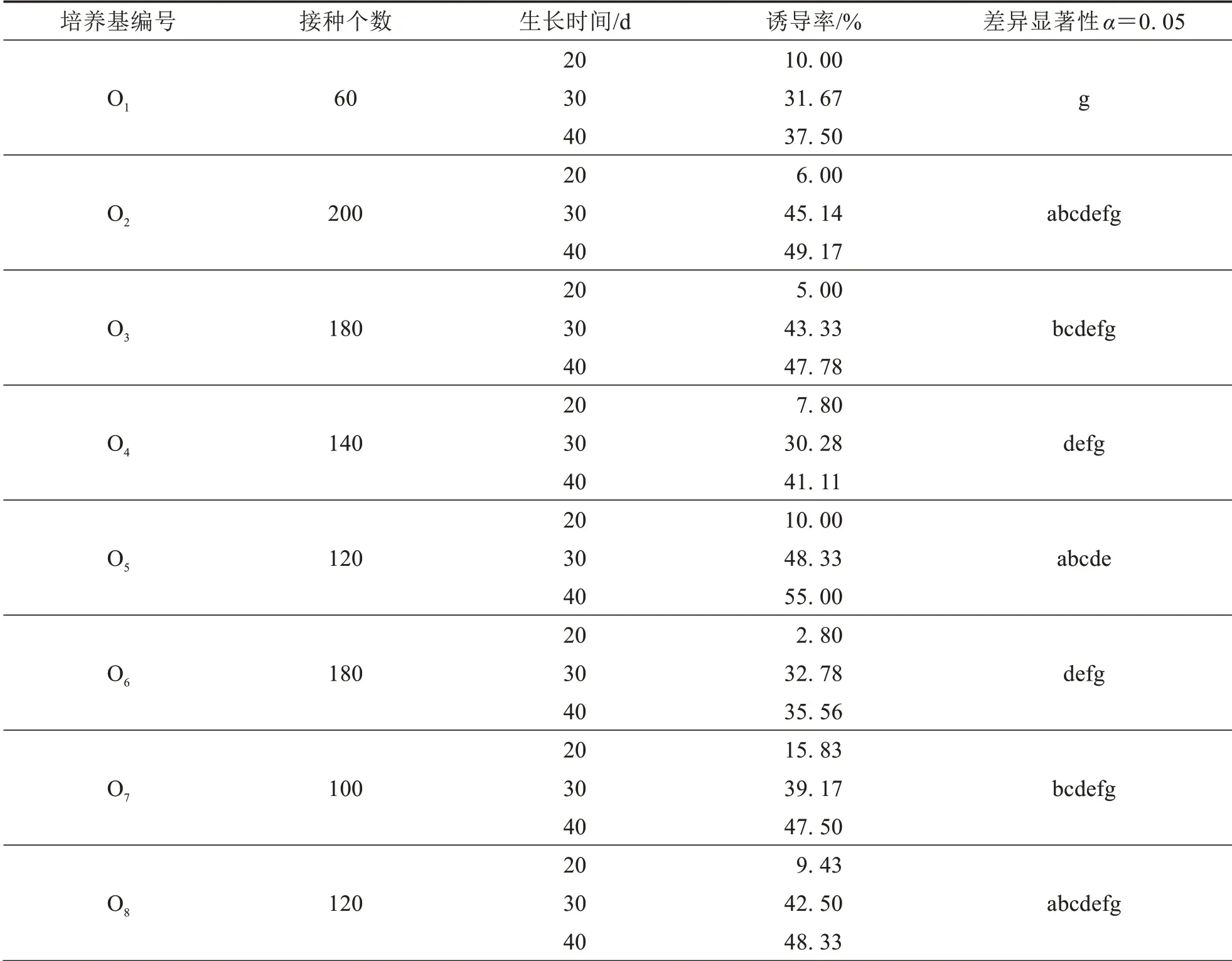
表2 不同濃度的植物生長調節劑組合對花藥培養的影響Tab.2 The influence of the medium with different concentrations of plant growth regulators on anther culture
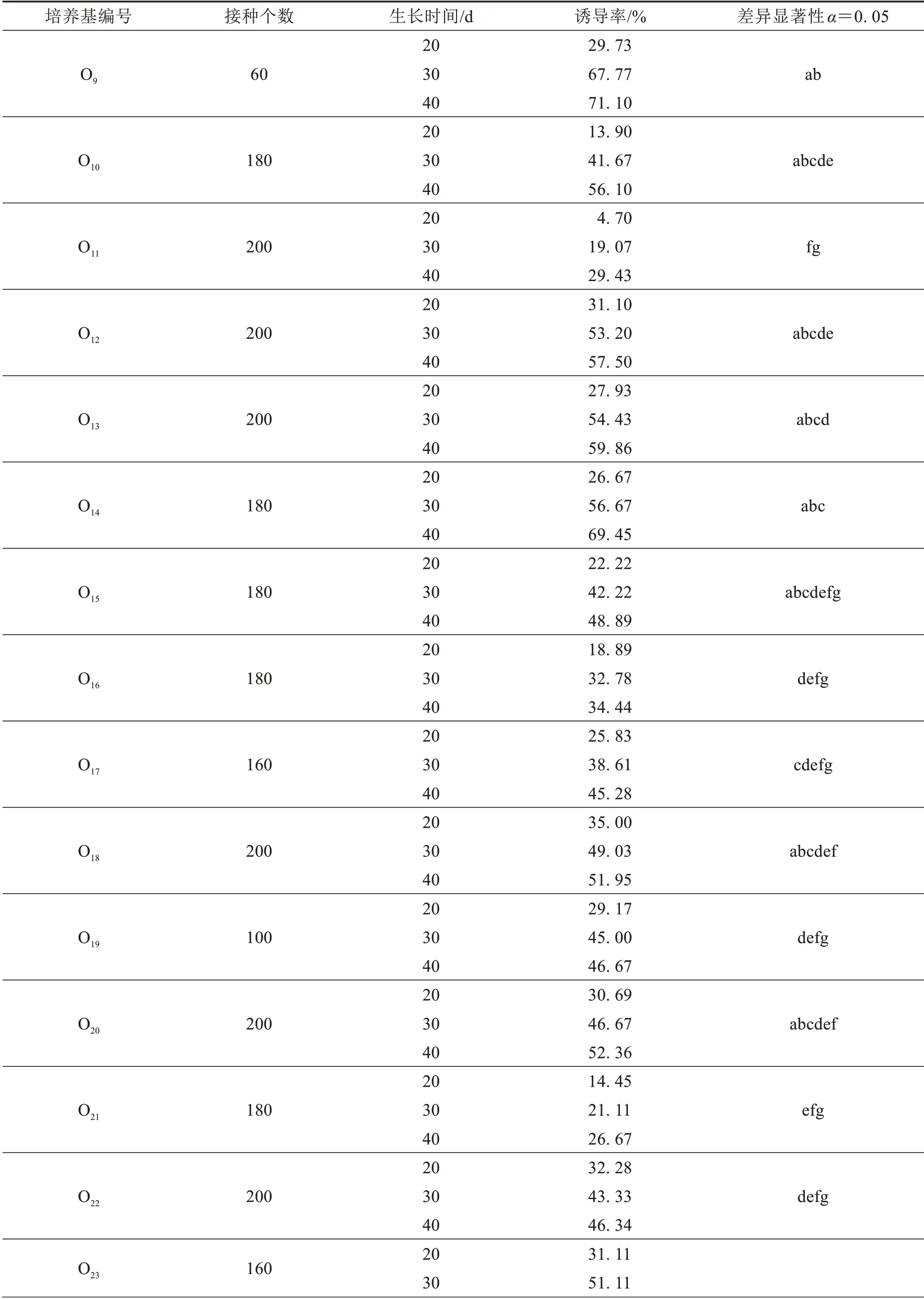
續表2
續表2
2.3 低溫預處理對花藥愈傷組織誘導的影響
4 ℃條件下低溫預處理不同時間對“杏黃龍船花”花藥誘導愈傷效率的影響不同(表3).龍船花花藥經過4 ℃低溫分別預處理0、24、48、72 h后,花藥均能誘導出愈傷組織.預處理24 h的效果最佳,培養30 d和40 d的誘導率分別為67.78%和75.00%,40 d時愈傷誘導率顯著高于未經低溫預處理的誘導率.

表3 不同預處理時間對愈傷誘導的影響Tab.3 Effects of different pretreatments time on callus induction
3 討論
龍船花應用廣泛,是十分重要的園林觀賞植物之一.花藥培養技術已廣泛用于十字花科[12]和禾本科[13-14]等農作物研究,本研究首次報道了龍船花花藥誘導愈傷的研究,為龍船花育種以及基礎研究提供理論參考.
利用花藥培養誘導形成愈傷組織,不同材料的誘導成功率有很大差異[15].馬洪民等[16]對26個不同草莓品種進行花藥培養研究時發現,草莓品種的基因型不同,其花藥的離體培養,愈傷組織誘導能力上也有顯著不同.26個草莓品種中只有9個品種誘導出愈傷組織.不同基因型在燕麥花藥組織培養的影響表現為能否誘導出愈傷,誘導愈傷組織的多少等[17].由此可見,基因對花藥培養效果起主要決定作用.相同培養條件下,“杏黃龍船花”均能誘導出愈傷組織,而“宮粉龍船花”未能誘導出愈傷,結果表明不同基因類型的供體材料對花藥愈傷組織的誘導具有不同的影響.基因類型對龍船花花藥愈傷組織的誘導作用是決定性的,與“宮粉龍船花”相比,“杏黃龍船花”為較易誘導花藥愈傷的品種.
植物生長調節劑2,4-D 常用于誘導植物組織分化愈傷組織,矮生龍船花莖段在2,4-D 濃度為2 mg·L-1的培養基中產生愈傷組織[12],“杏黃龍船花”花藥誘導愈傷的適宜2,4-D 濃度則為4 mg·L-1.低溫預處理有利于花藥愈傷組織的形成在其它物種中多有報道[13-14,17-19].郭新梅等[19]研究比較了基因型、低溫預處理以及處理時間、及植物生長調節劑配比等因素對玉米花藥培養效率的影響,研究表明適當的植物生長調節劑配比和低溫預處理均可提高花藥愈傷組織的誘導率.本實驗研究結果與前人的研究結果類似,同一培養基條件下,龍船花花藥在接種前進行適當的低溫預處理,誘導率高于未經預處理時的誘導率,由此可見,適當的低溫預處理有助于龍船花花藥愈傷組織的誘導,“杏黃龍船花”花藥在4 ℃低溫預處理24 h 后愈傷組織誘導率顯著高于未經低溫預處理的誘導率.
綜上,“杏黃龍船花”花藥較易誘導產生愈傷組織,通過25 個處理組合試驗篩選出MS 培養基(含30 g·L-1蔗糖+0.5 g·L-1活性炭+8 g·L-1瓊脂)+4 mg·L-12,4-D+2 mg·L-1KT為誘導龍船花花藥產生愈傷組織的最適培養基.“杏黃龍船花”花藥在4 ℃低溫預處理24 h可提高愈傷誘導率.

