外來(lái)入侵物種紫莖澤蘭的抗氧化活性研究
張朝志,袁彩蓮,程依婷,佘 容*,肖 文,3,4
(1.大理大學(xué) 天然抗氧化劑和氧化炎癥研究院,云南 大理 671003;2.大理大學(xué) 東喜瑪拉雅研究院,云南 大理 671003;3.中國(guó)三江并流區(qū)域生物多樣性協(xié)同創(chuàng)新中心,云南 大理 671003;4.大理大學(xué) 三江并流區(qū)域生物多樣性保護(hù)與利用云南省創(chuàng)新團(tuán)隊(duì),云南 大理 671003)
氧化應(yīng)激是人體內(nèi)致氧化與抗氧化作用失衡,即機(jī)體內(nèi)活性氧(reactive oxygen species,ROS)的產(chǎn)生和抗氧化防御系統(tǒng)失衡所致[1-2]。研究[3]表明,人體多種疾病的發(fā)生都與氧化應(yīng)激損傷有關(guān)。因此,醫(yī)學(xué)上常添加能夠有效抑制或清除自由基的抗氧化劑以協(xié)助維持體內(nèi)氧化與抗氧化系統(tǒng)的平衡,防止相關(guān)疾病的發(fā)生和保持機(jī)體的健康。目前,常用的抗氧化劑主要是VC和VE,但隨著大健康時(shí)代的到來(lái),人們更偏好使用天然抗氧化劑。因此,充分開發(fā)利用自然界已存在的天然抗氧化劑具有重要意義。
紫莖澤蘭(EupatoriumadenophorumSpreng),為菊目菊科澤蘭屬植物。其生命力強(qiáng)、適應(yīng)性廣,能釋放多種化感物質(zhì)以抑制周圍其它植物的生長(zhǎng),是一種侵占性極強(qiáng)的惡性有毒入侵植物[4]。目前,紫莖澤蘭在我國(guó)的入侵規(guī)模日益擴(kuò)增,尤其在云南、四川、廣西、貴州等省份已呈蔓延趨勢(shì),對(duì)農(nóng)林牧業(yè)造成了巨大損失,并嚴(yán)重影響了生態(tài)環(huán)境[5-6]。近年來(lái),為了變害為寶,研究者對(duì)紫莖澤蘭的化學(xué)成分進(jìn)行了研究[7-9],已有關(guān)于紫莖澤蘭的毒理研究[10]和抗氧化活性研究,尤其是對(duì)致病菌抑制作用[11-14]的相關(guān)報(bào)道。胡楚嬌等[15]利用DPPH法對(duì)紫莖澤蘭醇提物的抗氧化活性進(jìn)行了研究,發(fā)現(xiàn)紫莖澤蘭具有較強(qiáng)的抗氧化活性。但是,眾多關(guān)于植物活性物質(zhì)的研究表明,利用不同極性溶劑萃取所得萃取物的活性成分是不同的,其功效也存在很大差異。因此,作者利用不同極性溶劑萃取紫莖澤蘭葉的有效成分,并通過(guò)DPPH法、ABTS法、FRAP法評(píng)價(jià)萃取物的體外抗氧化活性,為紫莖澤蘭的開發(fā)應(yīng)用提供依據(jù)。
1 實(shí)驗(yàn)
1.1 材料、試劑與儀器
紫莖澤蘭鮮活植株,于2021年1月中旬采自大理蒼山洱海國(guó)家級(jí)自然保護(hù)區(qū)。
石油醚、乙酸乙酯、甲醇、無(wú)水乙醇、95%乙醇、VC,分析純,國(guó)藥集團(tuán)化學(xué)試劑有限公司;DPPH (1,1-二苯基-2-苦肼基),分析純,梯希愛化成工業(yè)發(fā)展有限公司;ABTS[2,2′-聯(lián)氮-雙(3-乙基-苯并噻唑-6-磺酸)二銨鹽]、 TPTZ(2,4,6-三吡啶基三嗪),分析純,上海麥克林生化科技有限公司。
AKDL-Ⅱ-24型艾柯實(shí)驗(yàn)室超純水機(jī),成都艾柯水處理設(shè)備有限公司;SB25-12DTD型超聲波清洗機(jī)、SCIENTZ-10N型冷凍干燥機(jī),寧波新芝生物科技股份有限公司;PX224ZH型電子天平,奧豪斯儀器有限公司;RE-2000A型旋轉(zhuǎn)蒸發(fā)儀,上海亞榮生化儀器廠;HWS-26型電熱恒溫水浴鍋,上海一恒科學(xué)儀器有限公司;722N型可見分光光度計(jì),上海菁華科技儀器有限公司。
1.2 紫莖澤蘭活性成分的提取
取新鮮的紫莖澤蘭葉片,用蒸餾水漂洗3次后置于實(shí)驗(yàn)臺(tái)上自然晾干,并于40 ℃下烘干至恒重后粉碎,過(guò)40目篩,裝袋中,置于4 ℃冰箱中保存,備用。
準(zhǔn)確稱取紫莖澤蘭葉干粉50 g,置于1 000 mL錐形瓶中,加入500 mL石油醚,封口膜封口,置于超聲波清洗機(jī)中,于20 ℃、40 Hz、60%功率條件下超聲萃取60 min,抽濾,濾液于40 ℃旋轉(zhuǎn)蒸發(fā)濃縮后得到萃取物浸膏,再用少量蒸餾水溶解,凍干后置于4 ℃冰箱中避光保存,備用。剩余濾渣于40 ℃烘干后,依次用乙酸乙酯和70%乙醇萃取抽濾,濃縮,凍干后置于4 ℃冰箱中避光保存,備用。
1.3 DPPH自由基清除能力的測(cè)定[16]
1.3.1 DPPH自由基工作液的配制
準(zhǔn)確稱取1.00 g DPPH粉末于棕色容量瓶中,加入無(wú)水乙醇溶解,定容至1 000 mL,搖勻,得1.00 g·L-1的DPPH自由基母液,置于4 ℃避光保存。使用時(shí),用無(wú)水乙醇將其濃度稀釋至50 mg·L-1,即為DPPH自由基工作液。
1.3.2 DPPH自由基標(biāo)準(zhǔn)曲線的繪制
避光稱取DPPH粉末1.25 g,用無(wú)水乙醇溶解并定容至50 mL,得25 g·L-1DPPH自由基母液;用無(wú)水乙醇將其稀釋成梯度濃度20 g·L-1、15 g·L-1、10 g·L-1、5 g·L-1,測(cè)定517 nm處吸光度;以DPPH自由基濃度為橫坐標(biāo)、吸光度為縱坐標(biāo),繪制DPPH自由基標(biāo)準(zhǔn)曲線[17]。
1.3.3 紫莖澤蘭萃取物DPPH自由基清除能力的測(cè)定
取萃取物干粉適量,加入甲醇將其稀釋至濃度(g·L-1)分別為1.00 、0.50 、0.25、0.125、0.062 5、0.031 25的樣品溶液;取2 mL樣品溶液,加入2 mL 50 mg·L-1DPPH自由基工作液,混勻,37 ℃水浴避光反應(yīng)30 min,測(cè)定517 nm處吸光度。以VC為陽(yáng)性對(duì)照,同時(shí)設(shè)置樣品對(duì)照和試劑空白,每個(gè)樣品重復(fù)測(cè)定6次。按式(1)計(jì)算DPPH自由基清除率:
(1)
式中:A0為2 mL甲醇+2 mL DPPH自由基工作液的吸光度;A1為2 mL樣品溶液+2 mL甲醇的吸光度;A2為2 mL樣品溶液+2 mL DPPH自由基工作液的吸光度。
1.4 ABTS自由基清除能力的測(cè)定[18]
1.4.1 ABTS自由基工作液的配制
用蒸餾水分別配制7 mmol·L-1ABTS自由基溶液和4.9 mmol·L-1K2S2O8溶液,將兩種溶液按1∶1體積比混合,避光保存12~16 h后,用無(wú)水乙醇稀釋至一定比例,靜置5 min后,測(cè)定734 nm處吸光度為0.70±0.02時(shí)即作為ABTS自由基工作液。
1.4.2 紫莖澤蘭萃取物ABTS自由基清除能力的測(cè)定
取萃取物干粉適量,加入甲醇將其稀釋至濃度(g·L-1)分別為0.25、0.125、0.062 5、0.031 25、0.015 625、0.007 812 5 的樣品溶液。取樣品溶液與ABTS自由基工作液等體積混勻,避光反應(yīng)6 min后,測(cè)定734 nm處吸光度。同時(shí),取不同濃度樣品溶液與等體積無(wú)水乙醇混合后作為對(duì)照管,取2 mL無(wú)水乙醇與等體積ABTS工作液混合后作為空白管,避光反應(yīng)6 min后測(cè)定734 nm處吸光度。同時(shí)設(shè)置樣品對(duì)照和試劑空白,每個(gè)樣品重復(fù)測(cè)定6次。按式(2)計(jì)算ABTS自由基清除率:
(2)
式中:A0為無(wú)水乙醇+ABTS自由基工作液的吸光度;A1為樣品溶液+無(wú)水乙醇的吸光度;A2為樣品溶液+ABTS自由基工作液的吸光度。
1.5 總抗氧化能力的測(cè)定[19]
1.5.1 FRAP工作液的配制
0.30 mol·L-1醋酸緩沖液:取0.80 g無(wú)水醋酸鈉,加入8.40 mL冰醋酸,定容至500 mL,用1.00 mol·L-1鹽酸溶液調(diào)節(jié)pH值至3.6。10 mmol·L-1TPTZ溶液:取TPTZ 0.078 g,用40 mmol·L-1鹽酸溶液溶解并定容至25 mL。20.00 mmol·L-1FeCl3溶液:取FeCl30.27 g,用蒸餾水溶解并定容至50 mL。
將上述溶液按10∶1∶1體積比混合后,即為FRAP工作液(現(xiàn)配現(xiàn)用)。
1.5.2 FeSO4標(biāo)準(zhǔn)曲線的繪制
準(zhǔn)確稱取FeSO4·7H2O 0.471 7 g,加入1 mL濃硫酸,用蒸餾水溶解并定容至250 mL,配制成6 mmol·L-1的FeSO4溶液;用蒸餾水稀釋成梯度濃度(mmol·L-1)為1.6、0.8、0.4、0.2、0.1的FeSO4溶液。取不同濃度FeSO4溶液各150 μL,加入FRAP工作液3.6 mL,37 ℃水浴避光反應(yīng)10 min,測(cè)定593 nm處吸光度;以FeSO4溶液濃度為橫坐標(biāo)、吸光度為縱坐標(biāo)繪制標(biāo)準(zhǔn)曲線[17]。
1.5.3 紫莖澤蘭萃取物總抗氧化能力的測(cè)定
取萃取物干粉適量,加入蒸餾水將其稀釋至濃度(g·L-1)分別為10.00、8.00、6.00、4.00、2.00、1.00、0.50、0.25的樣品溶液。取150 μL樣品溶液,加入FRAP工作液3.6 mL,37 ℃水浴避光反應(yīng)10 min,測(cè)定593 nm處吸光度。同時(shí)以去離子水為空白對(duì)照,1.0 mmol·L-1FeSO4標(biāo)準(zhǔn)溶液為陽(yáng)性對(duì)照,每個(gè)樣品重復(fù)測(cè)定6次。按式(3)計(jì)算總抗氧化能力:
(3)
式中:A1為樣品管的吸光度;A2為空白對(duì)照管的吸光度;A0為陽(yáng)性對(duì)照管的吸光度。
1.6 數(shù)據(jù)處理
比活性=IC50(VC)/IC50(樣品),比活性越大,表明抗氧化劑清除自由基的能力越強(qiáng)。
實(shí)驗(yàn)數(shù)據(jù)表示為平均值±標(biāo)準(zhǔn)偏差,使用Excel軟件繪圖,并采用SPSS26.0軟件進(jìn)行統(tǒng)計(jì)分析。
2 結(jié)果與討論
2.1 DPPH自由基清除能力
2.1.1 DPPH自由基標(biāo)準(zhǔn)曲線(圖1)
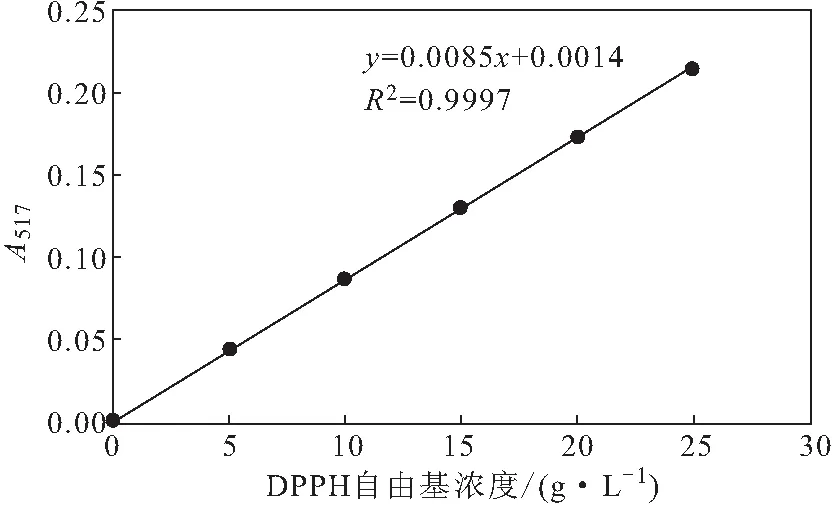
圖1 DPPH自由基標(biāo)準(zhǔn)曲線Fig.1 Standard curve of DPPH free radicals
由圖1可知,DPPH自由基標(biāo)準(zhǔn)曲線的線性回歸方程為y=0.0085x+0.0014,R2=0.9997。
2.1.2 紫莖澤蘭萃取物對(duì)DPPH自由基的清除能力(圖2)
由圖2可知,紫莖澤蘭不同溶劑萃取物均具有清除DPPH自由基的能力,且對(duì)DPPH自由基的清除率隨著萃取物濃度的增加逐漸升高。當(dāng)濃度為1.00 g·L-1時(shí),70%乙醇萃取物的清除率達(dá)95.4%,乙酸乙酯萃取物次之,石油醚萃取物最低,IC50值分別為0.074 g·L-1、0.123 g·L-1、0.232 g·L-1;與VC的比活性分別為2.03%、1.22%、0.65%(VC的IC50值為0.001 5 g·L-1)。統(tǒng)計(jì)分析顯示,70%乙醇萃取物的IC50值與石油醚和乙酸乙酯萃取物的有顯著差異(P<0.05),而石油醚和乙酸乙酯萃取物的IC50值無(wú)顯著差異。
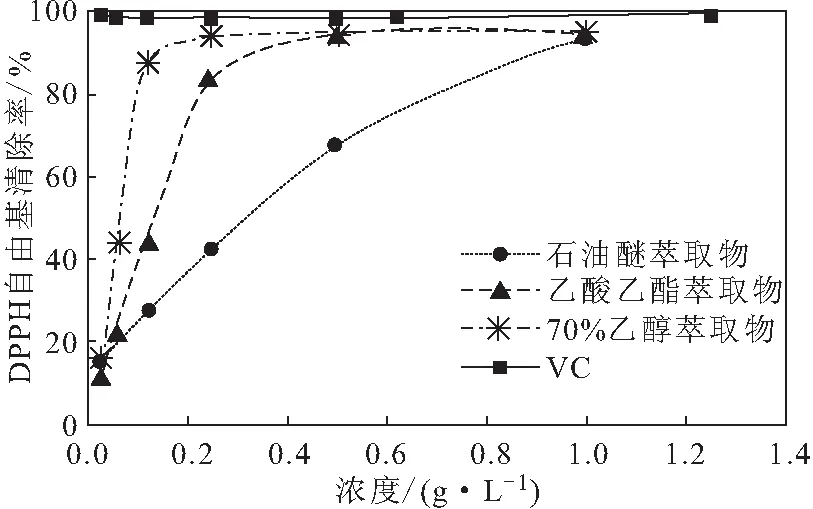
圖2 紫莖澤蘭不同溶劑萃取物對(duì)DPPH自由基的清除能力Fig.2 DPPH free radical scavenging ability of different solvent extracts of Eupatorium adenophorum Spreng
2.2 ABTS自由基清除能力
紫莖澤蘭不同溶劑萃取物對(duì)ABTS自由基的清除能力如圖3所示。

圖3 紫莖澤蘭不同溶劑萃取物對(duì)ABTS自由基的清除能力Fig.3 ABTS free radical scavenging ability of different solvent extracts of Eupatorium adenophorum Spreng
由圖3可知,紫莖澤蘭不同溶劑萃取物均具有清除ABTS自由基的能力,且對(duì)ABTS自由基的清除率隨著萃取物濃度的增加逐漸升高,呈正相關(guān)的劑量效應(yīng)。當(dāng)濃度為0.25 g·L-1時(shí),ABTS自由基清除率可達(dá)100%。70%乙醇萃取物的ABTS自由基清除率最高,石油醚萃取物次之,乙酸乙酯萃取物最低,IC50值分別為0.024 g·L-1、0.029 g·L-1、0.032 g·L-1,與VC的比活性分別為12.08%、10.00%、9.06%(VC的IC50值為0.002 9 g·L-1)。統(tǒng)計(jì)分析顯示,石油醚萃取物、乙酸乙酯萃取物、70%乙醇萃取物的IC50值無(wú)顯著差異。
2.3 FRAP總抗氧化能力(圖4、圖5)
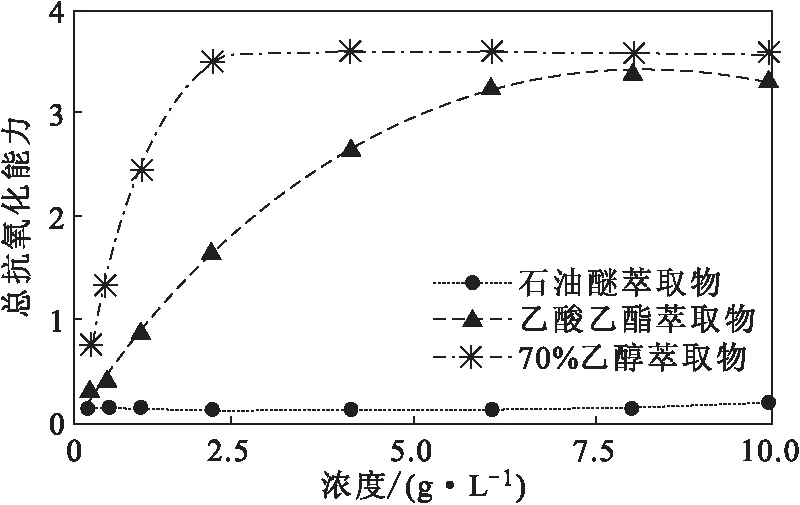
圖5 紫莖澤蘭不同溶劑萃取物的總抗氧化能力Fig.5 Total antioxidant ability of different solvent extracts of Eupatorium adenophorum Spreng
FeSO4標(biāo)準(zhǔn)曲線(圖4)的線性回歸方程為y=0.6012x+0.0429,R2=0.9937。
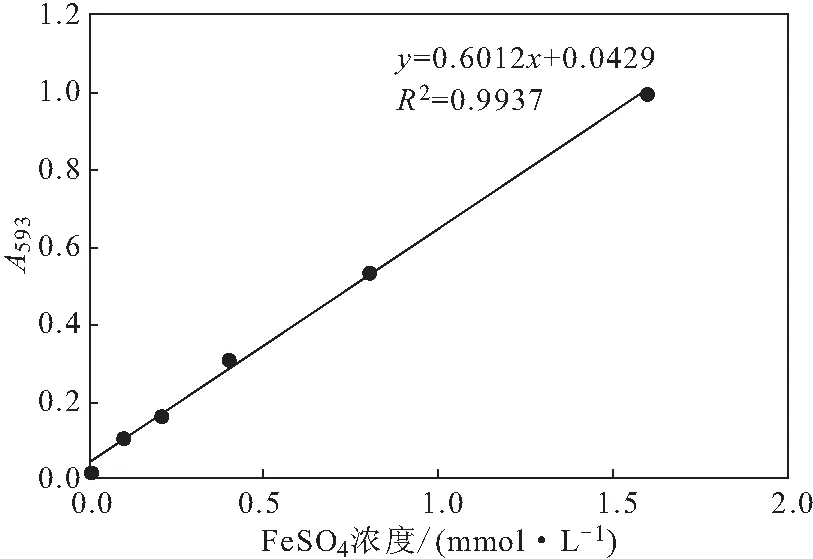
圖4 FeSO4標(biāo)準(zhǔn)曲線Fig.4 Standard curve of FeSO4
由圖5可知,紫莖澤蘭不同溶劑萃取物的總抗氧化能力存在差異。當(dāng)濃度為2.00 g·L-1時(shí),70%乙醇萃取物的總抗氧化能力最強(qiáng)(FRAP值3.47 ± 0.01),其次為乙酸乙酯萃取物(FRAP值1.65 ± 0.07),石油醚萃取物最弱(FRAP值0.11 ± 0.01)。統(tǒng)計(jì)分析顯示,70%乙醇萃取物的FRAP值與石油醚和乙酸乙酯萃取物的有顯著差異(P<0.05),而石油醚和乙酸乙酯萃取物的FRAP值無(wú)顯著差異。
2.4 討論
已有關(guān)于外來(lái)入侵物種水葫蘆的抗氧化性研究[20-21],其具有藥用價(jià)值和經(jīng)濟(jì)價(jià)值,可制成家畜飼料[22]、造紙?jiān)蟍23]等,現(xiàn)在水葫蘆在中國(guó)的危害已經(jīng)通過(guò)變害為寶得到了根治。
胡楚嬌等[15]研究發(fā)現(xiàn),紫莖澤蘭70%乙醇萃取物的DPPH自由基清除能力的IC50值為0.3 g·L-1,與之相比,本實(shí)驗(yàn)中紫莖澤蘭70%乙醇萃取物的DPPH自由基清除能力更好,IC50值為0.074 g·L-1。究其原因,一方面是活性成分的提取方法不同:本實(shí)驗(yàn)采用20 ℃超聲萃取后再于40 ℃旋蒸濃縮得到活性成分,而胡楚嬌等[15]采用的是冷浸超聲2次后于70~85 ℃高溫回流的方法,高溫處理可能會(huì)破壞活性成分,不利于提取。另一方面,也有可能是所選取的DPPH自由基工作液濃度不同:本實(shí)驗(yàn)選用了50 mg·L-1DPPH自由基工作液,而胡楚嬌等選用的是20 mg·L-1。根據(jù)DPPH自由基清除實(shí)驗(yàn)原理及IC50值的計(jì)算方法可知,DPPH自由基工作液濃度設(shè)定的不同會(huì)導(dǎo)致測(cè)定結(jié)果IC50值的不一致,而是否可以通過(guò)DPPH自由基工作液濃度進(jìn)行IC50值的換算后進(jìn)行橫向比較,還有待驗(yàn)證。迄今為止,通過(guò)比較DPPH、ABTS、超氧陰離子等自由基的清除效果來(lái)評(píng)估抗氧化活性的方法被廣泛應(yīng)用,但所用自由基工作液濃度卻不盡相同,由此導(dǎo)致研究得出的結(jié)果難以進(jìn)行橫向比較。因此,應(yīng)建立一套標(biāo)準(zhǔn)的體外抗氧化實(shí)驗(yàn)的評(píng)估方法,以便于天然抗氧化產(chǎn)物的篩選[24]。
3 結(jié)論
分別使用石油醚、乙酸乙酯、70%乙醇等3種不同極性溶劑萃取紫莖澤蘭葉的有效成分,通過(guò)DPPH法、ABTS法、FRAP法評(píng)價(jià)萃取物的體外抗氧化活性。結(jié)果表明,紫莖澤蘭3種萃取物均有一定的抗氧化活性,其中70%乙醇萃取物對(duì)DPPH自由基和ABTS自由基的清除能力及總抗氧化能力最強(qiáng),IC50值分別為0.074 g·L-1、0.024 g·L-1, FRAP值為3.47±0.01。3種萃取物均具有抗氧化活性,說(shuō)明紫莖澤蘭具有良好的抗氧化活性,可作為天然抗氧化劑的開發(fā)原料。今后將進(jìn)一步探究紫莖澤蘭抗氧化的有效化學(xué)成分、體內(nèi)抗氧化應(yīng)激和抗氧化炎癥能力及其安全性。

