射干抗肝癌活性生物堿成分的虛擬篩選研究
孫陽(yáng),李松哲,孫悅,姜德友
(黑龍江中醫(yī)藥大學(xué)基礎(chǔ)醫(yī)學(xué)院,黑龍江 哈爾濱 150040)
肝細(xì)胞癌(HCC)是癌癥疾病中致死率極高的癌種,現(xiàn)代研究普遍認(rèn)為慢性肝炎或肝硬化的發(fā)展可導(dǎo)致肝癌的形成[1-2]。由于肝實(shí)質(zhì)上沒有痛覺神經(jīng)的分布,當(dāng)觸及肝被膜引起疼痛時(shí)可能已經(jīng)達(dá)到中晚期,且肝臟承擔(dān)凈化血液的作用,極易受到其他臟器癌癥的侵襲,以上原因直接導(dǎo)致手術(shù)治療范圍有限,往往只局限于沒有血管侵犯或結(jié)節(jié)或遠(yuǎn)處轉(zhuǎn)移的孤立性腫瘤,而且,即使在術(shù)后,生存期也并不理想[3-4]。中醫(yī)藥的發(fā)展歷史悠久,無(wú)論單味藥還是組方在抗腫瘤實(shí)驗(yàn)與臨床中皆能看到較好的療效。
射干是鳶尾科植物,干燥根莖入藥,具有清熱解毒的功效,為苦寒之性[5],苦味自有堅(jiān)陰之功,可清泄邪熱而護(hù)陰津[6],肝為剛臟,受癌疾所累易化風(fēng)化火,故初期常見昏朦、發(fā)熱,與射干之品性相配。在現(xiàn)代實(shí)驗(yàn)分析中,也有數(shù)據(jù)表明射干在諸如肺癌[7]、卵巢癌[8]、結(jié)腸癌[9]和前列腺癌[10]中具有明顯的抑制作用,其組方鱉甲煎丸也被證明對(duì)肝癌的抑制明顯[11]。但射干抗肝癌的物質(zhì)藥效基礎(chǔ)和靶點(diǎn)蛋白通路尚不明確,故本文基于此,通過搜集射干有效活性成分與肝癌的核心靶點(diǎn)進(jìn)行分子對(duì)接,希望為之后的實(shí)驗(yàn)研究提供方向。分子對(duì)接是近年來藥物靶點(diǎn)構(gòu)效關(guān)系和藥物分子設(shè)計(jì)研究的一種有效手段,將已知的配體小分子放到受體活性位點(diǎn),通過變化配體小分子構(gòu)象,采取化學(xué)環(huán)境、幾何和能量互補(bǔ)的原則,評(píng)價(jià)配體小分子與受體互相作用強(qiáng)弱和結(jié)合能力,尋找配體小分子與受體蛋白的最佳構(gòu)象并計(jì)算結(jié)合自由能[12]。
1 材料與方法
1.1 射干有效成分的搜集
通過TCMSP[13](Traditional Chinese Medicine Systems Pharmacology Database andAnalysis Platform)數(shù)據(jù)庫(kù)搜尋射干的活性成分,并根據(jù)口服生物利用度(oral bioavailability,OB)≥30% 和類藥性(drug-likeness,DL)≥0.18這2個(gè)ADME屬性值進(jìn)行活性成分篩選,共獲得活性小分子17個(gè),再通過文獻(xiàn)檢索,搜尋被過濾掉的重要小分子或未被收錄的小分子,最終得到鳶尾黃素和次野鳶尾黃素2個(gè),共計(jì)19個(gè)小分子,分子結(jié)構(gòu)及編號(hào)見圖1。

圖1 射干中的生物堿結(jié)構(gòu)及編號(hào)
1.2 肝癌關(guān)鍵靶點(diǎn)的搜集
以“l(fā)iver cancer”為肝癌的關(guān)鍵詞,挖掘GeneCards數(shù)據(jù)庫(kù)(https://www.genecards.org)中治療肝癌的潛在靶點(diǎn),取前10個(gè)相關(guān)性最高的靶點(diǎn)(2020年12月下載),去除無(wú)明確晶體結(jié)構(gòu)蛋白、無(wú)明確臨床用藥或批準(zhǔn)的實(shí)驗(yàn)用藥蛋白,最終得到靶基因受體7個(gè)。分別是BRCA1、TP53、MSH2、PTEN、MLH1、EGFR和TNF,再通過RCSB PDB數(shù)據(jù)庫(kù)(http://www.rcsb.org/) 下載這些靶基因?qū)?yīng)的蛋白晶體結(jié)構(gòu),PDB編號(hào)及靶點(diǎn)肝癌相關(guān)性見表1。

表1 陽(yáng)性對(duì)照物PDB編號(hào)及肝癌相關(guān)性
1.3 陽(yáng)性對(duì)照化合物的搜集
通過GeneCards數(shù)據(jù)庫(kù)搜索作用靶基因蛋白的小分子藥物,以得到正式認(rèn)可的藥物為優(yōu)先考慮,若無(wú)正式認(rèn)可的藥物則采用已批準(zhǔn)的臨床實(shí)驗(yàn)性或研究性藥物,再與Drug Bank數(shù)據(jù)庫(kù)進(jìn)行比對(duì)確認(rèn),之后通過Zinc15數(shù)據(jù)庫(kù)[14]檢索陽(yáng)性對(duì)照化合物名稱,下載mol2文件,分子結(jié)構(gòu)及對(duì)應(yīng)靶基因信息見圖2。

圖2 陽(yáng)性對(duì)照物小分子及對(duì)應(yīng)靶基因
1.4 分子對(duì)接軟件及前期準(zhǔn)備
分子對(duì)接軟件采用autodockTools 1.5.6中的vina模塊[15],其中根據(jù)vina報(bào)道,經(jīng)vina處理的分子-靶點(diǎn)對(duì)接結(jié)果中,RMSD<2的比例高達(dá)78%,RMSD<2被認(rèn)為對(duì)接方案可行,故通過vina的分子對(duì)接預(yù)測(cè)可以被認(rèn)為可行性、準(zhǔn)確性較高。將射干、陽(yáng)性對(duì)照組小分子和靶點(diǎn)蛋白通過去除水分子,加氫進(jìn)行預(yù)處理,采用盲性對(duì)接法實(shí)行預(yù)測(cè),其余參數(shù)均采用默認(rèn)值,得到預(yù)測(cè)結(jié)果,結(jié)果以生成氫鍵的數(shù)值為優(yōu)先,以陽(yáng)性對(duì)照物所得的結(jié)合自由能為基準(zhǔn),低于陽(yáng)性對(duì)照物且生成氫鍵的小分子的自由能數(shù)值加粗表示,若小分子已經(jīng)低于對(duì)照組的結(jié)合自由能,卻還未生成氫鍵模型,則收錄最小值,在數(shù)值后用“*”標(biāo)出。
2 結(jié)果
2.1 陽(yáng)性對(duì)照物與對(duì)應(yīng)靶基因蛋白分子對(duì)接
通過Vina對(duì)接得出結(jié)合自由能,所得結(jié)果皆以生成氫鍵為基準(zhǔn),單位為kcal·mol-1,結(jié)合自由能數(shù)值見表2。
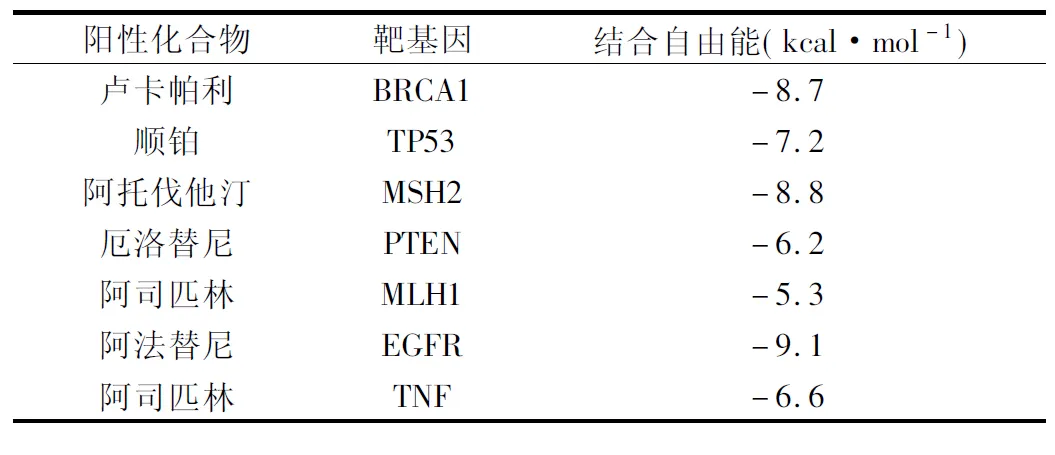
表2 陽(yáng)性對(duì)照物與對(duì)應(yīng)靶基因蛋白對(duì)接結(jié)果
2.2 綜合對(duì)接結(jié)果
將圖1與表1所示的小分子與蛋白質(zhì)一一進(jìn)行對(duì)接,共得出133組對(duì)接結(jié)果,以陽(yáng)性對(duì)照物分子對(duì)接數(shù)值為基準(zhǔn),結(jié)合自由能單位為kcal·mol-1,候選化合物與各靶基因蛋白作用情況見表3。
依據(jù)表3所得數(shù)據(jù),可視化每組靶基因蛋白中與小分子的最優(yōu)對(duì)接結(jié)果,并利用VMD軟件可視化原配體與配體對(duì)接構(gòu)象疊合圖,見圖3。

表3 候選化合物與各靶基因蛋白作用情況
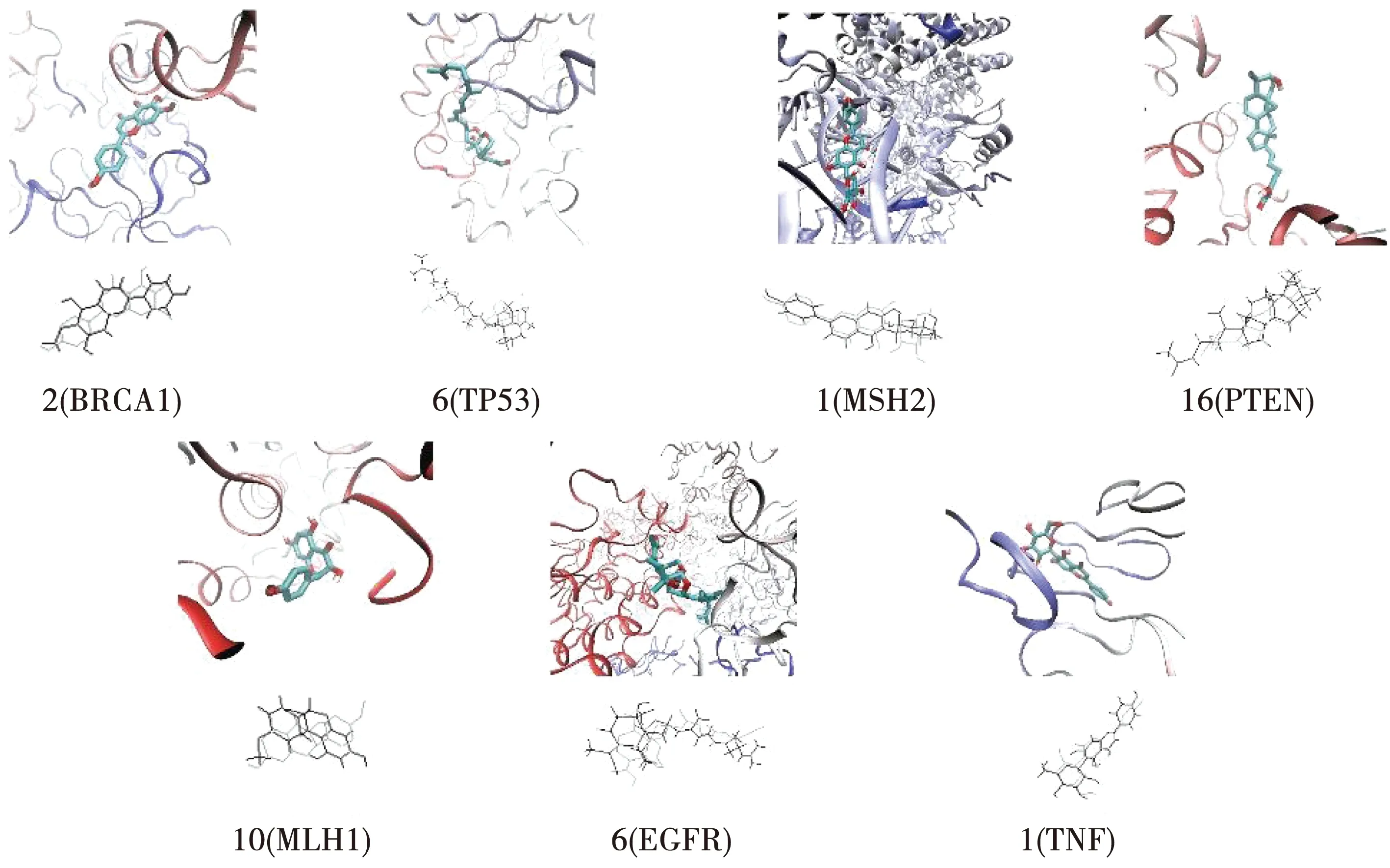
圖3 潛力小分子與靶基因蛋白對(duì)接構(gòu)象及與原配體疊合圖
3 討論
通過分析以上對(duì)接數(shù)據(jù),與肝癌極為密切的7個(gè)靶基因蛋白中,射干有效活性成分對(duì)TP53、MSH2、PTEN、MLH1和TNF皆表現(xiàn)出優(yōu)于陽(yáng)性對(duì)照物的結(jié)合能力,在BRCA1與EGFR中的結(jié)合自由能雖未低于陽(yáng)性對(duì)照物,但皆小于-1.2 kcal·mol-1,而對(duì)接結(jié)合自由能小于1.2 kcal·mol-1通常被認(rèn)為對(duì)接良好,所以可以預(yù)測(cè)出射干對(duì)肝癌的主要靶基因具有良好的作用效果。其中1號(hào)和6號(hào)小分子表現(xiàn)出較為突出的、普遍性的抗肝癌作用,分別是異牡荊素(Isovitexin)和鳶尾醛型新三萜(Anhydrobelachinal)。
在近期的實(shí)驗(yàn)中,發(fā)現(xiàn)Isovitexin可以通過基因調(diào)節(jié)抑制肝細(xì)胞癌(HCC)[16],下調(diào)錳超氧化物歧化酶(MnSOD)和叉頭盆蛋白質(zhì)M1(FoxM1)而降低HCC中干樣細(xì)胞(HCSLC)的干性而起到抗癌作用,并在肺癌研究中也發(fā)現(xiàn)了類似的情況,還發(fā)現(xiàn)可以抑制EMT表型及MMP2的表達(dá)[17-18]。CHEN和LIU等人也發(fā)現(xiàn),Isovitexin可以增強(qiáng)體內(nèi)TNF-α的產(chǎn)生或抑制腎臟內(nèi)TNF-α和IL-6的產(chǎn)生而起到保護(hù)腎臟的功能,既可以有效防止因順鉑導(dǎo)致的腎損傷,又可以增強(qiáng)順鉑的抗腫瘤活性[19-20]。Anhydrobelachinal目前的抗腫瘤證據(jù)較少,主要是發(fā)現(xiàn)Anhydrobelachinal的半抑制濃度(IC50)在0.1~5.3 microg/mL時(shí)對(duì)人類腫瘤細(xì)胞系A(chǔ)2780和K562具有一定的細(xì)胞毒性[21],這被認(rèn)為具有抗腫瘤作用[22],其具體機(jī)理還有待進(jìn)一步探索。
還需注意的是,基因突變是導(dǎo)致癌癥產(chǎn)生的重要因素,而在本次預(yù)測(cè)模型中,MSH2與MLH1是參與DNA錯(cuò)配修復(fù)途徑的重要組成部分,在多項(xiàng)研究中皆發(fā)現(xiàn)MSH2與MLH1的突變或丟失導(dǎo)致了一定比例的癌癥,因基因錯(cuò)配導(dǎo)致不匹配識(shí)別使下游基因異常表達(dá)[23-25],且MLH1/MSH2基因的低甲基化也被認(rèn)為在癌癥的化學(xué)耐受性中尤為重要[26]。而射干中的大量小分子在與MSH2和MLH1的結(jié)合中表現(xiàn)出良好的結(jié)合能力,低于陽(yáng)性對(duì)照組且生成氫鍵的比例分別為68.4%和89.4%,所以也可初步推測(cè)射干可以通過DNA錯(cuò)配修復(fù)途徑影響肝癌的發(fā)生發(fā)展。
4 結(jié)論
本實(shí)驗(yàn)對(duì)射干抗腫瘤進(jìn)行了虛擬篩選,選取了7個(gè)與肝癌相關(guān)性極為密切的靶基因,從現(xiàn)有的56個(gè)生物堿中篩選出19個(gè)潛在活性成分,1號(hào)和6號(hào)小分子通過篩選模擬被認(rèn)為抗肝癌潛力突出,且在實(shí)驗(yàn)中已經(jīng)被證明具有一定抗癌活性,與本實(shí)驗(yàn)結(jié)論相符。其中,多數(shù)活性生物堿與MSH2和MLH1具有良好的結(jié)合能力,所以可以推測(cè),射干可能主要通過DNA錯(cuò)配修復(fù)途徑影響肝癌的發(fā)展,或在肝癌的化學(xué)藥物治療中,對(duì)提高抗藥性具有一定積極作用。

