SHP2抑制劑PHPS1通過調節MAPK通路對ApoE基因敲除小鼠動脈粥樣硬化斑塊的影響
帖彥清 霍麗靜 馬倩 趙培 于悅卿 路永剛 于芳
動脈粥樣硬化是心腦血管發病的病理基礎。其中,脂質代謝異常和炎性損傷是導致動脈粥樣硬化的主要誘因[1,2]。因此,改善動脈粥樣硬化患者體內的脂質代謝和阻止炎性因素進一步損傷是改善動脈粥樣硬化形成的主要方法。目前,針對動脈粥樣硬化的治療主要為應用降脂藥物,但因其具體發病機制尚未完全清楚,故降脂并不能從根本上治愈動脈粥樣硬化引起的心腦血管疾病。絲裂原活化蛋白激酶(MAPK)是引起細胞生物學反應所必需的一類重要的信號通路,可調控多種心腦血管疾病的發病過程,其主要包括C-Jun氨基末端激酶(JNK)、p38及細胞外信號調節激酶(ERK)[3]。相關研究表明,MAPK參與內皮細胞的激活、泡沫細胞的形成、內皮祖細胞的凋亡和多種促動脈粥樣硬化細胞因子的表達[4]。PHPS1(phenyl hydrazonopyrazolone sulfonate1)是一種具有細胞滲透性的SHP2抑制劑,能夠有效抑制SHP2磷酸化并阻斷其參與的細胞活動和疾病進程[5]。已有的相關研究表明,PHPS1可通過抑制p-SHP2和p-ERK蛋白的表達,進而減少病變肺部中性粒細胞及巨噬細胞的浸潤,最終改善實驗小鼠的肺炎癥狀[6]。那么,PHPS1在動脈粥樣硬化中發揮什么作用,它是否可調控動脈粥樣硬化炎性因子的釋放,筆者發現相關研究較少。因此,本研究以ApoE-/-小鼠為研究對象,探討PHPS1對ApoE-/-小鼠動脈粥樣硬化的作用及作用機制,以期為臨床提供一種新的治療靶點。
1 材料與方法
1.1 實驗動物及處理方法 將8周齡雄性C57BL/6J-ApoE-/-小鼠(動物合格證號:201721850)隨機選取10只作為對照組,不做其他特殊處理,其余小鼠對其進行6周的高脂飼料喂養建立動脈粥樣硬化模型,建模成功后將其隨機分為模型組(腹腔注射0.9%氯化鈉溶液3 mg·kg-1·d-1,n=10)和PHPS1組(腹腔注射PHPS1劑量3 mg·kg-1·d-1,n=10),同時對照組也給予腹腔注射0.9%氯化鈉溶液3 mg·kg-1·d-1,1次/d,持續20 d。
1.2 實驗細胞來源及分組 小鼠巨噬細胞RAW264.7購自美國ATCC公司。將RAW264.7細胞培養于含10%胎牛血清、1%青鏈霉素DMEM培養基,37℃、5% CO2細胞培養箱內培養。待RAW264.7細胞生長達到80%時,根據培養基中加入的成分不同將RAW264.7分為3組,即對照組(未予特殊處理的DEME培養基)、模型組(給予ol-LDL處理的DEME培養基)及PHPS1組(同時給予ol-LDL和PHPS1處理的DEME培養基)。
1.3 實驗材料與儀器 p-PI3K、p-AKT、p-mTOR均購自abcam公司;DMEM/高糖培養基、PBS緩沖液、胰蛋白酶購自美國Hyclone公司;胎牛血清購自美國GIBCO公司;組織包埋機(型號:EG11508)、石蠟切片機型號(型號:RM2135)均購自Leica公司;熒光倒置顯微鏡(型號:Axio Vert A1)購自德國Carl Zeiss Jena;Western Blot用電泳槽(型號:DYCZ-24DN型)、轉移電泳儀(型號:DYY-7B型)及恒溫循環器(型號:WD-9412A型)均購自北京六一生物科技有限公司;全自動凝膠成像系統(型號:8845-S型)購自美國Bio-rad公司;電子天平(型號:MP200A型)購自上海精科儀器廠;制冰機(型號:SIM-F124型)購自日本5ANY0有限公司;全自動生化分析儀(型號貝克曼5800,美國貝克曼公司);酶標儀(型號 ELX800,北京Bio-Tek公司)等相關試劑及儀器。
1.4 動物實驗方法
1.4.1 全自動生化儀檢測小鼠體內TG、TC、HDL-C及LDL-C的表達水平:小鼠腹主動脈取血后放入離心機內3 500 r/min 離心 25 min,獲得血清后采用全自動生化分析儀檢測3組小鼠血清中TG、TC、HDL-C及LDL-C的表達水平。
1.4.2 Movat染色評估主動脈根部斑塊面積:取小鼠主動脈根部血管制成石蠟切片,常規脫臘至水后行Movat染色,顯微鏡下評估動脈斑塊大小,數據通過Image Pro Plus-6軟件(Media Cybernetics,Inc.)進行分析。
1.4.3 Western blot檢測3組p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表達水平:將上述所取主動脈根部組織研磨提取蛋白后,進行WB檢測,聚丙烯酰胺凝膠電泳 (SDS-PAGE) 電泳分離蛋白后再轉膜至PVDF膜上,5%脫脂奶粉封閉2 h,4℃冰箱中一抗孵育過夜,PBST充分洗滌后加入相應二抗(ab97080)室溫孵育1 h,ECL顯色,化學發光凝膠成像系統中顯影,IPP 6.0軟件行灰度掃描分析,以GAPDH為內參校正目的蛋白表達量。
1.5 細胞實驗方法 Western blot檢測3組RAW264.7細胞p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白水平:將上述各組細胞研磨提取蛋白后,進行Western blot檢測,聚丙烯酰胺凝膠電泳 (SDS-PAGE) 電泳分離蛋白后再轉膜至PVDF膜上,5%脫脂奶粉封閉2 h,4℃冰箱中一抗孵育過夜,PBST充分洗滌后加入相應二抗(ab97080)室溫孵育1 h,ECL顯色,化學發光凝膠成像系統中顯影,IPP 6.0 軟件行灰度掃描分析,以GAPDH為內參校正目的蛋白表達量。
2 結果
2.1 體內實驗結果
2.1.1 全自動生化儀檢測小鼠體內TG、TC、HDL-C及LDL-C的表達水平:全自動生化儀結果顯示,模型組小鼠中TG、TC及LDL-C表達最高,HDL-C 表達最低,其次依次為PHPS1組、對照組,差異均有統計學意義(P<0.05)。見表1。

表1 血脂水平比較
2.1.2 Movat染色評估主動脈根部斑塊面積:Movat染色結果顯示,PHPS1組主動脈根部顯示斑塊面積較對照組和模型組明顯減小,模型組斑塊較對照組明顯增加,差異均有統計學意義(P<0.05),對照組動脈粥樣硬化斑塊較少,可忽略。對照組內膜未見增厚,基本沒有泡沫細胞及斑塊,模型組的內膜明顯增厚且伴有大量的泡沫細胞聚集及炎性細胞浸潤,中膜細胞的排列紊亂,PHPS1組的內膜增厚程度較模型組明顯減輕并且泡沫細胞聚集及炎性細胞浸潤明顯。見表2,圖1。
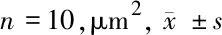
表2 主動脈根部斑塊面積比較
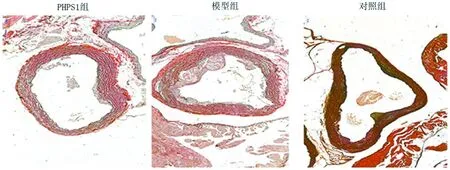
圖1 主動脈根部的斑塊面積(Movat染色×40)
2.1.3 Western blot檢測3組p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表達水平:Western blot檢測結果顯示,模型組p-SHP2、p-JNK、p-p38 MAPK及p-ERK的蛋白表達水平最高,其次依次為PHPS1組、對照組的p-SHP2、p-JNK、p-p38 MAPK及p-ERK的蛋白表達水平,差異均有統計學意義(P<0.05)。見表3,圖2。

表3 組織中p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表達水平

圖2 Western blot檢測組織中p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表達水平
2.2 細胞實驗結果 Western blot檢測3組細胞p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白水平:Western blot檢測結果顯示,模型組p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表達水平最高,其次依次為PHPS1組、對照組,3組間4種指標比較差異均有統計學意義(P<0.05)。見圖3,表4。

圖3 Western blot檢測細胞中p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白水平

表4 細胞中p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表達水平
3 討論
動脈粥樣硬化是老年人最常見的死亡原因之一。動脈粥樣硬化的主要病變的特征是脂質在動脈部分沉積,并伴有平滑肌細胞和纖維基質增生,并逐漸發展成動脈粥樣硬化斑塊的形成[7]。動脈粥樣硬化通常被認為是一種慢性炎癥性疾病,其相關炎癥是由促炎細胞因子、炎癥信號通路、生物活性脂質和粘附分子共同介導的[8]。由于動脈粥樣硬化發生機制尚未完全清楚,故并不能從根本上治愈動脈粥樣硬化引起的心腦血管疾病。因此,本研究以MAPK促炎信號通路為線索,通過應用SHP2抑制劑PHPS1觀察對ApoE-/-小鼠動脈粥樣硬化斑塊的影響。
SHP2(Src homology 2 domain-containing protein tyrosine phosphatase)是蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTP)家族成員之一,由PTPN11基因編碼在人類細胞和組織中廣泛表達,主要有2個酪氨酸磷酸化結合位點SH2結構域和1個具有催化功能的PTP結構域構成[9]。SHP2參與多種細胞信號的調節作用。相關研究表明,SHP2可通過相關信號通路調控巨噬細胞炎性反應和細菌清除中的作用。PHPS1是一種針對SHP2特異性抑制劑,可有效抑制SHP2磷酸化并阻斷其參與的細胞活動和疾病進程[10,11]。
本研究發現給予PHPS1治療后ApoE-/-小鼠動脈粥樣硬化斑塊面積明顯減小且小鼠體內炎性因子的表達水平同樣明顯降低。既往研究顯示,PHPS1能夠抑制炎性反應、減輕或延緩AS的發生[6]。
絲裂原活化蛋白激酶(MAPK)信號通路是細胞中一條重要的分子通路,MAPK由多種同工酶組成,包括ERK,JNK和p38 MAPK[12]。JNK 通路和 p38 MAPK 通路主要對炎性細胞因子和多種類型的細胞應激信號進行轉導,而ERK通路主要對細胞的生長、分裂和分化信號進行轉導,他們之間可以通過不同因素刺激激活,形成不同的轉導通路,激活不同的轉錄因子,介導不同的生物學效應,通路間可產生相互協同或抑制作用[13-16]。
活化的p38能促進細胞表達分泌炎性因子,而JNK能被TNF-α和IL-1β等炎性因子激活;ERK1/2有促進炎性細胞因子表達的作用,并與細胞增殖、轉化和分化密切相關[17-19]。動物實驗及細胞實驗研究發現,模型組WB檢查提示p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表達明顯升高且斑塊面積明顯增大,說明MAPK信號通路可促進ApoE-/-小鼠動脈粥樣硬化的形成。
給予PHPS1藥物治療后,動物實驗及細胞實驗WB結果均提示p-SHP2、p-JNK、p-p38 MAPK及p-ERK蛋白的表達明顯降低且斑塊面積明顯減小,說明PHPS1可通過抑制MAPK信號通路從而抑制炎性因子的釋放,最終抑制動脈粥樣硬化的形成。給予PHPS1藥物治療后,小鼠體內TG、TC及LDL-C明顯下降,HDL-C表達明顯上升。既往研究同樣表明,其余干預因素作用于MAPK信號通路后即可引起小鼠體內TG、TC及LDL-C表達的下降,HDL-C表達的上升[4,20,21]。說明MAPK信號通路可調節小鼠體內脂質的代謝狀態。
綜上所述,SHP2抑制劑PHPS1通過下調MAPK信號通路從而抑制ApoE-/-小鼠動脈粥樣硬化斑塊的形成。

