茶樹油對三種常見致病菌的體外抑菌活性研究
王桂榮,趙晨棟,王 萌,范碧玥,馬小燕,安志霞,趙鳳舞*
(1.甘肅農(nóng)業(yè)大學(xué),甘肅 蘭州 730070;2.蘭州職業(yè)技術(shù)學(xué)院,甘肅 蘭州 730070)
茶樹油主要通過蒸餾,從各種桃金娘科白千層屬植物的葉子中提煉而來,原產(chǎn)于澳洲,主要有揮發(fā)油、三萜等成分,芳香氣味,還含有一些鞣質(zhì)、脂肪酸和脂類化合物等[1],具有廣譜抗微生物的效果以及保健作用[2-5],是能夠用于替代抗生素、緩解微生物耐藥現(xiàn)狀的一種天然的、優(yōu)良的抗菌劑,且無毒害[6-7],已在多個領(lǐng)域得到廣泛應(yīng)用[3]。金黃色葡萄球菌(Staphyloccus aureus)是一種重要的病原菌[6]。沙門氏菌(Salmonella)是食物中毒事件的主要致病菌之一[7]。大腸埃希氏菌(Escherichia coli)通稱為大腸桿菌,寄居在動物腸道中,可以導(dǎo)致動物發(fā)生疾病,且具有多重耐藥性[8]。目前,微生物的耐藥性由于抗生素的濫用而逐年增強,因此尋找能夠代替抗生素、且對微生物敏感度高、不易使微生物產(chǎn)生耐藥性的抑菌物非常重要。本試驗選用金黃色葡萄球菌、沙門氏菌和大腸桿菌作為供試菌,茶樹油作為抑菌劑,進(jìn)行茶樹油體外抑菌試驗,測定茶樹油抑菌活性。同時通過分光光度法測定1.5×108cfu/ml(相當(dāng)于0.5麥?zhǔn)媳葷針?biāo)準(zhǔn))的菌懸液[9]在600 nm波長處的光密度值(optical density,OD),用OD值表示細(xì)菌菌懸液濃度,以驗證茶樹油對所選用的3種供試菌的抑制敏感度以及對其最小抑菌濃度(Minimal Inhibitory Concentration,MIC)。
1 材料與方法
1.1 材料
1.1.1 菌種 金黃色葡萄球菌(ATCC25923),沙門氏菌(CMC50115),大腸埃希氏菌(ATCC25922),菌種保存于甘肅農(nóng)業(yè)大學(xué)動物醫(yī)學(xué)院微生物實驗室。
1.1.2 試劑 蛋白胨、瓊脂粉、酵母提取物,均為生化試劑。吐溫-80溶液、氯化鈉、氫氧化鈉,均為分析純。試驗過程所用水為蒸餾水。
1.1.3 儀器與設(shè)備 紫外可見分光光度計(UV-5500),垂直層流潔凈工作臺(HCB-1300V),生化培養(yǎng)箱(HPX-Ⅱ-80),高壓蒸汽滅菌鍋(LDZH-100KBS),分析天平(Cubis Ⅱ)。
1.2 方法
1.2.1 培養(yǎng)基的配制 分別配制瓊脂液體培養(yǎng)基和固體培養(yǎng)基,配制完成后使用高壓蒸汽滅菌鍋高壓蒸汽(15 psi)滅菌20 min(1.05 kg/cm3),液體瓊脂培養(yǎng)基在高壓滅菌后,冷卻降溫放4 ℃條件下保存,以備后續(xù)制備菌懸液使用;固體培養(yǎng)基在溫度稍微冷卻后,趁熱倒平板,待冷卻凝固后使用無菌打孔器將瓊脂板做打孔處理[10],并用封口膜將平板封口后放4 ℃條件下保存,以備后續(xù)藥敏試驗使用。
1.2.2 茶樹油原液稀釋 將茶樹油原液連續(xù)采用倍比稀釋法(二倍比)處理,最終形成的茶樹油溶液分別相當(dāng)于茶樹油原液濃度×20、原液濃度×2-1、原液濃度×2-2、原液濃度×2-3、原液濃度×2-4、原液濃度×2-5、原液濃度×2-6、原液濃度×2-7、原液濃度×2-8、原液濃度×2-9。
1.2.3 供試菌菌懸液的制備 在液體培養(yǎng)基中取適量菌種溶液放于恒溫?fù)u床培養(yǎng)12~20 h,將所得菌液采用平板劃線法進(jìn)行菌種的純化分離培養(yǎng)[11],恒溫培養(yǎng)24 h后取出,用高壓蒸汽滅菌處理過的無菌接種環(huán)分別挑取長勢良好的供試菌單個菌落,分別接種于1.2.1制備的無菌瓊脂液體培養(yǎng)基,放于37 ℃恒溫?fù)u床孵育24 h。24 h后,將所得供試菌菌懸液取0.1 ml,采用倍比稀釋法連續(xù)進(jìn)行8次十倍比梯度稀釋處理,將稀釋后的菌懸液分別進(jìn)行平板涂布,并放于恒溫培養(yǎng)箱恒溫孵育過夜,之后采用平板計數(shù)法計數(shù)每個稀釋梯度平板的供試菌數(shù),計算不同稀釋度的供試菌菌懸液濃度。最終經(jīng)稀釋得到濃度為1.5×108cfu/ml的3種供試菌菌懸液,4 ℃保存,以備后續(xù)藥敏試驗使用。
1.2.4 藥敏試驗 試驗前將瓊脂板放至37 ℃恒溫培養(yǎng)箱孵育24 h,以檢測瓊脂板是否有雜菌污染。選用無污染的滅菌瓊脂板,采用平板涂布法將菌懸液均勻涂布在瓊脂培養(yǎng)基上,然后將茶樹油原液100 μl加入到提前打好的孔內(nèi)[10],隨后將其置于恒溫培養(yǎng)箱培養(yǎng)18~24 h,之后測定抑菌圈大小,并判斷茶樹油對3種供試菌的抑菌敏感度。
1.2.5 茶樹精油的最低抑菌濃度(MIC)測定采用微量肉湯稀釋法測定MIC[12]:將不同稀釋濃度的茶樹油溶液分別加至滅菌過的96孔板中,第2~11孔加不同濃度的茶樹油稀釋溶液,每孔20 μl,再每孔加菌懸液180 μl。第1孔加20 μl無菌水和180 μl液體培養(yǎng)基作空白對照;第12孔加20 μl無菌水和180 μl菌懸液作陽性對照,密封后置于37 ℃恒溫培養(yǎng)箱中孵育18~24 h后,測定OD600處的吸光度,重復(fù)3次并判斷結(jié)果。
2 結(jié)果與分析
2.1 茶樹油抑菌活性
抗生素抑菌效果判定標(biāo)準(zhǔn)[13]:最敏感級抑菌圈直徑大于15 mm,中度敏感抑菌圈直徑為10~15 mm,低度敏感抑菌圈直徑為7~9 mm,不敏感無抑菌圈。測量結(jié)果表明(表1),在3種菌中,茶樹油對金黃色葡萄球菌的抑菌活性為最敏感,對沙門氏菌、大腸桿菌均為中度敏感。

表1 茶樹油對供試菌的抑菌直徑
2.2 茶樹油最小抑菌濃度
橫坐標(biāo)為茶樹油原液稀釋倍數(shù),縱坐標(biāo)為OD600吸光度值,其最大突變區(qū)間即為茶樹油MIC濃度區(qū)間。結(jié)果表明,茶樹油對大腸桿菌、金黃色葡萄球菌、沙門氏菌抑制的突變區(qū)間分別主要發(fā)生在茶樹油原液稀釋倍數(shù)為2-3×10-1~2-2×10-1(圖1)、2-4×10-1~2-3×10-1(圖2)、2-7×10-1~2-6×10-1(圖3)區(qū)間內(nèi)。

圖1 金黃色葡萄球菌抑菌活性

圖2 沙門氏菌抑菌活性
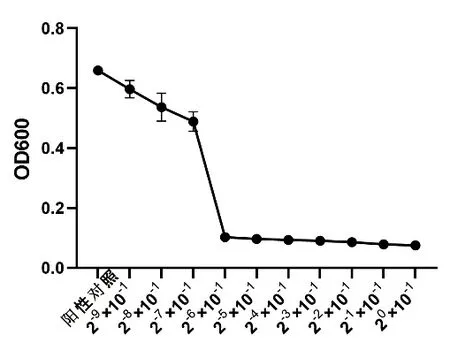
圖3 大腸桿菌抑菌活性
3 結(jié)論
在選用的3種細(xì)菌中,茶樹油對金黃色葡萄球菌的抑菌活性為最敏感,對沙門氏菌和大腸桿菌的抑菌敏感度為中度敏感。作用于金黃色葡萄球菌和沙門氏菌時,需使用高濃度茶樹油;但茶樹油在較低濃度時對大腸桿菌仍然有較好的抑制效果,因此作用于大腸桿菌時使用低濃度茶樹油即可。在抗微生物制劑方面可以考慮采用茶樹油作為原料或者添加劑來進(jìn)行制備。

